β2-微球蛋白酶联免疫分析试剂盒的研制
2012-11-12李丽波官国英刘中瑞侯惠仁梁瑞鹏
李丽波,官国英,刘中瑞,侯惠仁,梁瑞鹏
(原子高科股份有限公司,北京 102413)
β2-微球蛋白(β2-microglobin,β2-MG)是人体组织相容抗原(HLA)的一个β轻链,由淋巴细胞及有核细胞合成和分泌,相对分子质量为11 800。正常人β2-MG 的合成率及从细胞膜上的释放量相对恒定,β2-MG 可以从肾小球自由滤过,99.9%在近端肾小管吸收,并在肾小管上皮细胞中分解破坏,故而正常情况下β2-MG 的排出是很微量的。测定血清和尿液中的β2-MG可了解肾小球滤过功能以及肾小管的重吸收功能,是泌尿系统疾病中评价肾功能的灵敏指标[1]。另外,β2-MG因其能在免疫活性 细胞的识别和激活中起主要作用,也是一种肿瘤标志物,恶性血液病或其他实质性恶性肿瘤细胞能合成和分泌β2-MG,且其量超过正常细胞,使患者血清β2-MG 含量明显升高。
临床上血清β2-MG 的检测主要有以下几个方面的作用[2-5]:1)作为肾脏功能的灵敏指标,用于评价泌尿系统疾病中肾脏的功能;2)作为反映高血压和糖尿病肾脏受损的敏感指标,动态观察、诊断早期肾移植排斥反应;3)作为一种肿瘤标志物辅助诊断恶性肿瘤,评价骨髓瘤的预后及治疗效果;4)病毒感染及自身免疫性疾病时血清β2-MG 会升高。
目前临床上检测β2-MG 的方法主要有放射免疫分析法(RIA)、酶联免疫分析法(ELISA)、时间分辨荧光免疫分析法、免疫透射比浊法及增强免疫比浊法等。其中酶联免疫分析法因操作简便、检测迅速、无放射性污染、仪器设备价廉而倍受中小医院的青睐。本工作拟采用竞争法研制β2-MG 的酶联免疫分析试剂盒。
1 主要试剂和仪器
1.1 主要试剂
β2-MG:SCIPAC 公司,辣根过氧化物酶(Horseradish peroxidase,HRP)、四甲基联苯胺(TMB)、脲素过氧化氢(H2O2):美国Sigma公司;抗β2-MG 多克隆抗体:原子高科股份有限公司。正常人血清:核工业401医院检验科提供。放射免疫分析试剂盒:原子高科股份有限公司。
1.2 主要仪器
SPECTURE酶标仪:奥地利SLT公司;GAMMA-C12γ计数器:DPC 公司;PYX-DHS-60X75-BS电热培养箱:上海跃进医疗器械厂。
2 实验方法
2.1 β2-MG 酶标记物的制备
采用高碘酸钠氧化法制备β2-MG 酶标记物[6-7]。称取1.0mg HRP溶于0.1mL 双蒸水中,搅拌下加入0.1mL新鲜配制的0.06mol/L高碘酸钠(NaIO4)水溶液,4℃静置30 min;取出,搅拌下加入0.1mL 0.16mol/L的乙二醇水溶液,室温下静置30min。将1.0mg(500μL)β2-MG 的水溶液加入上述溶液中,混匀后,装入透析袋对0.05mol/L pH 9.5的碳酸盐缓冲液4℃透析过夜。次日,将溶液自透析袋取出,加入0.04 mL 新配制的NaBH4蒸馏水溶液(5g/L),混匀,4℃静置2h;取出反应液,装入透析袋对0.02 mol/L pH 7.4 的磷 酸缓冲液4℃透析过夜,取出透析液,加等体积甘油,-20℃贮存备用。
2.2 固相抗体的制备
向聚苯乙烯微量滴定板孔中按每孔200μL滴加含β2-MG 多克隆抗体的pH 9.6碳酸缓冲液,置4℃冰箱内过夜,次日取出后置37℃封闭1h,制得酶标板,用于免疫反应。
2.3 β2-MG 标准品的配制
用胎牛血清将已知浓度的β2-MG 溶液按要求依次稀释,配制成0.2、0.5、1.0、2.0、5.0和10mg/L的系列标准品,分装,冻干,4℃贮存备用。
2.4 底物溶液和终止剂
将TMB和H2O2分别溶于pH 5.0柠檬酸-磷酸缓冲液中,使其浓度分别为0.6 和1.2mmol/L,使用时以体积比1∶1混合即为底物溶液。终止剂为2mol/L H2SO4溶液。
2.5 β2-MG-ELISA分析程序
采取一步法加样程序:在包被有β2-MG 多克隆抗体的微量滴定板中按每孔20μL 滴加待测样品或标准品和每孔180μL酶标记物,混匀,37℃下温育50 min,弃反应液,用含0.05%Tween-20的洗涤液洗5次,再按每孔200μL加入底物液,避光,37℃下显色15min,以(2mol/L)H2SO4溶液按每孔50μL终止显色,于450nm处测定其光密度OD450;以标准品浓度的对数为横坐标,OD450为纵坐标,绘制标准曲线,根据标准曲线进行线性拟合从而计算样品中β2-MG 含量。
3 结果及讨论
3.1 方法学建立
3.1.1 β2-MG 酶标记物(β2-MG-HRP)滴度的选择 用含0.2%BSA 的磷酸盐缓冲液将β2-MG-HRP稀释为1∶12 000、1∶10 000、1∶8 000和1∶6 000的工作液用于β2-MG-ELISA实验,结果列于表1。表1 显示,随着滴度的增大,各标准点的OD450也随之增大,当酶标记物稀释度为1∶8 000时,标准点0.2、5、10mg/L与对应的零标准点的OD450之比均较大,说明其抑制效果较好,可以满足免疫分析的要求。因此,选择酶标记物的滴度为1∶8 000。
3.1.2 β2-MG 抗体包被浓度的选择 β2-MG抗体包被浓度分别为1.0、2.0、3.0、5.0、8.0、10.0mg/L,进行β2-MG 酶免疫分析,选择最佳β2-MG 抗体包被浓度,结果列于表2。由表2可知,当包 被浓度 为5 mg/L 时,“0“标准点的OD450值适中,加入标准品浓度为0.2mg/L 时,OD450与零标准点的OD450之比为76.2%,抑制比较明显,且此时抗体用量较少,故选择抗体包被浓度为5.0mg/L。
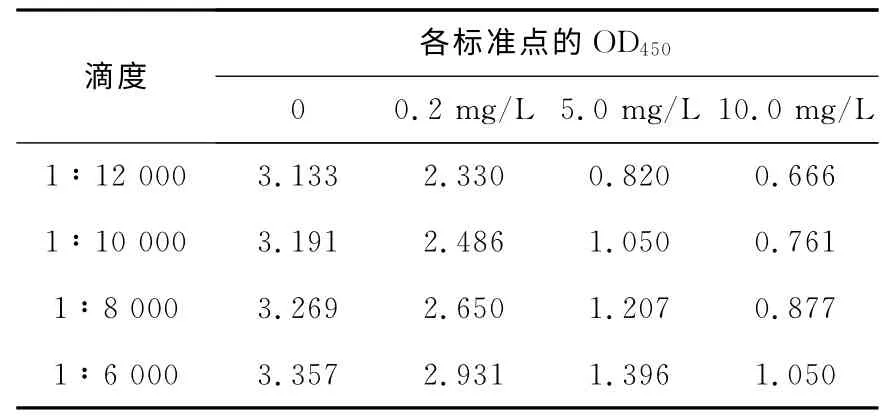
表1 β2-MG酶标记物(β2-MG-HRP)滴度的选择

表2 抗体包被浓度的选择
3.2 方法学鉴定
3.2.1 标准曲线与灵敏度 β2-MG-ELISA 标准曲线示于图1。同时测定20 个零标准的OD450,以其平均值减去2s计算其分析灵敏度为0.15mg/L。

图1 β2-MG ELISA标准曲线
3.2.2 精密度 重复测定3份含有不同β2-MG浓度的人血清样品,观察批内、批间变异,结果列于表3。表3显示,批内变异为4.1%~11.2%,批间变异为14.1%~16.0%。
3.2.3 准确性 取3份不同β2-MG 浓度的人血清样品分别加入已知浓度的β2-MG 标准品中,测定β2-MG回收率,结果列于表4。表4显示,回收率为93.3%~115.9%。
3.2.4 稀释实验 取β2-MG 含量较高的人血清样品用β2-MG 零标准进行倍比稀释,测定结果列于表5。经计算,稀释相关方程为y=4.279x-0.122 6,相关系数r=0.997 4。
3.2.5 特异性 用零标准品对高浓度的甲胎蛋白(α-fetoprotein,AFP)、铁蛋白(Ferritin,Fer)、白蛋白(Albumin,ALB)进行系列稀释(1~10mg/L),并作为样品在本系统中测定,结果列于表6。由表6 可知,Fer、ALB 在浓度低于10mg/L时无明显交叉反应,AFP 在浓度低于5mg/L时交叉较小。

表3 β2-MG-ELISA 试剂盒的批内批间变异
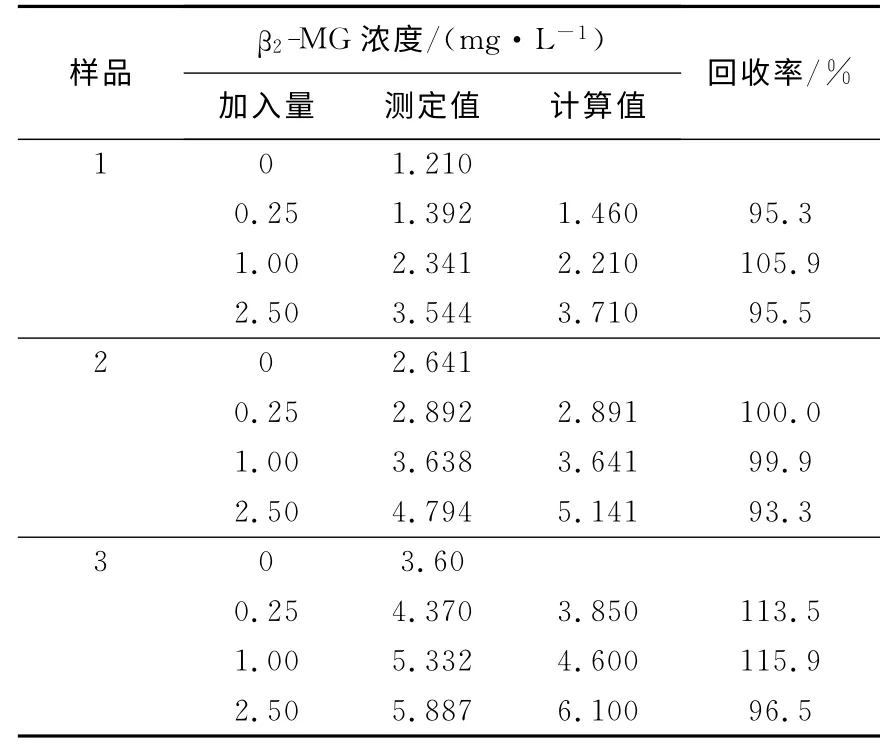
表4 β2-MG-ELISA回收实验
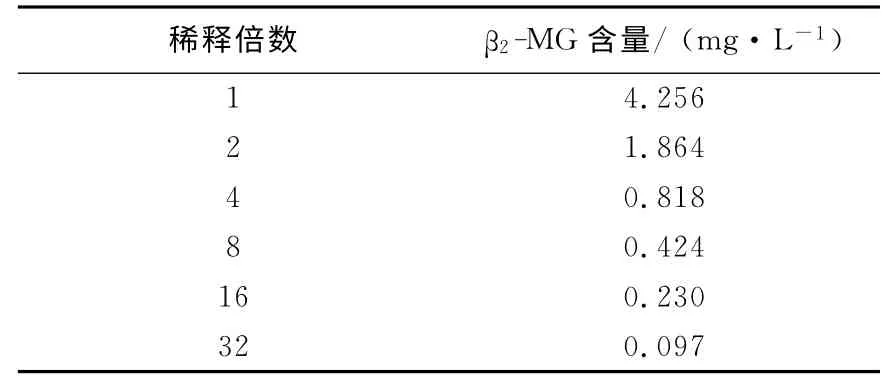
表5 样品倍比稀释实验

表6 β2-MG ELISA 交叉反应实验
3.3 方法学比较
与RIA 法同时测定59份人血清样品,测定的相关性示于图2。对图2 进行线性拟合相关方程为yELISA=1.006xRIA+0.406,r=0.900。表明本方法与RIA 法具有良好的相关性。

图2 本方法与RIA法测定的相关性
3.4 正常参考值
检测401医院检验科提供的正常人血清样品100份,测定结果低于4.5mg/L。由于所能采集到的样本数有限,只进行了初步的临床值测定,不同地区、不同实验室应通过测定建立自己的正常值参考范围。
4 小 结
本试剂盒通过条件优化实验,找到合适反应体系,建立了β2-MG 酶联免疫分析方法,方法分析灵敏度、精密度、检测范围、临床测定值达到免疫分析要求,初步完成了β2-MG-ELISA 试剂盒的研制工作,该试剂盒有望应用于临床。
[1]蔡锡麟,陈耀华,秦明秀.临床放射免疫学[M].北京:原子能出版社,1994:192-195.
[2]陈银石.β2-微球蛋白检测的临床意义[J].临床荟萃,1994,9(20):941-943.
[3]王自正.现代标记免疫学[M].北京:人民军医出版社,2000:66-67.
[4]苏丽芳.肿瘤病人血清β2-微球蛋白的测定及其临床意义[J].广州医药,1997,2(2):51.
[5]于峰,高子秀,杜秋红,等.恶性肿瘤病人血清β2-微球蛋白水平[J].齐鲁肿瘤杂志,1996,3(4):279.
[6]郭春祥,郭锡琼.介绍一种简单、快速的辣根过氧化物酶标记物酶标记抗体的过碘酸钠法[J].免疫学杂志,1983,33:97-100.
[7]官国英,刘忠瑞,李丽波,等.白蛋白酶联免疫分析试剂盒的研制[J].同位素,2010,23(3):182-185.
