国产氟多功能模块合成雌激素受体显像剂16α-[18F]氟-17β-雌二醇
2012-11-12孙传金方可元
孙传金,朱 虹,方可元
(1.南京军区南京总医院 核医学科,江苏 南京 210002;2.南京军区南京总医院 回旋加速器中心,南京江原安迪科正电子研究发展有限公司,江苏 南京 210002)
乳腺癌是女性最常见的恶性肿瘤之一,易发生转移,全世界每年约有135万妇女发病,并呈现出数量逐年上升且年轻化的趋势,严重影响妇女身心健康,并危及生命[1-2]。临床研究发现,雌二醇是通过与雌激素受体(Estrogen Receptor,ER)结合而发挥作用致病的,乳腺癌患者ER 若呈阳性,则可行内分泌治疗。免疫组化可检测组织标本的ER 表达,但有一定的局限性,其反映的只是所取病灶样本的ER 免疫活性,不一定反映该部位的ER 生物活性,更不能反映全身的情况[3]。16α-[18F]氟-17β-雌二醇(18F-FES)是雌二醇类衍生物的放射性配体,其PET/CT 显像能灵敏、准确、定量、无创伤地对原发病灶及转移病灶同时显像,可反映体内ER 表达水平、分布、密度变化及活动状态等方面的信息,这些信息对评价乳腺癌状况,预测内分泌治疗以及化、放疗等响应程度,预后评估等有重要作用。可为乳腺癌患者个性化治疗提供评价方法[4-5]。
国外相关文献[6]报道,18F-FES的合成方法有两种,一种是基于前体3,16β-二(三氟甲基磺酰)-1,3,5(10)雌甾三烯-17-酮的合成方法,该方法为低温反应,条件苛刻、产品纯化过程复杂,不适用于实验室模块化合成。另一种是以3-甲氧基甲基-16,17-O-磺酰基-表雌三醇-O-环状砜(3-O-(Methoxymethyl)-16,17-O-sulfuryl-16-epiestriol,MMSE)作为前体的合成方法[7-8],该方法的特点是反应快、反应条件易控制,适用于实验室模块化合成。本研究拟在国产氟多功能合成模块上,参考文献[7-8]的方法,以MMSE 为前体合成18F-FES。
1 主要试剂与仪器
1.1 主要试剂
3-甲氧基甲基-16,17-O-磺酰基-表雌三醇-O-环状砜(3-O-(Methoxymethyl)-16,17-O-sulfuryl-16-epiestriol,MMSE):ABX 产品;标准品FES:ABX产品;无水乙腈:Sigma-Aldrich 产品;氨基聚醚(Kryptofix 2.2.2,K2.2.2):ABX 产品;乙醇:Merck 产品;甲醇:国产色谱纯;light QMA、Sepak中性三氧化二铝柱:Waters公司;其他试剂均为国产分析纯。
1.2 主要仪器
TR19型回旋加速器:加拿大EBCO 公司;PET-MF-2V-IT-I型国产氟多功能合成模块:北京派特生物技术有限公司;高效液相色谱:美国Alltech公司;FC3200型放射检测器:美国Bioscan公司。
2 实验方法
2.1 18F-FES的合成
2.1.118F-FES 合成原理
18F-FES的化学合成工艺路线图[7]示于图1。反应历程主要包括前体MMSE 的亲核氟化反应和水解反应。
2.1.218F-FES 合成流程
PET-MF-2V-IT-I型国产氟多功能合成模块合成示意图示于图2。参考文献[7-8]报道的方法,结合国产氟多功能合成模块的结构,设计18F-FES在国产氟多功能模块上的合成流程。

图1 18F-FES化学合成工艺路线图

图2 PET-MF-2V-IT-I型氟多功能合成模块示意图
1)重氧水加入加速器靶中,经18O(p,n)18F反应生成18F-,经传输管道将18F-转移至合成模块,最终被捕获于QMA 柱上。
2)用1号瓶中的淋洗液(4mgK2CO3及17mg K2.2.2溶于1.3mL 乙腈及0.2mL水中)将QMA 柱上的18F-淋洗到反应管中;将反应管内的液体在通氮气的情况下,于115℃蒸干,除去溶剂。
3)将2号瓶中的2 mL 无水乙腈加入到反应管中,并于通氮气的条件下,于115℃蒸干,完全除去水分。
4)将3号瓶中的1mgMMSE前体溶于1mL无水乙腈中,将溶液加入到反管中,并于105℃反应15min,进行氟化反应,反应结束后冷却反应管。
5)4号瓶内的试剂(0.8mL 1mol/L 盐酸溶于7.2mL 乙腈)分三次加入到反应管中,并分别于105℃下反应6min,最后通氮气,于115℃下蒸去溶剂。
6)将5号瓶中的5mL流动相(为50%乙醇溶液(V(乙醇)∶V(水)=50∶50),流速为5mL/min),加入到反应管中清洗,再经Al2O3柱后进入到G0转移瓶中。
7)将粗品装载于LOOP 环中,启动HPLC进行纯化,纯化柱为Alltima C18柱(250mm×10.0mm,10μm),收集380~440s放射性产品,经无菌滤膜过滤后,以生理盐水稀释至产品中乙醇浓度低于10%,即得18F-FES溶液。
2.2 18F-FES鉴定
采用HPLC分析18F-FES的放化纯度,并进行紫外吸收扫描,将结果与参考文献[7-8]结果及标准品紫外吸收图谱结果相比较,鉴定18F-FES。
2.3 18F-FES质量检测
物理特性:目测法观察18F-FES 溶液外观、颜色和澄清度。化学特性:用pH 试纸测量其pH;采用HPLC测定18F-FES放化纯度,流动相为甲醇水溶液(V(甲醇)∶V(水)=60∶40),流速2 mL/min,层析柱为C-18(Waters C18,10μm,250 mm×4.6 mm),紫外波长为284nm。放射检测器为FC3200。
2.4 体外稳定性检测
18F-FES溶液室温放置,分别于1、2、3、4、6h后采用HPLC法测定其放化纯度。
3 结果与讨论
3.1 18F-FES产率
采用79GBq18F-和1mg MMSE前体在国产氟多功能合成模块密封体系中自动化合成18F-FES,最终得到18F-FES 产量为6.4 GBq。不校正合成效率为8.2%,校正合成效率为12.8%,比活度为0.165TBq/g,合成时间约为70min。
3.2 18F-FES鉴定
纯化后的18F-FES在284nm 处的紫外谱吸收峰图谱示于图3。由图3可以看出,18F-FES保留时间约为10min,此结果均与文献[7-8]及标准品一致,初步鉴定合成产物为18F-FES。

图3 18F-FES在284nm 处紫外吸收峰图谱
3.3 18F-FES质量检测
18F-FES溶液为无色透明,pH6~7。HPLC纯化后的放化纯度示于图4。图4 中未见其他杂质峰。根据图4可计算得,18F-FES溶液放化纯度大于98%。
3.4 18F-FES体外稳定性
18F-FES溶液在室温下放置1、2、3、4、6h后,放化纯度未见明显变化,仍大于98%,表明18F-FES体外稳定性良好。
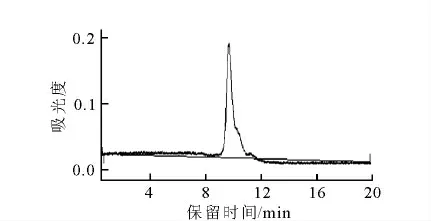
图4 18F-FES的HPLC图谱
4 小 结
综上所述,采用国产氟多功能模块可以合成18F-FES:采用79GBq18F-和1mg MMSE前体可合成6.4GBq18F-FES。不校正合成效率为8.2%,校正合成效率为12.8%,比活度为0.165TBq/mol,合成时间约为70min;18F-FES产品的放化纯度大于98%,并且体外稳定性良好。
18F-FES合成的关键步骤是前体MMSE的亲核氟化反应和水解反应。其中试剂的含量及浓度和反应的温度及时间为主要影响因素。本研究18F-FES合成效率较低。原因可能有以下几个方面:1)前体用量偏少,Oh 等[9]的研究发现,18F-FES的产率与前体MMSE的用量有关,随着用量的增加,从1、2、5到10 mg,产率逐渐提高到20%、45%、55%、68%;2)由于乙腈的沸点为82℃,氟化反应时温度要升高到105℃,所以反应体系必须保持密封。若反应体系的密封性不好,则成为开放体系,温度升高到105℃会导致乙腈沸腾,急剧挥发,影响氟化效率;3)酸水解反应过程易形成副产物,即18F-FES的降解问题,因此严格控制水解条件非常关键。操作中应严格控制该过程的反应温度及反应体系的体积,以防温度过高造成体系被蒸干,影响产率。18FFES的降解与反应温度、时间和水的含量均有关系,温度高、时间长及水含量大均容易导致18F-FES降解[10]。通过以上对合成产率影响因素的分析,若进一步优化反应条件,现有的合成收率应可以得到提高。
[1]Yu KD,Di GH,Wu J,et al.Development and trends of surgical modalities for breast cancer in China a review of 16-year data[J].Ann Surg Oncol,2007,14:2 502-2 509.
[2]曾超,刘亚莉,赵清波,等.Rab23分子在乳腺癌细胞中的表达及意义[J].医学研究生学报,2010,23(4):352-356.
[3]孟召伟,董峰,谭建.乳腺癌的雌激素受体显像[J].国际放射医学核医学杂志,2007,31(3):157-159.
[4]Mortimer JE,Dehdashti F,Siegel BA,et al.Metabolic flare:Indicator of hormone responsivenedd in advanced breast cancer[J].J Clin Oncol,2001,19(11):2 797-2 803.
[5]Kumar P,Mercer J,Doerkson C,et al.Clinical production,stability studies and PET imaging with 16-alpha-fluoroestradiol([18F]FES)in ER positive breast cancer patients[J].J Pharm Pharma-ceut Sci,2007,10(2):256s-265s.
[6]Brodack JW,Kilbourn MR,Welch MJ,et al.Application of robotics to radiopharmaceutical preparation:controlled synthesis of fluorine-18 16alpha-fluoroestradiol-17 beta [J].J Nucl Med,1986,27(5):714-721.
[7]Lim JL,Zheng L,Berridge MS,et al.The use of 3-methoxymethl-16 beta,17beta-epiestriol-O-cyclic sulfone as the precursor on the synthesis of F-18 16alpha-fluoroestradiol[J].Nucl Med Biol,1996,23:911-915.
[8]Tewson TJ,Mankoff DA,Peterson LM,et al.Interactions of 16a-[18F]-fluoroestradiol(FES)with sex steriod binding protein(SBP)[J].Nucl Med Biol,1999,26:905-913.
[9]Oh SJ,Chi DY,Mosdziano WC,et al.The automatic production of 16alpha-fluoroestradiol using a conventional[18F]FDG module with a disposable cassette system[J].Appl Radiat Isot,2007,65(6):676-681.
[10]王明伟,张勇平,章英剑,等.乳腺癌雌激素受体分子影像探针16α-[18F]氟-17β-雌二醇的自动化合成[J].核技术,2009,32(11):839-844.
