99Tcm 标记右旋糖苷衍生物的制备及其生物分布
2012-11-12杨春慧李洪玉梁积新罗洪义郑德强孙桂全
杨春慧 ,李洪玉,梁积新,鲁 佳,罗洪义,郑德强,孙桂全
(1.中国原子能科学研究院 同位素研究所 北京 102413;2.原子高科股份有限公司,北京 102413)
放射导向的前哨淋巴结活组织切片检查(SLNB)是一种在早期乳腺癌和黑色素瘤处置方面被广泛认可的技术,尤其在肿瘤发病初期,可以用于检测位于隐匿性区域的前哨淋巴结并对其是否发生癌转移进行评估,对治疗方案的选择具有重要意义[1-2]。SLNB可用于评估乳腺癌、口腔癌、宫颈癌和其他生殖泌尿系统肿瘤的转移情况。
目前,临床上常用的前哨淋巴结(SLN)显像剂大多为非特异性,且显像效果欠佳。99Tcm标记的纳米颗粒类药物被广泛用于SLN 检测,其摄取机理主要基于淋巴结内巨噬细胞的吞噬作用将药物滞留在SLN 内,但显像效果仍不够理想,主要缺点是:特异性不强,在注射点的浓集高,分子颗粒大小不均,易发生放射性从SLN 到次级淋巴结(2LN)的迁移,致使次级淋巴结显像不清晰,需要严格控制显像及活检时间[3]。
右旋糖苷作为一种非常便利的分子骨架,可修饰不同的化学基团,并表现出不同的分子性质。最近的研究[4-5]表明,99Tcm标记甘露糖基化的大分子如人血清白蛋白、右旋糖苷等,可与淋巴结巨噬细胞表面的受体结合,且其分子大小较为确定,摄取性能较好。LymphoseekTM(99Tcm-DTPA-甘露糖基化右旋糖苷)作为一种具有受体结合性质的显像剂被用于SLN 检测,目前在国外已完成了三期临床研究。其他相关的生物实验和显像研究表明,该类标记物在淋巴结的摄取可能受到分子大小、电荷、受体作用机制等因素的影响[6-7]。
羰基锝[99Tcm(CO)3]+具有许多优良的性质,如:化学性质较稳定,核结构较紧密,与适当的配体结合后可保护中心锝核不受其他配体的进攻,从而有利于整个配合物的稳定;分子较小,对多肽等生物分子的生物活性影响较小,应用范围较广等。更为有利的是,羰基锝可通过Isolink药盒很方便地制得。因此,本研究拟选用羰基锝做中心核进行标记物的生物分布实验,并比较甘露糖基对标记物在体内分布及淋巴结摄取的影响,以及由于起始右旋糖苷相对分子质量的不同对标记物体内分布及淋巴结摄取产生的影响。
1 实验材料
1.1 主要仪器
99Mo-99Tcm发生器:原子高科股份有限公司;FH463A 自动定标器、FT-603型闪烁探头:北京核仪器厂;CRC 15R 放射性活度计:美国CAPINTEC公司;微量注射器:美国Hamilton公司;高效液相系统:ProStar 210型,美国Varian公司;HPLC 放射性检测器:德国Raytest公司;Milli-Q高纯水制备系统:MILLIPORE公司。
1.2 主要试剂
右旋糖苷衍生物:希腊放射性核素和放射性显像产品研究所的Ioannis Pirmettis博士合成,法国的Roberto Pasqualini博士提供;Isolink药盒:由Mallinckrodt-Tyco公司生产并赠送。其他试剂均为国产分析纯,实验用水均为二次去离子水。
1.3 实验动物
Balb/c小鼠:60只,18~22g,雌雄不限,清洁级,由中国医学科学院实验动物研究所提供。
2 实验方法
2.1 羰基锝[99Tcm(CO)3(H2O)3]+的制备
Isolink药盒的主要成分为:4.5mg硼氢化钠、7.15mg碳酸钠、8.5mg二水合硼酸钠、2.85mg十水合硼酸钠。标记时,向Isolink 药盒中加入1 mL Na99TcmO4洗脱液(37~370MBq),于95℃反应25~30min,间歇振荡,反应结束后,冷却至室温,用约0.2 mL PBSHCl缓冲液(0.64 mol/L,pH 为2.5)调节pH为7.5~8.5。
2.2 右旋糖苷衍生物的99Tcm 标记
选取两组右旋糖苷衍生物进行对比,分别为不含甘露糖基的右旋糖酐衍生物DC(Dextranpropyl-S-Cysteine)和含甘露糖基的右旋糖酐衍生物DCM(Dextran-S-Cysteine-Mannose)。DC-1和DCM-1为第一组对比物(起始右旋糖苷的相对分子质量约为11 800);DC-2和DCM-2为第二组对比物(起始右旋糖苷的相对分子质量约为20 000,);另外,4种对比物分子上都修饰了半胱氨酸以提供羰基锝的结合位点。DC 和DCM 类衍生物的化学结构示于图1。标记方法参考文献[8]。将羰基锝[99Tcm(CO)3(H2O)3]+分别加入到含有400μg DC-1、DCM-1、DC-2 和DCM-2 冻干 品瓶中,反应混合物于75℃反应30min。得到99Tcm-(CO)3-DC-1、99Tcm-(CO)3-DC-2、99Tcm-(CO)3-DCM-1 和99Tcm-(CO)3-DCM-2。将标记溶液用生理盐水稀释80倍,于室温下静置5h,用HPLC 分析其放化纯度。
2.3 标记物放化纯度的测定
采用高效液相色谱法(HPLC)分析标记物的放化纯度:C18色谱柱(Hypersil ODS2,φ4.6mm×250mm)为分离柱,紫外检测器波长选择254nm,流速为1mL/min。分析条件为:流动相A :0.1%TFA/H2O,B:0.1%TFA/MeOH;淋洗梯度:0~4 min,0~0%B;4~6min,0~25%B;6~17 min,25%~100%B;17~25min,100%B;25~30min,100%~0B;30~35min,0%B。
2.4 标记物在正常小鼠体内的生物分布
取健康Balb/c小鼠60只,随机分为12组,每组5只。将标记物用生理盐水稀释(pH 6~7.5),由小鼠的右后足脚垫皮下进行注射。注射液浓度为3~37GBq/L,当注射剂量为0.01g/L时,注射体积为5μL;当注射剂量为0.1g/L时,注射体积为20 μL。注射后按摩脚掌0.5min,分别于处死前10min在给药一侧的脚垫处皮下注入专利蓝溶液,再按摩脚掌0.5min。给药后1、4h处死小鼠,取前哨淋巴结(即腘窝淋巴结)、次级淋巴结(即腰淋巴结)、注射点(即右后足)、肝、脾、血等,测量其放射性计数,计算组织或器官的放射性摄取率。

图1 右旋糖苷衍生物DC和DCM 的化学结构
3 结果与讨论
3.1 右旋糖苷衍生物化合物的99Tcm 标记
羰基锝[99Tcm(CO)3(H2O)3]+以及标记产物HPLC分析谱图示于图2。由图2结果可计算得,采用Isolink药盒制备的羰基锝的放化纯度≥95%;而右旋糖苷衍生物经羰基锝标记,放化纯度也均>90%。
将99Tcm-(CO)3-DCM-1标记溶液用生理盐水稀释80倍,于室温下静置5h,放化纯度未见降低,仍>90%,说明所得99Tcm-(CO)3-DCM-1体外稳定性较好。
3.2 标记物在正常小鼠体内的生物分布
99Tcm-(CO)3-DC 和99Tcm-(CO)3-DCM 在注射剂量为0.01g/L 时,给药后4h,正常Balb/c小鼠体内的生物分布列于表1;注射剂量为0.1g/L时,给药后1h和4h,小鼠体内的生物分布结果分别列于表2和表3。
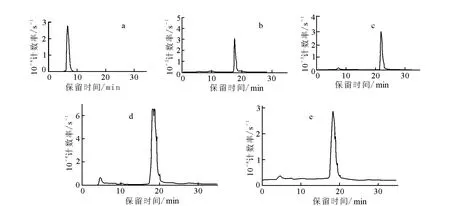
图2 标记物的HPLC谱图
表1 注射剂量为0.01g/L时给药4h后标记物在正常小鼠体内的生物分布(±s,n=5)
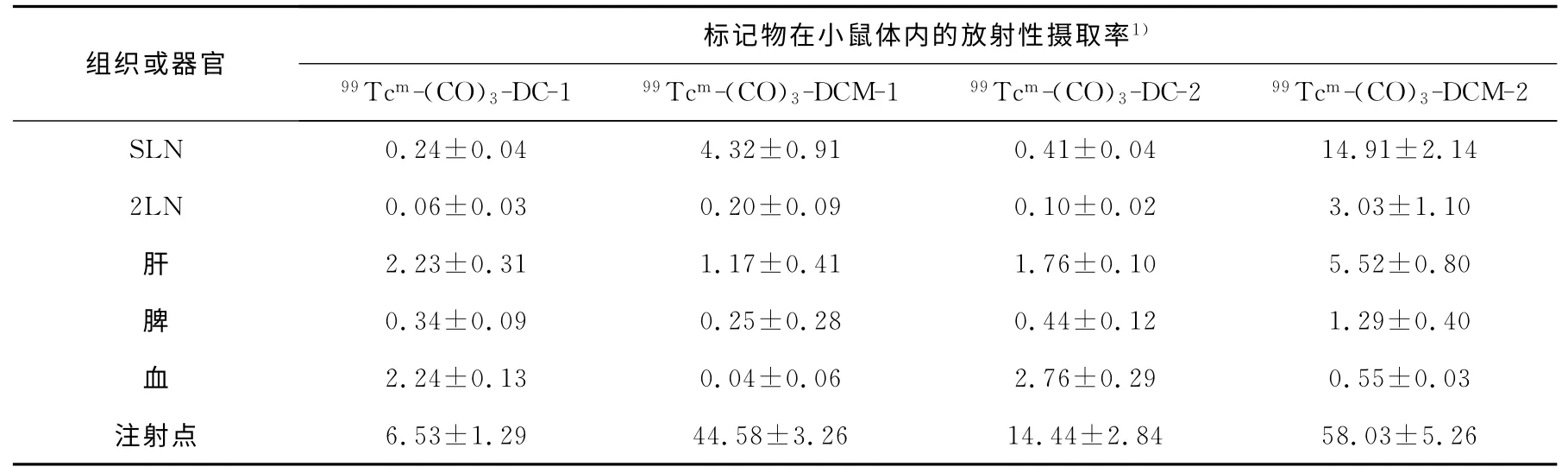
表1 注射剂量为0.01g/L时给药4h后标记物在正常小鼠体内的生物分布(±s,n=5)
注1):SLN、2LN、注射点摄取率的单位为%ID;肝、脾、血摄取率的单位为%ID·g-1
表2 注射剂量为0.1g/L时给药1h后标记物在正常小鼠体内的生物分布(±s,n=5)
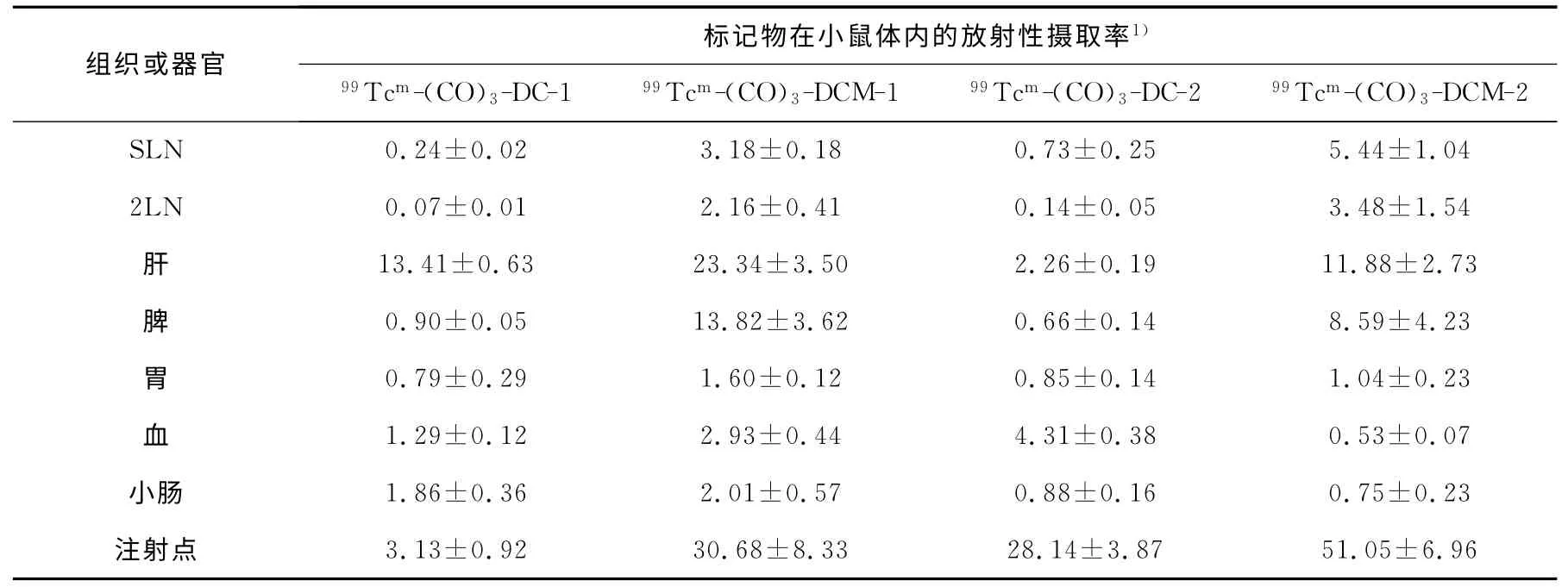
表2 注射剂量为0.1g/L时给药1h后标记物在正常小鼠体内的生物分布(±s,n=5)
注1):SLN、2LN、注射点摄取率的单位是%ID;肝、脾、胃、血和小肠摄取率的单位是%ID·g-1
表3 注射剂量为0.1g/L时给药4h后标记物在正常小鼠体内的生物分布(±s,n=5)
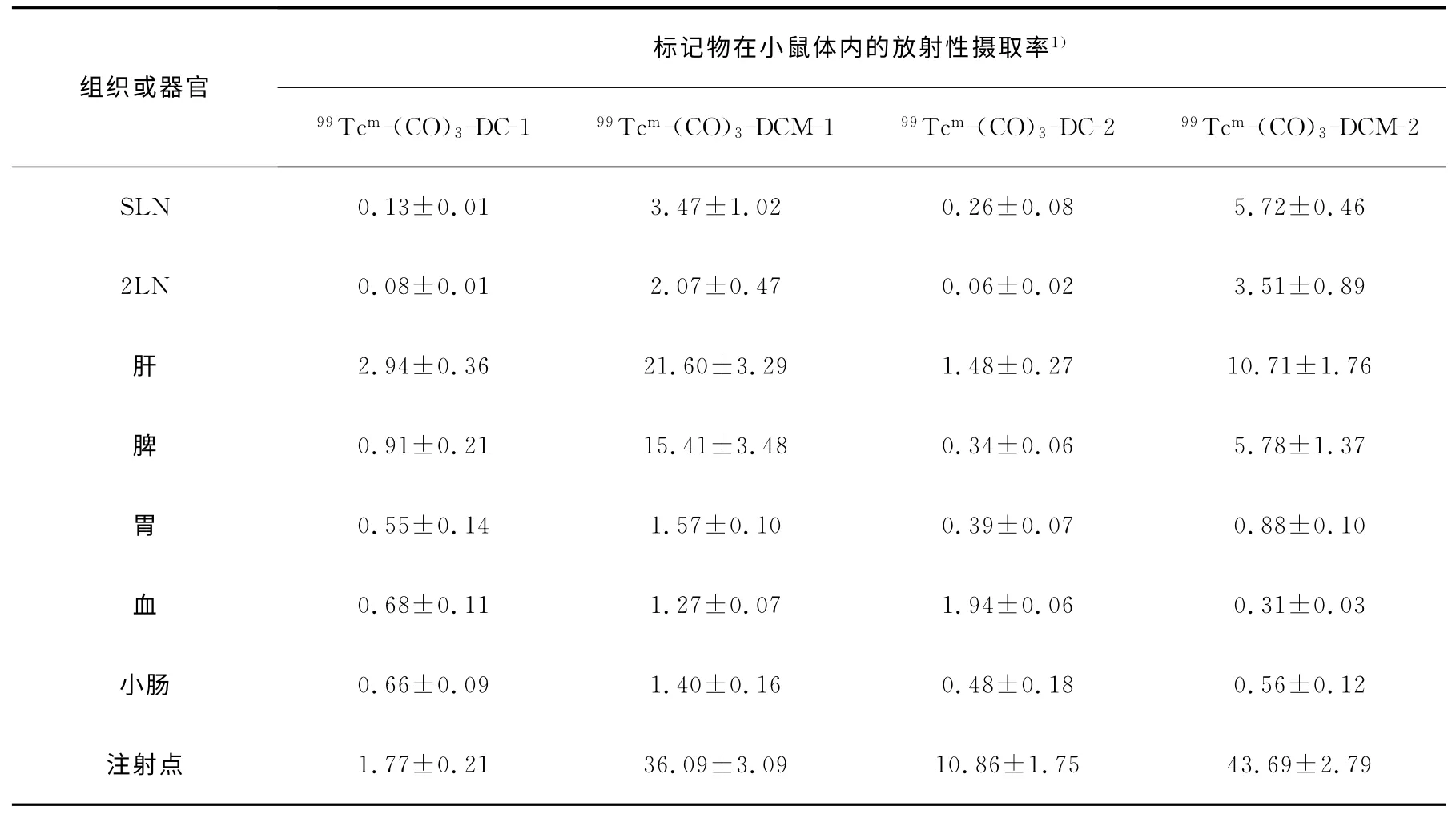
表3 注射剂量为0.1g/L时给药4h后标记物在正常小鼠体内的生物分布(±s,n=5)
注1):SLN、2LN、注射点摄取率的单位是%ID;肝、脾、胃、血和小肠摄取率的单位是%ID·g-1
表1结果显示:99Tcm-(CO)3-DC-1和99Tcm-(CO)3-DC-2 标记物在SLN摄取较低,99Tcm-(CO)3-DCM-1 和99Tcm-(CO)3-DCM-2 在SLN摄取较高,差异有统计学意义(P<0.000 5),但同时在注射点的滞留也相应增加。比如给药后4h,99Tcm-(CO)3-DC-2在SLN的摄取率为0.41%,在注射点的摄取也仅为14.44%;而当DC-2分子上连接甘露糖基后得到的DCM-2,其标记物99Tcm-(CO)3-DCM-2在SLN的摄取增加到14.91%,在注射点的摄取也增加到58.03%。差异有统计学意义(P<0.000 5)。分子中含有甘露糖基时,SLN 的摄取率大幅提高,表明分子中的甘露糖基对淋巴结巨噬细胞的受体具有亲和作用。
由表2和表3可见,当注射剂量为0.1g/L时,99Tcm-(CO)3-DCM 较99Tcm-(CO)3-DC 具有更高的SLN 摄取,其差异存在显著性(P<0.000 5),且表现出较高的肝、脾摄取,这可能是由于在动物脚掌这样一个相对狭小的范围里皮下注射,注射化学量及体积较大时,淋巴结处于一种过饱和状态,因此不能滞留的药物颗粒会经淋巴管进入血液,并最终停留在肝和脾内。而注射点放射性偏高,一方面是由于注射的化学量增加,另一方面可能由于注射液经稀释后,可能产生一些分子颗粒的聚集,造成注射点浓集增加。
对于前哨淋巴结显像而言,注射剂量是一个很关键的影响因素[9]。本研究显示了类似的结果,注射剂量降低为0.01g/L 时,在SLN 摄取提高的同时,肝摄取有了大幅降低,表明以小鼠为研究对象时,适当降低注射化学量或注射体积,选择合适的注射剂量,有利于标记物体内分布性质的改善。
另外,标记物的相对分子质量不同,也会造成不同的生物分布结果,总体来说,同类分子中相对分子质量较大的分子,在各种组织内的摄取都会有相应增加,差异显著(P<0.005)。比如99Tcm-(CO)3-DCM-2较99Tcm-(CO)3-DCM-1在注射剂量为0.01g/L 时,SLN 摄取高出两倍多。
4 结论
本研究用羰基锝标记了4种右旋糖苷衍生物,放化纯度均>90%。小鼠体内分布结果表明,含甘露糖基的右旋糖苷衍生物相比于不含甘露糖基的右旋糖酐衍生物具有更好的SLN 摄取率,体现了甘露糖基对淋巴结巨噬细胞的受体亲和作用;另外,起始右旋糖苷相对分子质量较高的标记化合物,SLN 摄取更高;标记物的注射剂量也会对SLN 摄取产生较大影响。
99Tcm标记的甘露糖基化右旋糖苷衍生物其分子大小较为确定,SLN 摄取性能较好,值得进一步研究。
[1]Mariani G,Moresco L,Viale G,et al.Radioguided sentinel lymph node biopsy in breast cancer suegery[J].J Nucl Med,2001,42:1 198-1 215.
[2]Easson AM,Rotstein LE,McCready DR.Lymph node assessment in melanoma[J].J Surg Oncol,2009,99:176-185.
[3]李艳,李囡,翟士桢,等.特异性前哨淋巴结显像剂99Tcm-rituximab药盒的制备及生物评价[J].同位素,2011,24(增刊):85-89.
[4]Antonia W,Carl KH,Jeanette M,et al.Molecular imaging of the sentinel lymph node via lymphoseek[J].Current Clinical Oncology,2009,4:123-133.
[5]Hoh CK,Wallace AM,Vera DR.Preclinical stu-dies of[99Tcm]DTPA-mannosyl-dextran[J].Nucl Med Biol,2003,30(5):457-464.
[6]Ellner SJ,Hoh CK,Vera DR,et al.Dose-dependent biodistribution of[99Tcm]DTPA-mannosyl-dextran for breast cancer sentinel lymph node mapping[J].Nucl Med Bio,2003,30(8):805-810.
[7]Kyoko T,Tomoya U,Emi K,et al.99Tcm-labeled mannosyl-neoglycoalbumin for sentinel lymph node identification[J].Nucl Med Biol,2004,31(7):893-900.
[8]Pirmettis I,Arano Y,Tsotakos T,et al.New99Tcm(CO)(3)Mannosylated dextran bearing Sderivatized cysteine chelator for sentinel lymph node detection[J].Mol Pharm,2012,9(6):1 681-1 692.
[9]李洪玉,梁积新,罗洪义,等.99Tcm-硫化铼胶体用于前哨淋巴结检测的生物实验:注射剂量与明胶浓度的影响[J].同位素,2011,24(2):72-76.
