脑缺血再灌注损伤大鼠大脑皮质NR2A及NR2B受体表达变化
2012-11-12杨一萍王永安范礼斌
杨一萍,骆 媛,王永安,范礼斌
(1.安徽医科大学生命科学学院医学遗传学教研室,安徽合肥 230032;2.军事医学科学院毒物药物研究所军事毒理学研究室,北京 100850)
近几年缺血性脑血管病发病率、病死率及致残率仍呈逐年上升趋势,严重威胁人类健康,而脑缺血再灌注损伤(cerebral ischemia reperfusion injury,IRI)危害更大。脑IRI,是指各种原因造成脑部组织血液灌流量减少或停止,重新恢复血液灌流后,其损伤反而加重的现象。关于脑IRI发病机制,目前尚未完全阐明,但既往研究已证实,N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体与脑缺血再灌注所致的脑损伤存在密切关系[1]。NMDA受体是兴奋性谷氨酸离子型受体的一种,主要存在于大脑皮质和海马,有NR1,NR2,NR3和NR4四种离子类型。其中,NR2是重要的调节亚单位,有NR2A,NR2B,NR2C和NR2D 4个剪接体。研究发现,NR2A和NR2B均参与了IRI过程,但其在IRI发生中的表达变化和作用尚存争议[2],并且目前的研究多集中在RNA水平,缺乏蛋白质水平的研究。而在生物体内发挥功能效应的是蛋白质,故本研究采用实时荧光定量PCR,Western印迹法和组织病理学等方法,从mRNA和蛋白水平观察脑IRI后大鼠大脑皮质NR2A和NR2B表达的变化,探讨NR2A/2B的表达与大脑皮质神经元的损伤的关系,以期进一步明确NMDA受体亚单位在IRI中的作用。
1 材料与方法
1.1 动物
健康成年 Sprague-Dawley大鼠,♂,体质量240~270 g,由维通利华实验动物技术有限公司提供,动物许可证号:SCXK(京)2006-2009。
1.2 试剂及器材
水合氯醛、肝素钠、甲醛、二甲苯和乙醇购自国药集团化学试剂有限公司;琼脂糖和丙烯酰胺购自Merck公司;十二烷基硫酸钠、双-丙烯酰胺、AP、Tris碱、TEMED和甘氨酸购自 Amresco公司;Prime ScriptRRT reagent Kit With gDNA Eraser,SYBR Premix Ex TaqTM试剂盒为TaKaRa公司产品;Trizol购自Invitrogen公司;抗NR2A单克隆抗体为Abcam公司产品;抗NR2B单克隆抗体为Millipore公司产品;抗β肌动蛋白多克隆抗体,HRP标记兔抗鼠IgG抗体,HE染色试剂盒均购自中杉金桥公司;BCA蛋白含量检测试剂盒、蛋白酶抑制剂混合物、RIPA裂解液均为凯基生物公司产品;其他化学试剂均为分析纯。MCAO栓线(2636-4A)购自北京沙东生物技术有限公司;RM2135石蜡切片机购自德国Leica公司,生物显微镜(BA400T)购自麦克迪奥实业集团有限公司;紫外分光光度计(UV-4802)购自尤尼柯仪器有限公司;荧光实时定量PCR仪、电泳仪、半干电转膜仪和凝胶呈像仪均购自美国Bio-Rad公司。
1.3 MCAO大鼠模型的评判标准
参考Zea Longa法,分别于麻醉清醒后对MCAO大鼠进行神经功能缺损评分:0分为无神经功能缺损症状;1分为不能完全伸展对侧前爪,即左侧前肢内收、屈曲;2分为自主运动时身体向左侧转圈;3分为身体向左侧倾倒;4分为不能自主行走并伴有意识障碍。
模型纳入标准:根据预实验的结果神经功能评分为2~3分的大鼠梗死体积为(28±4)%;Bederson等[3]的研究发现线栓法制备的MCAO大鼠神经功能评分为2~3分对应的梗死体积在(27±6)% ~(28±5)%,说明建立的MCAO大鼠具有稳定性和可复制性,故将复制成功的神经功能评分为2~3分的大鼠纳入实验组。
模型剔除标准:无明显神经功能缺损表现或症状很轻及有严重意识障碍的大鼠;术中出血过多或蛛网膜下腔出血、MCA起始部或Willis环有凝血块的大鼠。
1.4 MCAO大鼠模型的建立及分组
54只SD大鼠随机分为6组:①假手术组;②再灌注后6,12,24,48及96 h组,每组各9只动物。大鼠术前禁食12 h,10%水合氯醛3 ml·kg-1腹腔麻醉后仰卧位固定,取颈部偏右侧切口,分离右侧颈总动脉 (common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)和颈内动脉(internal carotid artery,ICA)。结扎ECA,将栓线尾部与CCA成30°角从CCA缓慢插入 ICA,插入长度为18~20 mm(从CCA分叉处计算),固定栓线,缝合消毒,缺血2h后将栓线缓慢抽出实施再灌注,待大鼠清醒后进行神经评分。于各时间点再次麻醉,以肝素20 kU·L-1化生理盐水灌流心脏,迅速取脑。由于半暗带和梗死区的界限不易确定,为满足无RNA酶的实验要求,以肉眼观察大脑皮质缺血再灌注损伤区与正常皮质之间的水肿线为界,实时定量PCR和Western印迹实验的取材部位和HE染色观察的部位均为水肿线以内包括半暗带和梗死区的皮质组织。
1.5 HE染色观察病理改变
每组各取3只完整大脑行4%甲醛固定,视交叉处冠状面切片,二甲苯洗2次,每次5~10 min,95%乙醇洗2次,每次3 min,2 min,80%乙醇1 min,蒸馏水1 mim,苏木精液染色12 min,流水稍洗去苏木精液1 ~3 s,1%盐酸乙醇1 ~3 s,稍水洗 20 s,促蓝液返蓝15 s,流水冲洗15 min,蒸馏水过洗2 s,0.5%苏红液染色2 min,蒸馏水稍洗2 s 80%乙醇稍洗1~2 s,95%乙醇洗2次,每次3 min,无水乙醇10 min,二甲苯洗3次,每次3 min,用滴加中性树脂的盖玻片封片,通风橱内吹干,光学显微镜下观察并照相,光学显微镜下观察病理改变。
1.6 RT-PCR检测NR2A,NR2B mRNA的表达
1.6.1 RNA 抽提和逆转录 cDNA
取各时间点MCAO大鼠梗死区及半暗带大脑皮质约100 mg,Trizol法抽提大脑皮质总RNA,加适量RNase-free水溶解。紫外分光光度计检测A260/A280吸光度,计算RNA的浓度和纯度。取5μl RNA进行1%琼脂糖凝胶电泳,恒压120 V,15 min,凝胶成像仪显示,可见28 S,18 S和5 S三条带,其中前两条带的相对亮度为2∶1说明RNA完整性好,无明显降解。A260/A280均在1.8~2.0,说明纯度较好,没有蛋白和苯酚的污染。
在1μg总 RNA样本中加入 gDNA Eraser 0.5 μl,5×缓冲液2 μl无 RNase水至10 μl。反应条件:42℃变性2 min,以消除可能存在的gDNA污染。0.5 μl PrimeSeript RT Enzyme,0.5 μl Oligo dT 引物50 μmol·L-1,0.5 μl随即引物(100 μmol·L-1),5 ×缓冲液 2μl,已去除 gDNA 的 RNA 10μl,加无RNase水至 20 μl。反应条件:37℃ 15 min,85℃5 s。反应产物置于-20℃冰箱长期保存。
1.6.2 实时荧光定量RT-PCR
根据 NR2A,NR2B和 β肌动蛋白基因在GenBank的序列,经Primer Express3.0软件设计引物(表1),并由Invitrogen公司合成。应用SYBR Green实时定量PCR试剂盒,以10倍稀释、5个浓度梯度的cDNA样本,分别建立NR2A,NR2B和β肌动蛋白基因扩增的标准曲线,确定它们的扩增效率并采用最佳扩增效率(E=90% ~110%)的反应体系条件进行检测。25μl反应体系包括:SYBR Ex Taq 12.5 μl,0.5 μl上游引物 10 μmol·L-1,0.5 μl下游引物 10 μmol·L-1,0.5 μl cDNA 10 μmol·L-1,11μl ddH2O。扩增条件:95℃预变性 30 s,95℃变性10 s,60℃退火延伸30 s,共40个循环,每次循环结束后采集荧光。为确定扩增反应的特异性,循环结束后进行融解曲线分析,条件如下:65~95℃,每5 s上升0.5℃。每组样本设定无cDNA模板反应孔为阴性对照;每个样本进行3次重复,重复间允许的差异小于0.5 ct。用BioRad ManagerTM软件分别测定每个样本NR2A/2B的相对拷贝数。
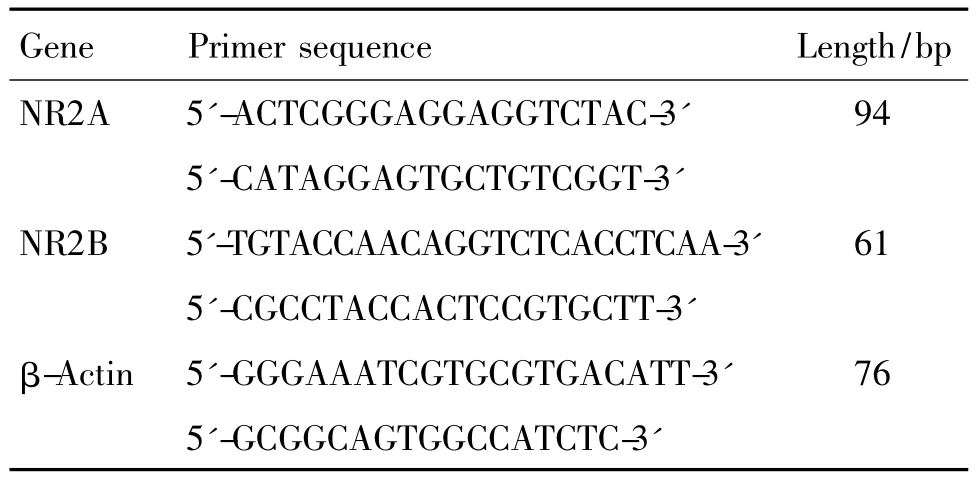
Tab.1 Primer sequences of genes sequences in real time-PCR
1.7 Western印迹法检测NR2A和NR2B蛋白表达
取各时间点MCAO大鼠梗死区及半暗带大脑皮质约100 mg,加入蛋白裂解液1 ml,冰上超声破碎,4℃,9168×g,离心15 min制备组织蛋白匀浆液,BCA法测定蛋白浓度。分别灌制8%和5%SDS-聚丙烯酰胺分离胶和浓缩胶,进行SDS-PAGE凝胶电泳。半干转印法60 mA恒流转膜30 min将蛋白转移到PVDF膜上,5%脱脂奶粉封闭2 h,加一抗,分别为抗NR2A单克隆抗体(1∶5000)、抗NR2B单克隆抗体(1∶1000),内参抗 β肌动蛋白抗体(1∶1000),4℃孵育过夜。次日 TBST洗膜后加入HRP标记的山羊抗兔/山羊抗小鼠二抗(1∶7000),室温孵育1 h。ECL化学发光检测杂交信号,X线片压片曝光,凝胶图像分析其积分光密度值,NR2A,NR2B蛋白的相对表达水平用β肌动蛋白的表达量来校正,即目的蛋白相对表达量 =IANR2A蛋白/IAβ肌动蛋白。
1.8 统计学分析
2 结果
2.1 局灶性脑缺血再灌注损伤大鼠大脑皮质改变
与假手术组相比,再灌后6 h,脑梗死区颜色变浅,正常神经元细胞数减少、排列紊乱,组织结构疏松、血管扩张(图1B箭头所示),锥体细胞核固缩成圆形或椭圆形;随着再灌注时间的延长,脑损伤程度逐步加重,12 h时可见血管内淤血(如图1C箭头所示);再灌后24 h损伤最严重,梗死区出现大量的核固缩核溶解等典型的细胞凋亡特征性表现,几乎看不到正常神经元细胞(如图1D箭头所示);48 h出现大面积角质化(如图1E箭头所示),96 h可见炎症细胞浸润(如图1F箭头所示)。
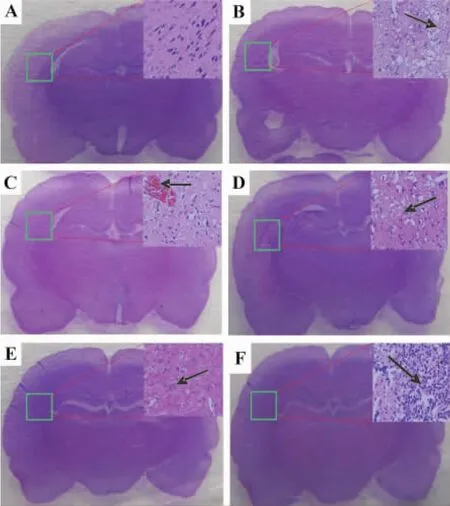
Fig.1 Pathological changes of rat cerebral cortex at different time points after ischemia(2 h)reperfusion injury(I/R)(HE ×400).A:sham;B-F:6,12,24,48 and 96 h after I/R.
2.2 局灶性脑缺血再灌注损伤大鼠脑皮质NR2A/2B mRNA表达水平
采用实时荧光定量PCR技术,检测了MCAO大鼠皮质NMDA受体亚单位NR2A/2B mRNA在再灌注后不同时间表达变化(表2)。结果表明,与假手术组相比,再灌注后6 h皮质NR2A mRNA水平表达显著降低(P<0.01),再灌注24 h,NR2A/2B均降至最低,NR2A∶NR2B 的比值由1∶1变为 1∶2;而后NR2A及NR2B表达又逐渐升高,至再灌注后96 h,NR2A∶NR2B 恢复至1∶1。
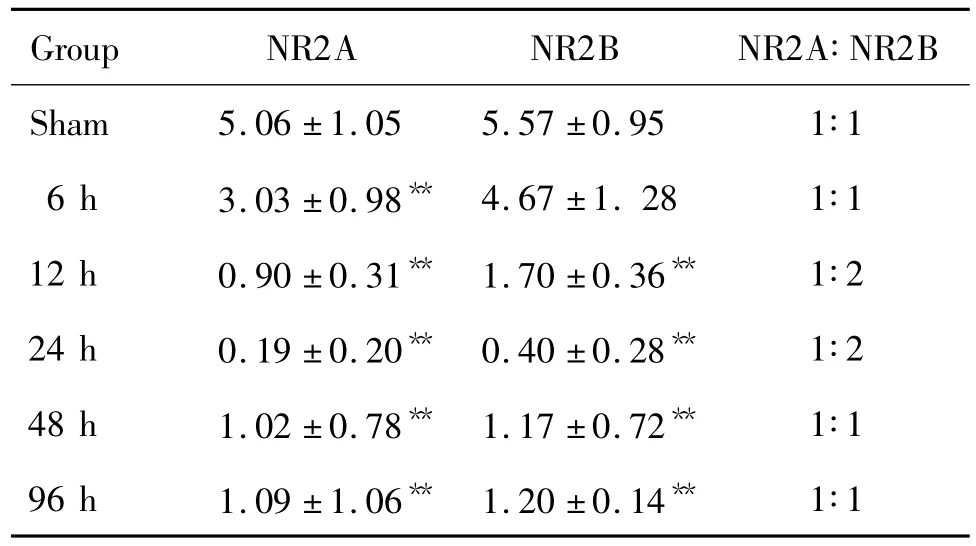
Tab.2 mRNA Expression of NR2A/2B in the cerebral cortex of rat at different time points after I/R
2.3 局灶性脑缺血再灌注损伤大鼠脑皮质NR2A/2B蛋白表达水平
图2结果显示,再灌注后6 h,大鼠大脑皮质NR2A/2B蛋白表达开始下调,NR2B与假手术组相比有统计学差异(P<0.05);此后,两者进一步下调,并于再灌后24 h降至最低(P<0.01)(图2);再灌后48 h出现上调,96 h两者蛋白的表达也为1∶1且已接近正常水平。与NR2B蛋白表达不同,尽管NR2A蛋白表达总体呈先降低后升高趋势;但在观察的整个时间点内,NR2A蛋白有显著统计学意义的下调仅出现在再灌后24 h(P<0.05),在其他各时间点,NR2A蛋白表达与假手术组相比未见显著改变。
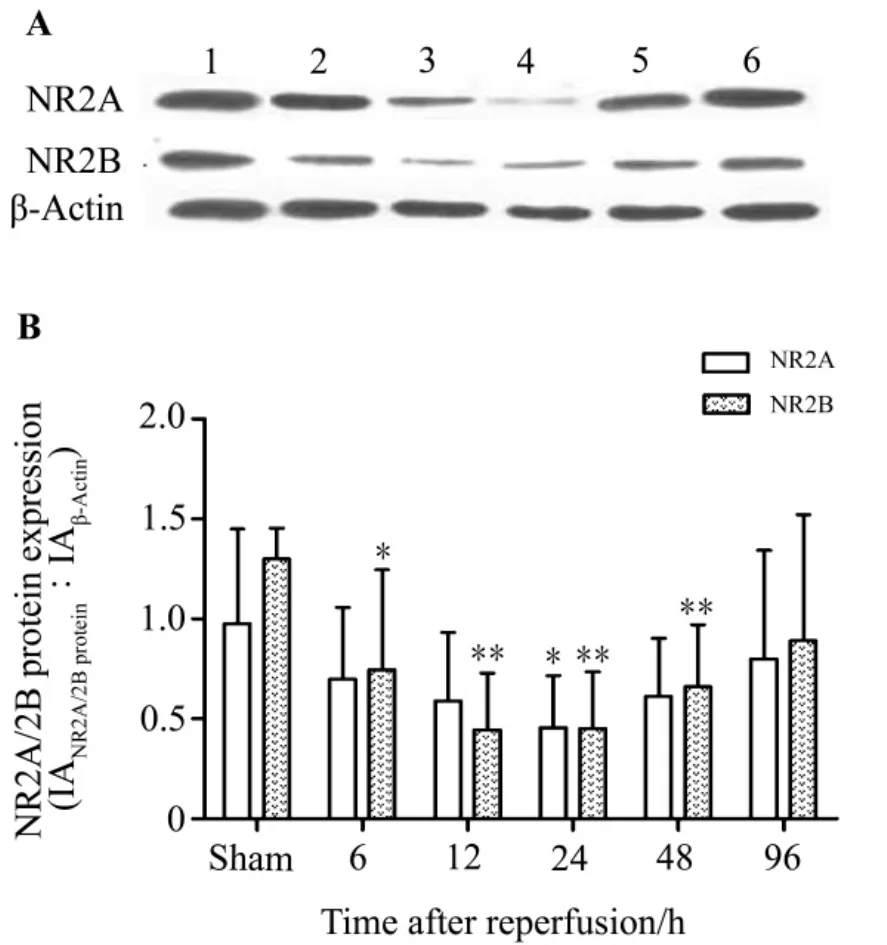
Fig.2 Expression of NR2A/2B protein in the cerebral cortex of rat at different time points after I/R.C was the semiquantitative result of A and B.1.sham,2.6 h after I/R;C:12 h after I/R;D:24 h after I/R;E:48 h after I/R;F:96 h after I/R.n=6.*P <0.05,**P <0.01,compared with sham group.
3 讨论
关于NR2主要受体亚单位NR2A/2B在IRI后不同时间表达变化,目前仍存在明显争议。Liu等[4]发现IRI后,海马神经元 CA1区NR2A/2B的mRNA水平呈先降低后增高趋势,NR2B的变化尤为显著;而 Cascón等[5]则认为 NR2B 表达下调与NMDA受体介导的兴奋性毒性有关,NR2A表达上调可能与促进IRI中的细胞存活有关;Dos-Anjos等[6]研究证实,在 IRI早期,NR2A mRNA 与 2B mRNA表达比例失衡,引发NMDA受体结构和功能改变,可能是导致神经元损伤的重要原因。需要说明的是,这些研究,多单纯局限于mRNA或蛋白水平;但 mRNA水平并非绝对预示其相应蛋白水平[7],因此,本研究在同一个动物模型上,同时开展mRNA及其相应蛋白表达,以及脑皮质病理学改变相关性的研究。
本实验组织病理学结果表明,脑缺血再灌后6 h,大脑皮质即出现明显病理学改变,再灌后24 h,损伤最为严重;RT-PCR及Western印迹法研究结果发现,在再灌后6 h,最为明显的改变是NR2B蛋白水平的显著下调;之后至96 h,NR2A/2B mRNA及蛋白表达均呈现先降低再升高的趋势,24 h至最低;除此之外,在再灌后12 h及24 h,存在NR2A及NR2B mRNA比例失衡,其mRNA比值由1∶1升至1∶2,至96 h两者的比值达到1∶1,蛋白表达也已接近假手术组水平。这表明再灌24 h后NR2A/2B的基因和蛋白表达均处于最低水平且两者的mRNA比值发生改变与24 h病理损伤严重之间存在时间一致性,因此推测在IRI中神经元的损伤可能与NR2A/2B的表达变化有关。
NR2是NR1的调节亚单位,多数研究认为含有NR2A的NMDA受体主要在缺血耐受机制中发挥保护作用,而含有NR2B的NMDA受体及其介导的信号分子在兴奋性毒性和缺血引起的神经元死亡中起主要作用[5,8]。在本实验中,NR2B 蛋白表达在脑缺血再灌注损伤后6 h即出现显著下调,则从另一个角度证实了NR2B的表达降低可能是引发大脑皮质病理学改变的始动因素;而此后NR2A/2B的不均衡下调,导致NR2A的保护性调控作用降低、NR2B的损伤性调控作用增强,进而加重NMDA受体复合体结构和功能改变,则可能是进一步引发大脑皮质病理学改变的继发原因。再灌注24 h后NR2A/2B的表达开始上调,再灌注96 h时,不管基因水平NR2A∶NR2B约为1∶1,蛋白的表达量已接近正常水平,说明NR2A和NR2B分别作为NMDA复合体中参与保护和损伤的重要调节亚单位,随着再灌注时间的延长它们能通过自身的调节达到与正常水平相似的平衡状态,这可能是大鼠自身在脑缺血再灌注损伤中的应激性保护。这种上调性保护与Liu等[4]报道的NMDA受体过度表达参与脑缺血再灌注损伤的兴奋性氨基酸毒性损伤并不矛盾,因为再灌注96 h NR2A/2B的表达仍低于正常水平。需要说明的是,RNA和蛋白具体表达量在每个时间点不尽一致,这是由于蛋白表达可以受转录调控,也可以受翻译水平的调控,而翻译水平的调控可以导致蛋白表达和RNA水平不成比例[9]。
目前临床多选用氯胺酮、美金刚等非竞争性NMDA受体拮抗剂治疗IRI,但均难以达到理想效果,甚至加重脑病理损伤的发生[10-11]。究其原因,主要在于上述药物均为非受体亚型选择性NMDA受体拮抗剂;且在使用过程中,未重点考虑NR2不同亚型在损伤后不同时间表达变化。而本研究结果则发现,NMDA受体亚单位在IRI发作过程中,其表达存在亚单位特异性。因此,依据NR2A/2B在脑缺血再灌注后不同时间表达变化,选用相应的NR2受体亚单位激动剂或拮抗剂进行选择性治疗,将成为今后IRI的治疗新方向。
[1]Numakawa T,Matsumoto T,Numakawa Y,Richards M,Yamawaki S,Kunugi H.Protective action of neurotrophic factors and estrogen against oxidative stressmediated neurodegeneration[J].J Toxicol,2011,(2011):405194.
[2]Bannerman DM,Niewoehner B,Lyon L,Romberg C,Schmitt WB,Taylor A,et al.NMDA receptor subunit NR2A is required for rapidly acquired spatial working memory but not incremental spatial reference memory[J].J Neurosci,2008,28(14):3623-3630.
[3]Bederson JB,Pitts LH,Tsuji M,Nishimura MC,Davis RL,Bartkowski H.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-476.
[4]Liu Z,Zhao W,Xu T,Pei D,Peng Y.Alterations of NMDA receptor subunits NR1,NR2A and NR2BmRNA expression and their relationship to apoptosis following transient forebrain ischemia[J].Brain Res,2010,(1361):133-139.
[5]Gascón S, Sobrado M,Roda JM,Rodríguez-Peña A,Díaz-Guerra M.Excitotoxicity and focal cerebral ischemia induce truncation of the NR2A and NR2B subunits of the NMDA receptor and cleavage of the scaffolding protein PSD-95[J].Mol Psychiatry,2008,13(1):99-114.
[6]Dos-Anjos S,Martínez-Villayandre B,Montori S,Regueiro-Purriños MM,Gonzalo-Orden JM,Fernández-López A.Transient global ischemia in rat brain promotes different NMDA receptor regulation depending on the brain structure studied[J].Neurochem Int,2009,54(3-4):180-185.
[7]Wolf-Yadlin A, Sevecka M, MacBeath G.Dissecting protein function and signaling using protein microarrays[J].Curr Opin Chem Biol,2009,13(4):398-405.
[8]Taghibiglou C,Martin HG,Lai TW,Cho T,Prasad S,Kojic L,et al.Role of NMDA receptor-dependent activation of SREBP1 in excitotoxic and ischemic neuronal injuries[J].Nat Med,2009,15(12):1399-1406.
[9]Gu L, Zhu N, Zhang H,Durden DL,Feng Y,Zhou M.Regulation of XIAP translation and induction by MDM2 following irradiation[J].Cancer Cell,2009,15(5):363-375.
[10]von Engelhardt J, Coserea I, Pawlak V,Fuchs EC,Köhr G,Seeburg PH,et al.Excitotoxicity in vitro by NR2A-and NR2B-containing NMDA receptors[J].Neuropharmacology,2007,53(1):10-17.
[11]Liu Y,Wong TP,Aarts M,Rooyakkers A,Liu L,Lai TW,et al.NMDA receptor subunits have differential roles in mediating excitotoxic neuronal death both in vitro and in vivo[J].J Neurosci,2007,27(11):2846-2857.
