海岛棉DELLA蛋白基因GbGAI2的克隆及其在胚珠中表达分析
2012-11-10詹杰鹏崔百明彭明曲廷云郑银英
詹杰鹏,崔百明,彭明,曲廷云,郑银英
(1石河子大学生命科学学院/农业生物技术重点实验室,石河子832003;2中国热带农业科学院热带生物技术研究所,海口571101)
棉花作为棉纺织业的原材料,与人们的日常生活密切相关,是一种全球性的重要经济作物,也是我国重要的经济和战略物资。海岛棉又名长绒棉,其纤维细长,强力高,纺纱性能极佳,在我国仅在新疆的部分地区出产长绒棉,产量极为有限。
赤霉素(Gibberellins,GA)作为一种重要的植物激素,广泛存在于各种植物中,在调控胚根的生长、茎杆的伸长、叶片的延展、花的发育、花器的分化和果实的成熟等阶段发挥重要作用[1]。棉纤维的发育可划分为4个不同且相互重叠的时期:纤维的起始、延伸、次生壁合成以及成熟,而纤维的起始和伸长过程影响棉纤维的产量。棉纤维细胞的启动需要激素的刺激,其中赤霉素在诱导单纤维细胞产生和伸长中具有重要作用[2]
DELLA蛋白是一类 GRAS(GAI、RGA、SCR)家族蛋白[1],作为GA信号转导通路中的一类转录因子,主要起负调控作用,抑制GA信号向下游传递。在DELLA蛋白的氨基酸序列中,N端同源性总体上不高,但存在DELLA和TVHYNP两个非常保守的酸性结构域[3]。序列中,N端同源性总体上不高,但存在DELLA和TVHYNP两个非常保守的酸性结构域[3]。Itoh等[4]利用水稻SLR1基因的突变体分析了DELLA蛋白不同保守结构域的功能,认为DELLA与VHYNP是GA信号感知结构域。GA可诱导DELLA蛋白的降解,在水稻GA转导途径中,GA与质膜外受体GID1结合,通过G蛋白或Ca2+以及GID1将信号传递到胞内,诱导DELLA蛋白通过泛素化蛋白酶通道降解,解除DELLA蛋白的抑制作用,进而调节植物的生长发育[5]。DELLA蛋白结构的完整性为正常GA反应所必需,如果DELLA蛋白的结构发生改变,使之不能感知GA信号,DELLA蛋白便成为组成性的阻遏蛋白,植株表现出类似GA缺乏的表型[1]。目前,在已发现的DELLA突变体中,植株大多表现为对GA不敏感的矮化表型。研究表明这些突变体都是因为DELLA蛋白在DELLA区域发生了变化,不能感知GA信号,造成DELLA蛋白的积累,从而表现出 GA 不敏感的性状[1,6-8]。
近些年来,有关棉花中DELLA蛋白的研究取得了很大的进展。棉花中有4个基因编码DELLA蛋白的同源基因,分别为 Gh GAI1、Gh GAI2、Gh-GAI3、Gh GAI4,其中已证明 Gh GAI3和Gh GAI4各有2个等位基因GhGAI3a、GhGAI3b、GhGAI4a、Gh GAI4b[9]。预测海岛棉中也存在多个编码DELLA蛋白的基因。廖文斌等[8]首次从海岛棉中克隆得到1个类似DELLA蛋白基因Gh RGL,并证明其包含有DELLA蛋白所有的保守结构域。本实验克隆了海岛棉中DELLA蛋白同源基因GbGAI2,分析了GbGAI2在海岛棉胚珠不同发育阶段表达量的差异。
1 材料与方法
1.1 材料与试剂
1.1.1材料
海岛棉(Gossiypium barbadense L.)新海14由石河子大学农学院张微教授提供。
1.1.2试剂
Taq酶、AMV、DNA回收试剂盒、DNA连接酶、p GEM-Teasy载体等均由Promega公司提供,膜结合DNA清除试剂盒由北京天恩泽基因科技有限公司提供,引物由上海生工生物工程技术服务有限公司合成,测序由北京六合华大基因科技股份有限公司完成。
1.2 方法
1.2.1 DNA提取
取大田中生长3个月的海岛棉(新海14)植株幼叶(顶端未展开叶片及向下数的两片展开叶)0.5~1.0 g,CTAB法提取海岛棉基因组总DNA。
1.2.2基因克隆
根据已知棉花DELLA蛋白Gh GAI2(Gen-Bank登录号:FJ974045)设计上游引物:5′-CCCGGGATGAAGCGAGACCACAATCA-3′;
下游引物:5′-GAGCTCTCACTGGCTTATGGCGGTGG-3′。
以海岛棉基因组DNA为模板进行PCR扩增。PCR 程序:94℃5 min后,94℃30 s,66℃45 s,72℃1 min,共35个循环;72℃10 min。PCR产物置于1.5%琼脂糖中电泳,回收目的片段,回收产物与pGEM-Teasy载体连接后转化E.coli DH5α感受态细胞,涂于LB固体培养基(含50μg/m L Amp)上,37℃培养16 h后,挑取菌落,液体LB培养基(含50 μg/m L Amp)37℃震荡培养12 h后,提取质粒DNA,酶切鉴定正确质粒DNA送上海生工生物工程技术服务有限公司测序。
1.2.3序列分析
利用DNAMAN软件进行多重序列比较和同源性分析。采用Mega 5.1软件构建系统发育树,参数设置:采取最大简约法(Maximun Parsimony,MP)构建系统树,随机逐步比较的方式搜索最佳系统树,对生成的系统发育树进行Bootstrap校正,最终生成系统发育树。
1.2.4胚珠采集
胚珠采自海岛棉开花后第1天(1 DPA)至25天(25 DPA)的棉铃,隔1 d采集1次,从第8 DPA开始,胚珠上已长出棉纤维,小心分离棉纤维与胚珠组织,收集胚珠。所采集到的胚珠用锡箔纸包好后迅速放入液氮罐中保存,带回实验室。
1.2.5 RNA的提取和cDNA合成
利用CTAB/酸酚法[10]提取海岛棉花后不同发育时期胚珠组织总RNA,用北京天恩泽基因科技有限公司提供的膜结合DNA清除试剂盒进一步纯化海岛棉胚珠组织总RNA。
反转录采用20μL体系,利用AMV反转录酶逆转录合成cDNA第一链。20μL体系中含1μg总RNA,DEPC水6.5μL,Olig d T 181μL,75℃保温5 min后,冰上冷却5 min,然后再依次加入RNase Inhibitor(40 U/μL)0.5μL,5×AMV buffer 4μL,dNTPs(10 mmol/L)2μL和 AMV(5 U/μL)1μL,25℃保温10 min,42℃温育60 min,70℃变性5 min,冰浴5 min。所得逆转录产物加EDTA(0.75 mol/L)稀释至总体积为50μL,-20℃保存备用。
1.2.6半定量RT-PCR
以海岛棉花后不同发育时期胚珠组织总RNA逆转录产物为模板,检测Gb GAI2基因在海岛棉不同发育时期胚珠中的表达情况。
用棉花Gh His3作为内标基因,Gb GAI2扩增引物与内标基因扩增引物见表1。
内标基因与目的基因同机分管扩增,扩增体系中含cDNA(20 ng/μL),10×PCR buffer 2 m L,d NTP(10 mmol/L)1μL,引物(10μmol/L)0.5μL和Taq(5 U/μL)0.2μL,dd H2O 加至总体积20 μL。扩增条件为94℃3 min;94℃30 s,58℃45 s,72℃延伸1 min,25个循环,72℃10 min。PCR产物置1.5%琼脂糖中电泳,用紫外凝胶成像仪(Bio-Rad)观察结果。试验重复3次。

表1 半定量RT-PCR引物Tab.1 The primers of Semi-quantitative RT-PCR experiment
2 结果与分析
2.1 GbGAI2基因的克隆与序列分析
已报道棉花DELLA蛋白基因不含有内含子,本研究根据已知陆地棉DELLA蛋白GhGAI2设计特异性引物,以海岛棉基因组DNA为模板,PCR成功扩增得到1条目的片段(图1)。
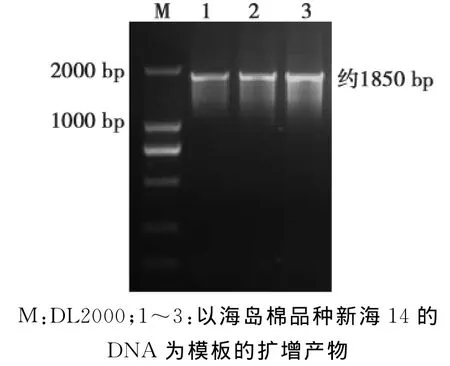
图1 GbGAI2b基因扩增Fig.1 Amplification of the GbGAI2 gene from Gossypium barbadense L.variety of Xinhai 14
测序发现该基因片段与陆地棉DELLA蛋白基因Gh GAI2相似性最高,将其命名为GbGAI2。该基因含有1个完整的阅读框,全长1848 bp,编码616个氨基酸序列(图2)。
将GbGAI2与4个双子叶植物(陆地棉:DQ006269、FJ974045、HM034760、HM034763、HM034761和 HM034762;拟南芥:CAA72177;葡萄:AAM19210;蕃茄 AAP22369)和3个单子叶植物(水稻:BAA90749.1;小麦:CAB51555;玉米:CAB51557)的已知DELLA蛋白进行氨基酸多重序列比较分析(图2),发现GbGAI2蛋白具有GRAS家族的所有典型结构域,包括核定位信号域NLS,DELLA蛋白N端保守结构域DELLA和TVHYNP区域,C端保守结构VHIID、PFYRE和SAW,以及在GA信号传导过程中起重要调节作用的LZ区域和poly S/T/V 区域(图2),由此推测GbGAI2蛋白属于植物特有的GRAS转录因子的DELLA亚族,并有可能参与GA信号通路调节。

图2 海岛棉GbGAI2氨基酸序列与已知植物DELLA蛋白氨基酸序列比对Fig.2 Amino acid sequence comparison of putative GbGAI2 with other related proteins
对海岛棉Gb GAI2与已知植物DELLA蛋白氨基酸序列的相似性进行分析(表2),发现海岛棉Gb GAI2与已知植物DELLA蛋白氨基酸序列保守区高度一致,平均相似性59.14%。其中与陆地棉DELLA蛋白GhGAI2相似性最高,达到90.13%,其次为葡萄,相似性为69.12%。
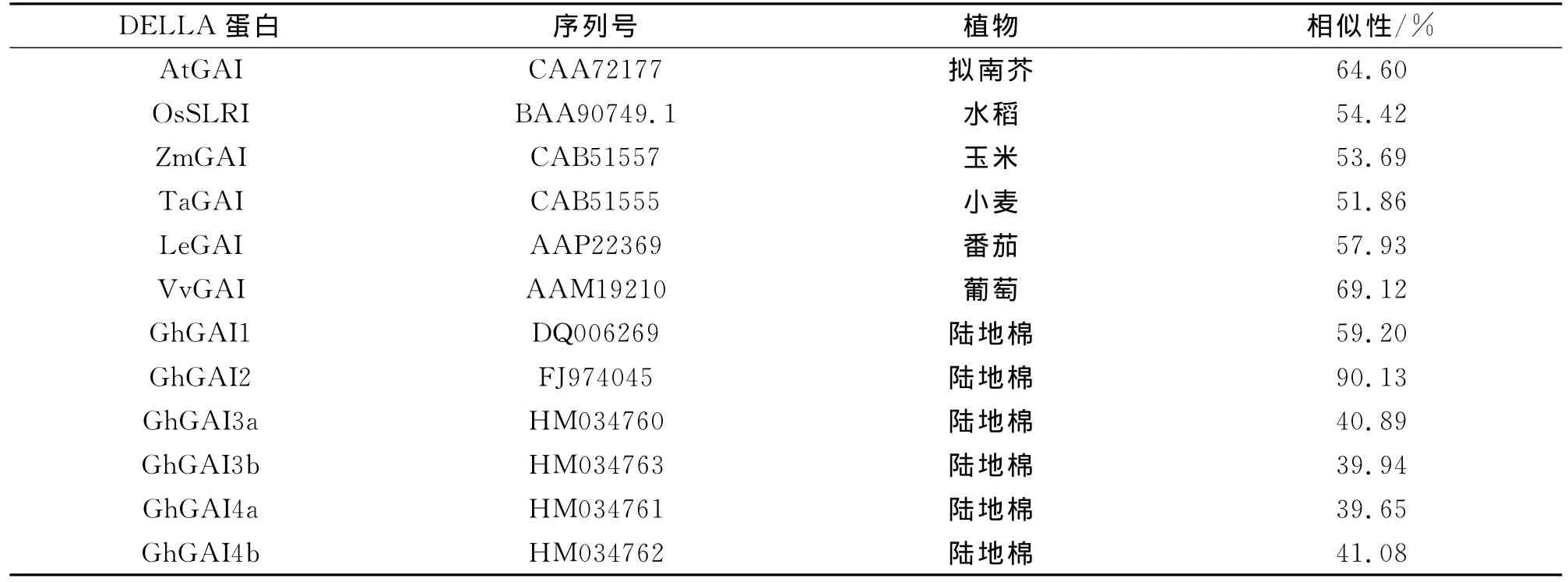
表2 海岛棉GbGAI2与已知植物DELLA蛋白相似性比较Tab.2 Identity analysis of amino acid sequence of putative GbGAI2 with other related proteins
构建海岛棉GbGAI2与已知植物DELLA蛋白氨基酸序列的系统发育树(图3),发育树中DELLA蛋白主要包括单子叶植物和双子叶植物。结合海岛棉Gb GAI2与已知植物DELLA蛋白全长氨基酸序列的相似性比较进行分析,发现GbGAI2与陆地棉Gh GAI2蛋白氨基酸序列相似性最高,系统发育树中处于最近的一个分支,此外,除陆地棉DELLA蛋白GhGAI3a、GhGAI3b、GhGAI4a和GhGAI4b外,海岛棉GbGAI2与其他双子叶植物DELLA蛋白氨基酸序列的相似性普遍高于单子叶植物,在发育树中处于一个分支,单子叶植物处于另一个分支。
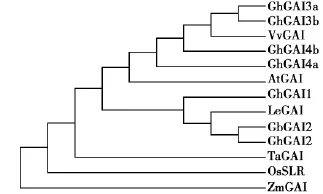
图3 海岛棉DELLA蛋白GbGAI2系统发育树分析Fig.3 Phylogenetic analysis of GbGAI2 protein with other related proteins
2.2 不同时期海岛棉胚珠中DELLA基因表达分析
棉花纤维形成和发育过程可分为纤维原始细胞分化和突起(1-2 DPA)、初生壁伸长(0-25 DPA)、次生壁增厚(20-45 DPA)及脱水成熟(45-50 DPA)4个相互重叠的时期[11]。本研究分析了DELLA蛋白基因GbGAI2在海岛棉胚珠不同发育阶段表达情况。由图4可见,海岛棉DELLA蛋白基因Gb-GAI2在花后胚珠发育的各个阶段均有表达,但不同阶段表达量明显不同。Gb GAI2在海岛棉胚珠发育的初始阶段(1-5 DPA)有高表达量,之后略有降低,自第9 DPA开始表达量又有所上升,说明DELLA蛋白GbGAI2可能在棉纤维发育的起始阶段具有重要作用,并对棉花纤维的伸长起到一定作用。待胚珠生长至第23 DPA时,GbGAI2表达量达到最高,表明GbGAI2可能参与棉纤维次生壁加厚。

图4 海岛棉DELLA蛋白基因GbGAI2 1-25DPA胚珠组织的表达模式Fig.4 The expression level of DELLA gene of Gossiypium barbadense L.in ovule in 1-25DPA
3 讨论
赤霉素广泛存在于植物界中,在植物整个生命循环过程中起着重要的调控作用[12]。DELLA蛋白在赤霉素信号转导通路中起负调控作用,DELLA蛋白感知GA信号后通过泛素化通道降解,解除抑制[13]。研究表明DELLA蛋白在赤霉素信号转导体系中起重要作用,其在赤霉素与其他植物激素互作中的作用也得以阐明[13]。
本研究成功克隆得到了海岛棉DELLA蛋白基因GbGAI2,而且Gb GAI2基因所编码的氨基酸序列与已知其他物种DELLA蛋白氨基酸序列在保守区具有很高的一致性,具有GRAS家族蛋白的所有特征结构域,表明GbGAI2编码的蛋白产物属于DELLA蛋白家族的一种,很有可能参与海岛棉的GA信号转导。
比较Gb GAI2与已知DELLA蛋白氨基酸序列的相似性,并结合DELLA蛋白系统发育树进行分析,发现海岛棉GbGAI2蛋白与陆地棉DELLA蛋白GhGAI2氨基酸序列相似性最高。除陆地棉Gh-GAI3s、Gh GAI4s外,Gb GAI2与双子叶植物DELLA蛋白间的相似性普遍高于单子叶植物。Gb-GAI2与陆地棉Gh GAI3a、Gh GAI3b、Gh GAI4a和GhGAI4b间氨基酸序列相似性较低。已有研究结果表明Gh GAI1与拟南芥5个DELLA蛋白的氨基酸序列相似性为58~64%[8],而 GhGAI3a、Gh-GAI3b、Gh GAI4a和Gh GAI4b与其他物种中DELLA蛋白的相似性为38~40%,具有较大的分歧[9]。
有关拟南芥DELLA蛋白的研究表明,DELLA蛋白是GA调节下控制编码毛状体发生激活因子基因所必须的,失去功能的GAI对毛状体发生有显著的影响[14]。Yang等[15]对棉花中DELLA蛋白的研究发现,1个DELLA蛋白GAI基因在开花前3 d的表达量最高,开花当天的表达量有较大幅度的下降,开花后3 d和开花后5 d的表达量与开花当天相比并没有显著的改变,而在棉花无毛突变体中相应的发育时期中,GAI的表达量比野生型棉花均有较大幅度的降低,说明GAI基因在棉纤维发育的过程中起到重要作用,特别是在起始时期。
本实验分析了DELLA蛋白基因GbGAI2在海岛棉花后胚珠不同发育阶段表达量的差异。发现GbGAI2可能对棉纤维原始细胞的起始分化以及棉纤维次生壁加厚过程中发挥作用。本研究为进一步弄清楚DELLA蛋白对海岛棉棉纤维生长发育的作用机制,提供了一些基础数据。
[1]黄先忠,马正强.DELLA家族蛋白与植物生长发育的关系[J].植物生理学讯,2004,40(5):529-532.
[2]Graves D A,Stewart J M.Chronology of the differentiation of cotton(Gossypium hirsutum L.)fiber cells[J].planta,2004,175(2):254-258.
[3]曲庭云,王栓锁,彭明,等.海岛棉DELLA蛋白编码基因GbGAI的克隆与功能初步分析[J].中国农学通报,2010,26(13):30-35.
[4]Itoh H,Ueguchi Tanaka M,Sato Y,et al.The gibberellin signaling pathway is regulated by the appearance and disappearance of SLENDER RICE1 in nuclei[J].Plant Cell,2002,14:57-70.
[5]Ueguchi Tanaka M,Ashikari M,Matsuoka M,et al.GIBBERELLIN INSENSITIVE DWARF1 encodes a soluble receptor for gibberellin[J].Nature,2005,437:693-698.
[6]Peng J,Carol P,Richards D E,et al.The Arabidopsis GAI gene defines a signaling pathway that negatively regulates gibberellin responses[J].Genes Dev,1997,11:3194-3205.
[7]赵永斌.植物GRAS蛋白的结构与功能[J].吉林师范大学学报:自然科学版,2007,28(4):29-31.
[8]廖文彬,崔百明,温玮,等.赤霉素负调控因子Gh RGL(RGL-LIKE)基因序列与功能预测分析[J].热带作物学报,2009,30(2):170-175.
[9]Wen W,Cui B M,Yu X L,et al.Functional analysis of cotton DELLA-Like genes that are differentially regulated during fiber development[J].Plant Mol Biol Rep,2012,30(4):1014-1024.
[10]蒋建雄,张天真.利用CTAB/酸酚法提取棉花组织总RNA[J].棉花学报,2003,15(2):166-167.
[11]倪志勇,吕萌,范玲.棉花Gh4CL1基因的克隆及表达[J].西北植物学报,2010,30(5):876-882.
[12]Fleet C M,Sun T P.A DELLA cate balance:the role of gibberellin in plant morphogenesis[J].Curr Opin Plant Biol,2005,8:77-85.
[13]黄先忠,蒋才富,廖立力,等.赤霉素作用机理的分子基础与调控模式研究进展[J].植物学通报,2006,23(5):499-510.
[14]Yinbo Gan,Chang Liu,Hao Yu,et al.Integration of cytokinin and gibberellin signalling by Arabidopsis transcription factors GIS,ZFP8 and GIS2 in the regulation of epidermal cell fate[J].Development,2007,134:2073-2081.
[15]Yang S S,Cheun F,Lee J J,et al.Accumulation of genome-specific transcripts,transcription factors and phytohormonal regulators during early stages of fiber cell development in allotetraploid cotton[J].The Plant Journal,2006,147:761-775.
