碱性条件下一异丙基萘氧化合成过氧化物
2012-11-09陈倩文靳海波杨索和郭志武何广湘
陈倩文,靳海波,杨索和,郭志武,何广湘
(北京石油化工学院 化工系,北京 102617)
碱性条件下一异丙基萘氧化合成过氧化物
陈倩文,靳海波,杨索和,郭志武,何广湘
(北京石油化工学院 化工系,北京 102617)
在碱性条件下,以空气为氧化剂氧化一异丙基萘(IPN)制备一异丙基萘过氧化物(IPNHP)。分别以NaOH和Na2CO3为催化剂、异丁醛和H2O2为引发剂,考察了催化剂种类和含量、引发剂种类、反应温度等因素对IPN转化率和IPNHP选择性的影响。实验结果表明,以Na2CO3为催化剂时IPN转化率较低,而以NaOH为催化剂时,IPN转化率明显增加,但反应速率较慢;加入引发剂可加快反应速率,但以H2O2为引发剂时,副产物较多,IPNHP选择性较差,而以异丁醛为引发剂时,IPNHP选择性大幅度提高。在反应温度100 ℃、异丁醛为引发剂(w=0.1%)、NaOH为催化剂(w(Na+)=1.5%)、氧气流量10 L/h时反应效果最好,IPN转化率最高达到26.5%,IPNHP选择性最高达到68.0%。
催化氧化;一异丙基萘;一异丙基萘过氧化物;氢氧化钠;异丁醛
萘酚包括1-萘酚和2-萘酚两种异构体,是重要的有机化工原料,广泛应用于有机颜料、橡胶助剂、医药和农药中间体等领域[1-5]。由于萘酚的应用领域不断扩大,导致市场需求量不断增加。目前,合成萘酚的主要方法有:磺化碱熔法、2-氯萘水解法、过氧化氢法和一异丙基萘(IPN)氧化法等[6]。其中应用最广的是磺化碱熔法,该方法存在着生产工艺复杂、流程长、设备腐蚀严重以及污染环境等缺点。而与异丙苯法制苯酚丙酮相似的IPN氧化法被认为具有清洁、原子经济性强等优势。该方法的合成路线是先由萘和丙烯烷基化得到IPN[7],再通过氧化得到一异丙基萘过氧化物(IPNHP),最后经酸分解得到萘酚和丙酮。目前,IPN氧化法仅在日本少数工厂实现了规模化生产,其氧化技术及工艺的安全性(系统中存在大量的过氧化物)是合成技术的关键,因此该工艺过程仍在不断地研究完善。
目前,已有很多研究者采用碱金属盐、碱性稀土金属盐、过渡金属、过渡金属盐等作为催化剂应用于烷基芳烃的氧化反应中,如在异丙苯氧化反应中,Topchiev等[8]以NaOH,Na2CO3,NaHCO3,Ca(OH)2,CaCO3,BaO2,BaCO3等为催化剂,可得到较高的过氧化氢异丙苯收率。Emanuel等[9]在异丙苯氧化反应介质中加入碱金属和碱金属盐,由于中和了酸性产物,加速了氧化反应链引发阶段的速率。此外,因氧化反应为自由基链式反应[10],为加快反应速率,需在反应中加入引发剂。Sheldon等[11-13]在环己烯和1-辛烯的氧化反应中使用过氧化苯甲酰、过氧化叔丁基、过氧化乙酰、过氧叔丁醇等过氧化物为引发剂,可得到较高的环己烯、1-辛烯环氧化产物收率,但副产物较多。Takac等[14-16]对2-异丙基萘氧化过程进行了系列研究,考察了以Cu为催化剂的氧化动力学以及NaOH溶液和有机、无机引发剂对氧化反应的影响。
本工作以空气为氧化剂氧化IPN,采用碱性催化剂和不同类型的引发剂,考察了催化剂种类和含量、引发剂种类、反应温度等因素对IPN氧化反应的影响。
1 实验部分
1.1 试剂
异丁醛:分析纯,美国Fluka公司;H2O2: 化学纯,天津福晨化学试剂厂;NaOH、Na2CO3、硫代硫酸钠:化学纯,北京化工厂;IPN混合物(w):β-IPN 80.1%,α-IPN 16.8%,萘等其他组分3.1%。
1.2 实验装置
实验装置采用集热式恒温磁力搅拌反应器,能根据设定值自动控制反应温度和搅拌转速。空气由高压空气钢瓶经气体体积流量计计量后通入反应器,反应器气体出口处装有冷凝器,可将反应混合物蒸气冷凝回反应器内。
1.3 反应产物的分析
采用硫代硫酸钠标准溶液滴定反应产物中的IPNHP,并按式(1)计算IPNHP的含量(wIPNHP):

式中,V为消耗的硫代硫酸钠标准溶液体积, mL。
反应产物中其他组分的分析采用气相色谱法。采用岛津公司GC-14C型气相色谱仪,Clarity(P/N 456-06000)工作站。SE-54色谱柱(50 m×0.20 mm×0.33μm),柱头压137.9 kPa;载气为氮气,流量0.5 mL/min;进样口温度290 ℃;检测器(FID)温度300 ℃;柱温采用程序升温:起始温度150 ℃保持10 min,升温速率2 ℃/min,终温270 ℃保持15 min;分流比90∶1。采用面积归一化法进行定量。
1.4 转化率和选择性的计算
根据分析结果,按式(2)和式(3)计算IPN转化率(XIPN)和IPNHP选择性(SIPNHP):

式中,n(IPN)F,n(IPN)P分别为反应进料和产物中IPN的物质的量,mol;n(IPNHP)为反应产物中IPNHP的物质的量,mol。
2 结果与讨论
2.1 催化剂和引发剂种类的影响
在IPN氧化反应中IPNHP为主产物,但在一些反应条件下,会产生一定量的二甲基-2-萘甲醇、2-萘乙酮、2-异丙烯基萘和二异丙基萘等副产物。由于这些副产物呈酸性,极易将主产物IPNHP分解,降低IPNHP的收率。因此,应尽量避免副产物的产生。根据自由基链反应机理,过氧化物的形成、反应物转化率和产物分布很大程度上是由引发剂和催化剂活性决定的。
本实验选择Na2CO3和NaOH为催化剂、异丁醛和H2O2为引发剂,考察了催化剂和引发剂种类对IPN氧化反应的影响,实验结果见图1。由图1可看出,在不添加引发剂的条件下,当反应温度和氧气流量一定时,以Na2CO3为催化剂时,wIPNHP非常低,当反应时间超过24 h时,wIPNHP也没有明显增加,一直低于1.5%;而以NaOH为催化剂时,wIPNHP明显增加,在反应时间15 h内,IPN转化率基本不变,IPNHP选择性超过了60.0%。 说明NaOH的催化作用较好,但所需反应时间仍较长。当在NaOH催化体系中加入引发剂后,在反应时间10 h内,以异丁醛为引发剂时,wIPNHP达到13.4%,IPN转化率也大幅度提高(最高达到24.6%);但IPNHP选择性不如未加入异丁醛时的高,可见加入强氧化性的引发剂会导致副反应的发生。该现象以加入H2O2引发剂时尤为明显:IPNHP选择性在反应3 h时增加到28.0%,wIPNHP最高只达到6.4%,并且两者均随反应时间的延长而逐渐降低。由于H2O2的强氧化性及其受热分解生成的自由基,使得IPN转化率在反应7 h左右时达到最高值30.8%,且反应速率大幅加快;但因为H2O2在碱性溶液中极易分解,且在反应温度90 ℃下其分解速率加快,引发剂过早消耗,所以IPNHP选择性在反应4 h后开始下降。由此可见,以NaOH为催化剂、异丁醛为引发剂时,IPN转化率和IPNHP选择性均较好,是比较理想的组合。

图1 催化剂和引发剂种类对wIPNHP(a),SIPNHP(b),XIPN(c)的影响Fig.1 The effects of the type of catalyst and initiator on wIPNHP(a),SIPNHP(b),XIPN(c). Reaction conditions:w(Na+)=1.0%,90 ℃,O2 flux 10 L/h.
2.2 催化剂含量的影响
在氧化反应中,溶液的pH可改变产物的分布。如:碱浓度较低会导致酸性化合物的形成,碱浓度过高会导致醇式化合物的形成[13-14]。因此, 以NaOH为催化剂、异丁醛为引发剂、考察了催化剂含量(以w(Na+)计)对IPN氧化反应的影响,实验结果见图2。由图2可看出,当w(Na+)从0.5%增至1.5%时,wIPNHP和IPN转化率都增加,wIPNHP最高可达15.6%,说明增大溶液的pH可增加wIPNHP。这是因为随初始溶液中NaOH含量的增加,引入反应中间体的Na+增多。但w(Na+)增至2.0%时,wIPNHP降低,在反应时间10 h内,wIPNHP最高只有3.9%。由图2还可看出,当w(Na+)=0.5%时, IPNHP选择性随反应时间的延长而逐渐增大;当w(Na+)增至1.5%时,IPNHP选择性均维持在较高的水平,最高可达68.0%。但当w(Na+)增至2.0%时,IPNHP选择性明显下降,在30.0%以下,与wIPNHP下降的情况一致。这是因为IPNHP呈酸性,过量的碱会中和一部分IPNHP,生成大量副产物。而对于IPN转化率,当w(Na+)从0.5%增至2.0%时,IPN转化率不断增加,这是因为随NaOH含量的增加,引入反应中间体的Na+增多;当反应后期因Na+被不断消耗,IPN转化率有所下降。综上所述,在IPN氧化反应中,w(Na+)=1.5%时,IPNHP的含量、选择性和IPN转化率均维持在较高的水平。
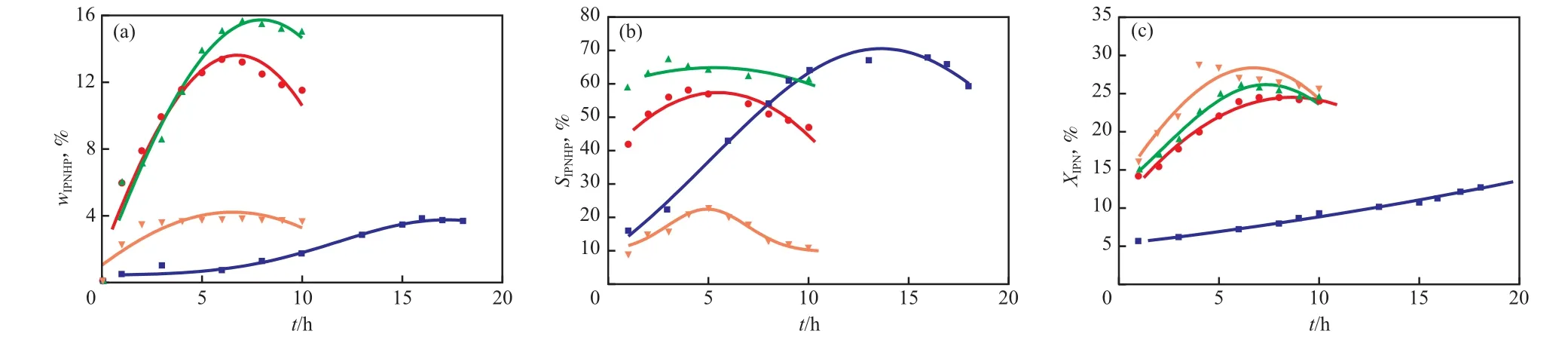
图2 催化剂含量对wIPNHP(a),SIPNHP(b),XIPN(c)的影响Fig.2 The effects of the catalyst content on wIPNHP(a),SIPNHP(b) and XIPN(c).
2.3 反应温度的影响
过氧化物是热敏性的化合物,在过高的温度下,容易分解为自由基产物和分子产物。因此,考察反应温度对IPN氧化反应的影响。考虑氧化反应速率、反应时间和过氧化物的热分解性质,设 置反应温度为90,100,110 ℃,实验结果见图3。

图3 反应温度对wIPNHP(a),SIPNHP(b),XIPN(c)的影响Fig.3 The effects of reaction temperature on wIPNHP(a),SIPNHP(b) and XIPN(c).Reaction conditions:NaOH as catalyst,0.1%(w)isobutyraldehyde as initiator,w(Na+)=1.5%,O2 flux 10 L/h. Reaction temperature/℃:■ 90;● 100;▲ 110
由图3可看出,当反应温度从90 ℃升至100 ℃时,wIPNHP和IPN转化率随反应温度的升高而增大;在反应时间22 h内,wIPNHP最高达到19.2%,IPN转化率最高达到26.5%。说明升高温度有利于IPN氧化反应的发生。但当反应温度升至110 ℃时,反应初期wIPNHP和IPN转化率迅速增加,反应6 h后两者急剧下降。反应温度对IPNHP选择性的影响也呈现相同的情况。反应温度从90 ℃升至100 ℃时,IPNHP选择性均维持在较高水平,在100 ℃时IPNHP选择性最高达到68.0%。出现这个现象的原因有两种:(1)反应温度升高,可促进IPN热分解生成自由基,因此可加速后续自由基链反应的发生,所以在100 ℃时IPNHP的含量和选择性均高于90 ℃时的值。但IPNHP的分解速率也随反应温度的升高而加快,因此在110 ℃时,由于IPNHP分解为分子产物,导致其在产物中的含量降低,选择性也降低。(2)反应温度升高,也有利于H2O2自由基进入萘环中,生成自由基清除剂,降低了自由基的含量[13],降低了目标产物IPNHP的选择性。所以,IPN氧化反应的温度必须严格控制,适宜的反应温度为100 ℃。
3 结论
(1)对于IPN氧化反应,以Na2CO3为催化剂时IPN转化率较低,并且反应产物中IPNHP的含量也很低;而以NaOH为催化剂时,反应产物中IPNHP的含量明显增加,IPN转化率也明显增加, 但反应时间较长。
(2)加入引发剂反应速率大幅加快,但以H2O2为引发剂时,副产物较多,IPNHP选择性偏低;而以异丁醛为引发剂时,IPNHP选择性和IPN转化率大幅提高,是较理想的引发剂。
(3)IPN氧化反应适宜的反应条件为:NaOH为催化剂,异丁醛为引发剂,w(Na+)=1.5%,异丁醛含量为0.1%(w), 氧气流量10 L/h,反应温度100 ℃。在此条件下,IPN转化率最高达到26.5%,IPNHP选择性最高达到68.0%。
[1] 梁诚. 2-萘酚及其衍生产品合成工艺进展[J]. 染料工业,2001,38(5):16 - 19.
[2] 杨辉琼. 萘酚的绿色合成[J]. 江苏化工,2007,35(5):34 - 37.
[3] 许杰,房明,张玉明,等. 萘下游产品的生产及市场现状[J].精细化工中间体,2003,33(4):6 - 8.
[4] 张天永,杨秋生,卢洲,等. 萘酚的催化合成技术进展[J].化工进展,2009,28(1):55 - 56.
[5] 魏文德. 有机化工原料大全[M]. 北京:化学工业出版社,1999. 961 - 963.
[6] PCUK-Produits Chimiques Ugine Kuhlmann. Regioselective Preparaion ofα- orβ-Naphthol:US,4419528[P]. 1983 -12 - 06.
[7] 钟海军,柳云骐,冯锡兰,等. 硅改性Hβ沸石催化萘异丙基化反应[J]. 石油化工,2007,36(5):479 - 484.
[8] Topchiev A V,Zavgorodnii S V,Kryuchkova V G. Alkylation with Olefins[M]. Amsterdam:Elsevier,1964:48 - 51.
[9] Emanuel N M,Denisov Z K. Liquid Phase Oxidations of Hydrocarbons[M]. New York:Plenum Press,1967:16 - 18.
[10] 吴志强,靳海波,韩占生,等. 2,6-二异丙基萘液相氧化制2,6-萘二甲酸催化条件的研究[J].石油化工,2004,33(7):647 - 650.
[11] Sheldon R A,Kochi J K. Metal-Catalyzed Oxidations of Or-ganic Compounds in the Liquid Phase[J].Appl Catal,A,1976,25(13):272 - 413.
[12] Hatch L F,Matar S. Hydrocarbon Process[M]. Amsterdam:Elsevier,1978:294 - 297.
[13] Sheldon R A,van Doon J A. Metal-Catalyzed Epoxidation of Olefins with Organic Hydroperoxides:Ⅰ. A Comparison of Various Metal Catalysts[J].J Catal,1973,31(3):427 - 437.
[14] Takac S,Ozdamar T H. Oxidation of 2-Isopropylnaphthalene to 2-Isopropylnaphthalene hydroperoxide[J].Appl Catal,A,1993,95(1):35 - 51.
[15] Boyac F G,Takaç S,Özdamar T H. Catalytic Effects of NaOH on the Liquid-Phase Oxidation of 2-Isopropylnaphthalene[J].Appl Catal,A,1998,172(1):59 - 66.
[16] Boyac F G,Takaç S,Özdamar T H. Effects of Organic and Inorganic Lnitiator-Catalysts on the Liquid-Phase Oxidation of 2-Isopropylnaphthalene[J].Appl Catal,A,2000,197(2):279 - 287.
Synthesis of Isopropylnaphthalene Hydroperoxide from Isopropyl Naphthalene in Alkaline Solution
Chen Qianwen,Jin Haibo,Yang Suohe,Guo Zhiwu,He Guangxiang
(Department of Chemical Engineering,Beijing Institute of Petrochemical Technology,Beijing 102617,China)
Isopropylnaphthalene hydroperoxide(IPNHP) was synthesized from isopropyl naphthalene(IPN) with air as oxidant,NaOH or Na2CO3catalyst,and isobutyral dehyde or hydrogen peroxide as initiator in alkaline solution. The effects of catalyst type,catalyst concentration,initiator type and reaction temperature on conversion of IPN and selectivity to the target product IPNHP were investigated. The results showed that under the optimal conditions of NaOH as catalyst(w(Na+)=1.5%),isobutyraldehyde as initiator(w=0.1%),reaction temperature 100 ℃ and O2flux 10 L/h,the conversion of IPN and the selectivity to IPNHP could reach 26.5% and 68.0%,respectively.
catalytic oxidation;isopropyl naphthalene;isopropylnaphthalene hydroperoxide;sodium hydroxide;isobutyraldehyde
1000 - 8144(2012)03 - 0283 - 05
TQ 243.1
A
2011 - 08 - 12;[修改稿日期]2011 - 12 - 27。
陈倩文(1986—),女,江西省景德镇市人,硕士生。联系人:靳海波,电话 010-81292074,电邮 jinhaibo@bipt.edu.cn。
国家自然科学基金项目(21073020);北京市属高等学校人才强教深度计划资助项目(PHR200906139)。
(编辑 安 静)
进展与述评
