加巴喷丁对癫痫持续状态大鼠海马区神经元凋亡的影响
2012-11-07王克玲刘新艳王静施荣富孙素真
王克玲 刘新艳 王静 施荣富 孙素真
癫痫发作,尤其是癫痫持续状态(status epilepticus,SE)不仅会增加癫痫患者的死亡率,还可造成神经元坏死和凋亡,长期影响癫痫患者的生存质量。因此在控制癫痫发作的同时防止神经元坏死和凋亡的脑保护剂成为研究重点。已发现一些抗癫痫药具有抗凋亡作用[1]。加巴喷丁(gabapentin,GBP)是新在我国临床使用的抗癫痫药,它在抗癫痫同时是否具有神经元保护作用尚不清楚。本研究用戊四氮(pentylenetetrazol,PTZ)制造大鼠癫痫持续状态癫痫模型,用GBP进行干预,用缺口末端标记法(TUNEL)法检测海马CA1、CA3区凋亡情况,以探讨GBP的抗凋亡作用。
1 材料与方法
1.1 实验动物 健康雄性Sprague-Dawley(SD)大鼠48只,体重(180±20)g,由河北省试验动物中心提供,许可证号:SCXK(冀)2003-1-003。PTZ(美国 Sigma公司)。GBP(-),TUNEL试剂盒(德国宝丽曼);显微镜[日本,BHS(Olympus),脱水机(英国姗顿公司,Citadel 2000)],包埋机(英国姗顿公司,Histocentres),切片机(英国姗顿公司,AS-325),显微镜(日本,BHS,Olympus)。
1.2 方法
1.2.1 分组:SD大鼠48只。随机分为加巴喷丁组(GBP组)、加巴喷丁干预组(干预组)、戊四氮致痫组(PTZ组)、对照组,每组12只。
1.2.2 癫痫造模:SE 模型采用 PTZ 60 mg·kg-1·d-1腹腔注射,每24小时1次,每次注射后观察30 min,观察并记录发作潜伏期、发作时行为表现和持续时间。大鼠惊厥行为表现采用Racine六级评价标准[2]。0级:无任何反应;Ⅰ级:湿狗样抖动、面肌痉挛如眨眼、动须、及节律性咀嚼;Ⅱ级:颈部肌肉痉挛表现为点头和(或)甩尾;Ⅲ级:一侧前肢阵挛;Ⅳ双侧前肢阵挛伴站立;Ⅴ级:全身阵挛,失去平衡,跌倒。记录发作时的行为表现。PTZ注射期间出现racineⅣ~Ⅴ级惊厥发作持续30 min,连续3 d未死亡者为SE成功,成功率75%。干预组于致痫成功后给予GBP灌胃,每天600 mg/kg;PTZ组照常喂养;GBP组给予未致痫大鼠GBP 600 mg/kg;对照组给予等体积0.9%氯化钠溶液灌胃,所有喂药均每天分2次给予,共5 d。
1.2.3 脑电图描记:每组大鼠取2只进行脑电图描记。用10%水合氯醛35 mg/kg给予大鼠腹腔注射麻醉,电极位置采用单极导联法,记录电极取两根0.5寸针灸毫针分别刺入大鼠顶骨正中左右两侧头皮下,再用导线连接于脑电图机信号输入盒,大鼠尾根部电极接地。先观察行为学改变,然后描记脑电图。
1.2.4 标本制备:10%水合氯醛35 mg/kg腹腔注射麻醉。输液架距大鼠心脏高度控制在1.5 m。打开胸腔暴露心脏。找到心尖部,右手将灌流针刺破心尖部进针入主动脉。先以0.9%氯化钠溶液快速灌流,直到从右心耳流出无色液体,肠系膜颜色变苍白,肝脏颜色变淡黄,随后灌注4℃预冷的4%的多聚甲醛溶液250 ml(0.1 mol/L PB配液,pH值7.4)。开始全速灌流,注意观察大鼠,直到看到大鼠四肢突然紧张,肌肉阵挛,尾部卷曲上翘转至其四肢肌肉抽搐停止,此时改为缓慢滴灌,至大鼠躯干、四肢、尾部僵直,肝脏变硬,说明达到固定目的。灌注时间控制在1.5 h左右。在视交叉和乳头体处垂直横断脑组织,将含有海马的中段脑组织置于4%多聚甲醛溶液。常规脱水、透明、石蜡包埋。用石蜡切片机,自视交叉向后冠状位连续石蜡切片,切至出现海马结构,每片厚度5 μm,每隔5张取1张,每个标本区2张用于TUNEL检测。常规脱蜡入水、PBS洗3次、显色、复染、常规脱水透明封固、镜下观察海马组织细胞凋亡。
1.2.5 TUNEL检验凋亡阳性细胞:TUNEL染色严格按试剂盒说明书步骤进行操作。细胞核染成棕褐色的为凋亡阳性细胞。每张切片海马部位分别至少观察CA1和 CA3区10个具有代表性的高倍视野(100×),计数每个视野中染色阳性的细胞数,计算出凋亡指数。细胞凋亡指数(apoptotic index,AI)=凋亡细胞数/细胞总数×100%。
1.3统计学分析应用SPSS 13.0统计软件,计量资料以±s表示,组间两两比较F检验,,P<0.05为差异有统计学意义。
2 结果
2.1 3组SE大鼠海马区CA1、CA3 TUNEL阳性细胞表达 细胞核内TUNEL染色阳性细胞呈棕黄色小块和颗粒,对照组大鼠皮质可见散在的TUNEL阳性细胞,海马区CA1和CA3区未见TUNEL阳性细胞。PTZ组与正常对照组比较,皮层细胞层排列紊乱,细胞层数减少,海马区CA1和 CA3区可见TUNEL阳性细胞,细胞核呈现棕黄色,数量较多。干预组TUNEL阳性细胞明显少于PTZ组。见图1。
2.2 TNE阳性细胞数量分析 GBP组和对照组比较,差异无统计学意义(P>0.05);PTZ组与对照组比较,PTZ组增多(P<0.01);PTZ组与干预组比较,干预组凋亡细胞少于PTZ组(P <0.05)。见表1。
表1GBP对SE大鼠海马神经AI的影响n=12,±s

表1GBP对SE大鼠海马神经AI的影响n=12,±s
75±9 12±5 GBP组 10±5 PTZ组 88±12干预组组别 凋亡指数对照组
3 讨论
过去认为癫痫发作造成的神经元损害主要表现为坏死,但近来国内外研究证实,癫痫发作后神经细胞的死亡方式除坏死外还存在凋亡[3]。还有人认为癫痫的主要病理改变是细胞凋亡[1]。癫痫动物模型的研究表明,癫痫发作可导致海马、杏仁核、大脑皮质、丘脑及小脑等部位神经元丧失[4],颞叶癫痫的脑边缘区特别是海马呈现显著的神经元丧失。神经元丧失包括坏死、凋亡和不易区分的混合形态3种类型。在人类颞叶癫痫患者及各种SE模型中用形态学生化的方法均证实,神经元的损伤具有典型的凋亡征[5]。SE是指1次发作30 min以上,或30 min内发作多次,期间神智清醒者。SE对神经元的损伤更为严重,有学者认为癫痫持续时间长短决定海马神经元死亡的形式[6]。本实验用戊四氮致癫痫持续状态后发现SE大鼠海马区CA1C和A3的凋亡细胞显著增加,提示SE确实能引起神经元的凋亡与有关研究报告一致[7]。既然细胞凋亡是SE后神经元丢失的重要形式。因此,阻断凋亡就成为保护癫痫患者脑损伤的新途径。
近十年新型抗癫痫药已在我国广泛应用,对这些抗癫痫药物是否也具有抗凋亡的神经保护作用成为研究重点。已有研究认为托吡酯和左乙拉西坦具有保护因癫痫发作造成的海马神经元损害[1,8]。GBP有无神经元保护作用尚不清楚。本实验用发现PTZ制造的SE模型海马CA1和CA3区凋亡细胞显著多于对照组,提示SE确实可以引起神经元凋亡的发生,而加用GBP后,凋亡减轻,提示GBP保护癫痫发作引起神经元凋亡。虽然GBP结构与神经递质γ-氨基丁酸(GABA)相似,但它并不通过GABA机制直接发挥作用,并不作用于GABA的受体,不代谢成GABA或GABA激动剂,也不抑制GABA的摄取和降解,它的抗癫痫机制尚不明确。目前研究认为GBP通过Na+依赖性通道通过血脑屏障,结合于谷氨酸占优势的大脑皮质、海马及小脑的分子层,影响神经细胞膜的氨基酸转运而起到抗癫痫作用[9]。它在本实验中显示出抗凋亡作用是否和托吡酯一样也是通过拮抗兴奋性氨基酸的毒性作用还有待于进一步研究。
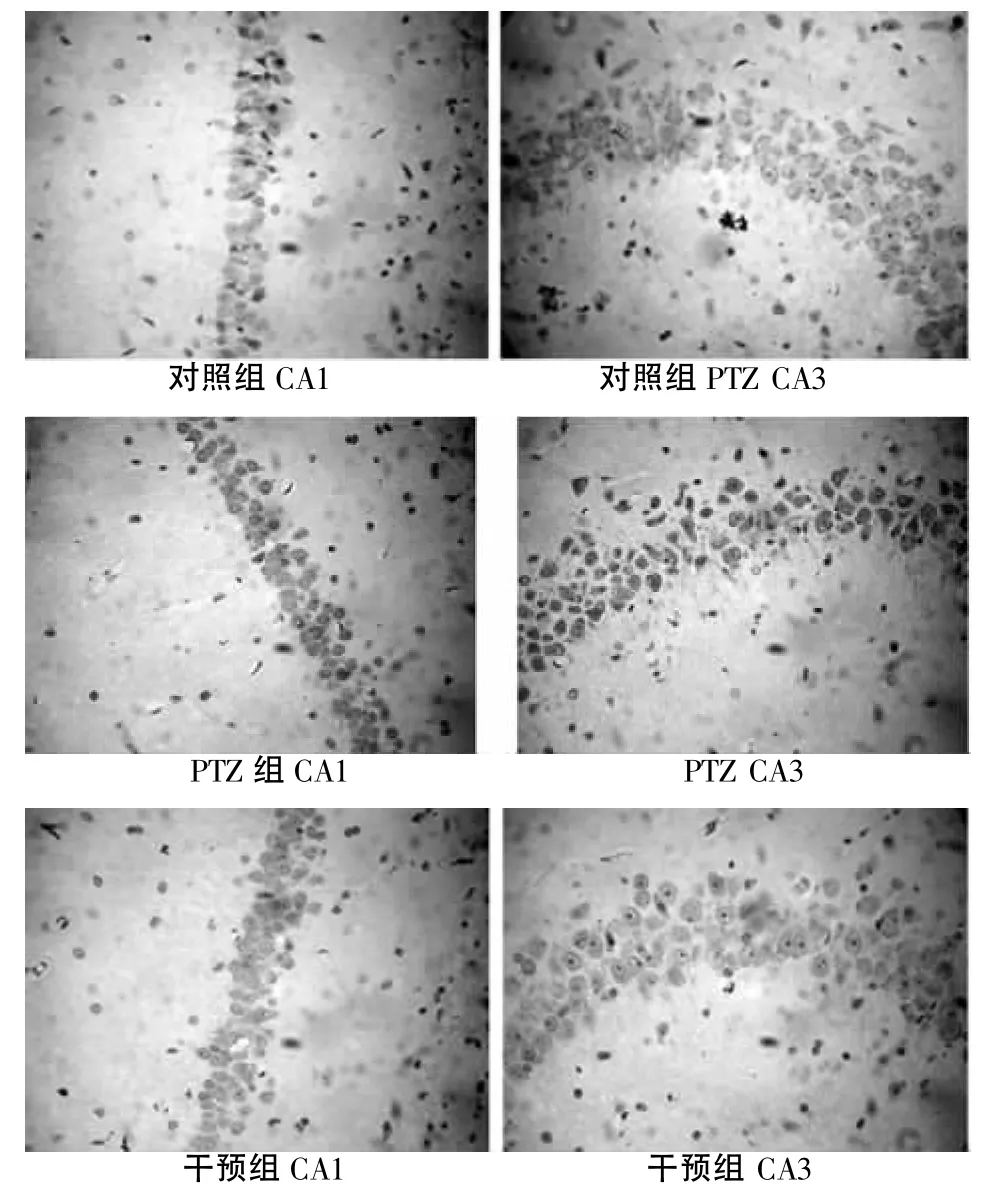
图1 3组SE大鼠海马区CA1、CA 3 TUNEL阳性细胞表达
随着对癫痫患者生活质量的重视,发现SE后脑损伤的发病率日益增高,有关SE中神经元保护的研究也不断取得进展,但癫痫发作所致的脑损伤机制相当复杂,各种因素相互影响。目前人们已将SE后神经元损伤的研究重点转移至线粒体和基因[10,11],认为线粒体是调控SE后神经元死亡的核心环节,线粒体的损伤、细胞色素C的释放和caspase-3的激活是神经元损伤的最后共同通路。基因的不正常表达也是癫痫性脑损伤的重要途径。这些发现为SE后脑保护治疗开辟了新的前景。
1 纪建波,张庆柱,李倩,等.托吡酯对癫痫持续状态大鼠海马神经元损伤的影响.山东医药,2006,46:23-24.
2 Racine RJ.Modification of seizure activity by electrical stimulation.II.Motor seizure.Electroencephalogr Clin Neurophysiol,1972,32:281-294.
3 丁瑛雪,高丽.癫痫的脑损伤研究进展.国际儿科学杂志,2007,34:17-20.
4 Bertram EH,Scott C.The pathological substrate of limbic epilepsy:neuronal loss in the medial dorsal thalamic nucleus as the consisterrt change.Epilepsia,2000,41:53-58.
5 Sarkar R,Shin DH,Liu H,et al.Patterns of status epilepticus induced neuronal injury during development and long term cones quences.Neurosci,1998,18:8382-8393.
6 陈玉华.癫痫发作诱导神经元死亡的机制.黄石理工学院学报,2011,27:58-61.
7 谢炜,于礼建,鲍勇,等.柴胡总皂贰对戊四氮致痛大鼠海马神经细胞凋亡.新中医,2006,38:87-88.
8 王学峰,张喻,彭希,等.癫病持续状态中海马神经元的保护:现状及展望.中国神经免疫学和神经病学杂志,2010,17:95-98.
9 李红霞,王孝蓉,赵志刚.抗癫痫药物加巴喷丁临床药物.治疗杂志,2006,4:49-53.
10 何斌,于会青.癫痫持续状态临床分析.河北医药,2011,33:2830.
11 Tan Z,Sankar R,Tu W,et al.Immunohistochemical study of p53-associated proteins in rat brain following lithium-pilocarpine status epilepticus.Brain Res,2002,929:129-138.
