超声提取法测定槐花中总黄酮含量
2012-11-07张学良樊钰库王霞英王丽宁夏固原市药品检验所宁夏固原756000宁夏固原市人民医院药剂科宁夏固原756000
张学良,樊钰库,王霞英,王丽(.宁夏固原市药品检验所,宁夏固原756000;.宁夏固原市人民医院药剂科,宁夏固原756000)
超声提取法测定槐花中总黄酮含量
张学良1*,樊钰库2,王霞英1#,王丽1(1.宁夏固原市药品检验所,宁夏固原756000;2.宁夏固原市人民医院药剂科,宁夏固原756000)
目的:用超声提取法测定槐花中总黄酮含量。方法:采用60%的乙醇超声提取槐花中的总黄酮,采用紫外可见分光光度法,在500 nm波长处测吸光度,计算样品中总黄酮的含量。结果:芦丁对照品溶液在4.0~20.0 μg·mL-1范围内线性关系良好,平均回收率为99.7%,RSD=0.98%(n=5)。结论:本方法工艺简单,采用超声提取、纯化方法得到的黄酮类物质其纯度较高,并且测定总黄酮含量的方法可靠。
超声提取法;槐花;总黄酮;含量测定
槐花是豆科植物槐(Sophora japonica L.)的干燥花及花蕾,一般将开放的花朵习称“槐花”,将花蕾习称“槐米”,具有凉血止血、清肝泻火的功效,用于治疗便血、痔血、血痢、崩漏、吐血、衄血、肝热目赤、头痛眩晕[1]。药理实验证明,槐花具有调节毛细血管渗透、抗炎、解痉、抗溃疡以及抗菌等作用[2]。槐花主要含有黄酮苷,槐花提取物可作为保健食品和营养食品等的原料,具有较高的药用、食用及保健价值[3]。超声技术应用于提取植物中的生物碱等研究近年来已有报道[4],但超声技术应用于提取槐花中总黄酮的研究还少见报道,本研究用超声提取法测定槐花中的总黄酮含量,现报道如下。
1 仪器与试药
1.1 仪器
KQ3200型超声波清洗器(工作频率40 kHz,昆山市超声仪器有限公司生产);UV-1901紫外可见分光光度计(上海分析仪器总厂生产);SHB-3型循环水真空泵(郑州长城科工贸有限公司生产)。
1.2 试药
试剂均为分析纯;芦丁对照品(中国药品生物制品检定所提供,批号:100080-200707,供UV法测定纯度为92.5%);新鲜槐花(市售)。
2 方法与结果
2.1 总黄酮的提取
取新鲜槐花,烘干、粉碎,称取粉末约3 g,加80 mL 60%乙醇,温度在60℃左右超声提取2次,每次1 h,抽滤,合并2次滤液,放置于250 mL容量瓶中,用60%乙醇洗涤滤渣并稀释至刻度,得样品提取液。
2.2 测定方法
以芦丁为对照品测定槐花中总黄酮的含量,加入铝离子试剂,同时控制适宜pH值[5],使黄酮化合物与铝盐形成络合物,在可见光区能获得稳定的特征吸收峰。
2.3 总黄酮含量的测定
2.3.1 波长的选择:取样品提取液适量,在0.30 mL 5%NaNO2溶液存在的碱性条件下,经Al(NO3)3显色后,以试剂为空白参比液在420~700 nm波长范围测定络合物的吸光度,在500 nm波长处有最大吸收,所以选用500 nm为测定波长。
2.3.2 对照品溶液的制备:精密称取105℃干燥至恒重的芦丁对照品5 mg置50 mL的容量瓶中(0.10 mg·mL-1),加入5%NaNO2溶液0.30 mL,摇匀,静置6 min后加10%的Al(NO3)3溶液0.30 mL,摇匀,静置6 min;再加4%NaOH溶液4.00 mL,用60%乙醇稀释至刻度,摇匀,静置12 min后测定。
2.3.3 样品溶液的制备:精密吸取样品提取液2 mL置25 mL容量瓶中,按对照品溶液的制备方法自“加入5%亚硝酸钠溶液0.30 mL”起制备样品溶液。
2.3.4 线性关系考察:分别精密吸取芦丁对照品溶液1.00、2.00、3.00、4.00、5.00 mL于25 mL容量瓶中,加60%的乙醇稀释至刻度后分别测定。以吸光度(A),为纵坐标、浓度(C)为横坐标,绘制标准曲线,得回归方程:A=-0.825+11.538 1C,r=0.999 9,在4.0~20.0 μg·mL-1范围内线性关系良好。2.3.5精密度试验:取芦丁对照品溶液,重复测定吸光度5次,结果RSD=1.25%(n=5),表明仪器精密度良好。
2.3.6 重现性试验:取同一槐花样品,平行制备5份样品溶液,依法测定5次,结果RSD=0.96%(n=5)。
2.3.7 稳定性试验:将样品液放置30、60、90、120 min后复测吸光度,结果基本稳定,RSD=0.2%。
2.3.8 加样回收率试验:精密称取已知含量的同批样品适量,平行操作5份,分别精密加入一定量的对照品依法操作,并计算加样回收率,测得样品中芦丁对照品的平均回收率为99.7%,RSD=0.98%(n=5),见表1 。
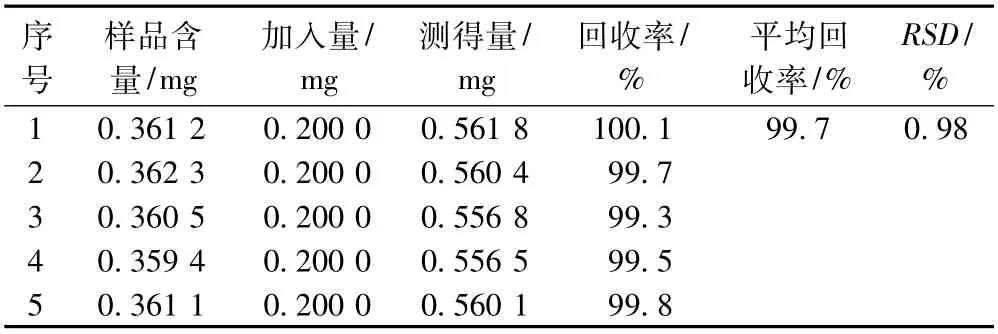
表1 加样回收率试验结果(n=5)Tab 1Results of recovery test(n=5)
2.3.9 样品含量测定:取样品溶液以空白试剂作参比液,于500 nm波长处测吸光度,按照上述回归方程:A=-0.825+11.538 1C,计算总黄酮的含量,见表2 。

表2 样品含量测定结果(n=3)Tab 2Results of content determination of total flavonoids in samples(n=3)
2.4 浓度、时间、料液比等因素对提取的影响
2.4.1 浓度对提取的影响:分别用20%、40%、60%、80%、95%的乙醇,以80 mL对3 g槐花进行提取2 h,提取结果表明,乙醇浓度对样品中黄酮类化合物提取影响较大,以60%的乙醇为最佳提取浓度。
2.4.2 时间对提取的影响:用60%乙醇分别对3 g槐花提取0.5、1、2、3、4 h,以每次1 h、合并提取2次共2 h的提取效果为最好。
2.4.3 溶剂量对提取的影响:对3 g槐花分别用40、60、80、100、120 mL的溶剂提取,实验表明以80 mL的溶剂量提取效果最好。
3 讨论
研究表明,本方法操作简单,比《中华人民共和国药典》(2010年版)规定的用索氏提取器加乙醚回流的方法简单易行,方法采用全物理过程,无污染,应用前景较好。采用本方法提取得到的总黄酮含量较高,建立总黄酮含量测定的方法准确可靠。
[1]国家药典委员会.中华人民共和国药典:一部[S].2010年版.北京:中国医药科技出版社,2010:677-679.
[2]夏杏洲,张辉,魏传晚.榕树叶中黄酮类化合物的提取条件研究[J].食品研究与开发,2002,23(5):35-37.
[3]张芳.HPLC法同时测定复方利血平片中苯磺酸氨氯地平和缬沙坦含量[J].中国医院用药评价与分析,2011,11(8):721-724.
[4]刘祥义.超声波提取元宝枫叶总黄酮方法研究[J].云南化工,2003,30(1):27-28.
[5]舒晓宏,冯梅,陈华,等.槐花米中芦丁提取最佳pH值的实验研究[J].大连医科大学学报,2005,27(2):91-92.
Determination of The Total Flavonoids Extracted Ultrasonically from Sophora Japonica L.:A Methodological Study
ZHANG Xue-liang1*,FAN Yu-ku2,WANG Xia-ying1#,WANG Li1(1.Ningxia Guyuan Institute for Drug Control,Ningxia Guyuan 756000,China;2.Ningxia Guyuan Municipal People’s Hospital,Ningxia Guyuan 756000,China)
OBJECTIVE:To determine the content of total flavonoids extracted ultrasonically from Sophora japonica L.METHODS:60%ethanol was used for ultrasonic extraction of total flavonoids from Sophora japonica L.,and the content of total flavonoids was determined by ultraviolet spectrophotometry in which the absorbance was measured at a wavelength of 500 nm,then the content of total flavonoids in the sample was figured out.RESULTS:Good linear relationship was achieved when rutoside control solution was at a concentration range of 4.0-20.0 μg·mL-1;the average recovery rate was 99.7%with RSD of 0.98%(n=5).CONCLUSION:The experimental method is simple;ultrasonic extraction and purification method results in high purity of flavonoids and the determination method for total flavonoids content is reliable.
Ultrosonic extraction;Sophora japonica L.;Total flavonoids;Content determination
R932
B
1672-2124(2012)09-0816-02
2012-01-08
2012-03-27)
