盐酸法舒地尔注射液与果糖注射液配伍的稳定性考察
2012-11-07徐梅韩强徐州医学院附属医院药剂科江苏徐州221002
徐梅,韩强(徐州医学院附属医院药剂科,江苏徐州221002)
盐酸法舒地尔注射液与果糖注射液配伍的稳定性考察
徐梅*,韩强#(徐州医学院附属医院药剂科,江苏徐州221002)
目的:考察盐酸法舒地尔注射液在室温[(25±2)℃]下与果糖注射液配伍的稳定性。方法:模拟临床用药浓度将盐酸法舒地尔注射液加入果糖注射液中,混合均匀后,在室温[(25±2)℃]下观察并测定6 h内配伍液的外观和pH值变化,采用高效液相色谱法测定法舒地尔的含量,并考察是有无新物质生成。结果:在室温[(25±2)℃]条件下,0~6 h配伍液的外观、pH值、盐酸法舒地尔的含量均无明显变化。结论:盐酸法舒地尔注射液与果糖注射液配伍,在室温[(25±2)℃]下6 h内配伍液稳定。
盐酸法舒地尔注射液;果糖注射液;配伍;稳定性;高效液相色谱法
盐酸法舒地尔是一种新型的钙通道阻滞剂和蛋白激酶抑制剂,其具有强烈的扩血管及对缺血脑组织的保护作用。盐酸法舒地尔可通过抑制细胞内游离钙离子的活动来阻断血管收缩过程最终阶段肌球蛋白轻链的磷酸化来扩张血管,以预防脑血管痉挛、改善脑缺血症状,并能抑制因细胞内钙离子增加而导致的各种酶系异常活动,起到保护脑神经细胞、改善预后、降低病死率的作用[1]。果糖注射液为营养药,具有补充热量,改善糖代谢的作用。果糖在体内代谢不依赖胰岛素的参与,可直接透过细胞膜参与糖代谢而不增加血糖浓度,其甜味及产热量与葡萄糖相仿,一般作为糖的代用品用于糖尿病患者[2]。临床上对于外科术后或高血压合并糖尿病的患者,为控制患者液体输注量或选择最适宜的溶剂[3],通常直接用果糖作为溶剂。盐酸法舒地尔注射液在治疗脑血管疾病伴糖尿病的患者时,能否与果糖注射液配伍使用,本文对此进行了稳定性考察。
1 仪器与试药
1.1 仪器
Waters高效液相色谱仪,1525型分离系统(含二元梯度洗脱系统、柱温箱等)、717型自动进样器、2487双波长紫外检测器、Empower色谱数据工作站;pHS-3B型pH计(上海精密科学仪器有限公司生产);UV-2401PC紫外分光光度计(日本岛津公司生产)及FA1004B电子天平(上海精密科学仪器有限公司生产)。
1.2 试药
盐酸法舒地尔注射液(天津红日药业股份有限公司生产,批号:1006011),盐酸法舒地尔对照品(纯度>99%,天津红日药业有限公司生产,批号080522),果糖注射液(江苏正大丰海制药有限公司生产,规格:250 mL,批号:1002091),甲醇为色谱纯,磷酸氢二钾及磷酸试剂均为分析纯,水为重蒸馏水(自制)。
2 方法与结果
2.1 色谱条件
色谱柱:Xterra RP18(4.6 mm×250 mm,5 μm);流动相:甲醇:0.01 mol·L-1磷酸二氢钾溶液(pH=4.5,以磷酸调节)(45:55);流速:1.0 mL·min-1;柱温:30℃;检测波长:275 nm;灵敏度:AUFS 2.0;进样量:20 μL。色谱图见图1 。
2.2 法舒地尔对照品溶液的制备
精密称取干燥至恒重的盐酸法舒地尔对照品30 mg,放置于100 mL容量瓶中,加蒸馏水溶解稀释至刻度,配制成浓度为300 μg·mL-1的对照品贮备溶液。
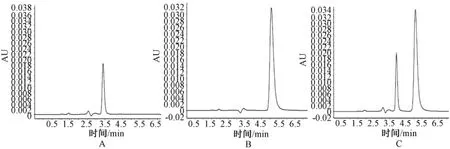
图1 高效液相色谱图Fig 1HPLC chromatograms
2.3 标准曲线的制备
精密量取上述对照品溶液稀释成含法舒地尔6.0、12.0、18.0、24.0、30.0、36.0、42.0 μg·mL-17个浓度的溶液,按“2.1”项下条件进样测定,记录色谱。以浓度(C)为横坐标,相应峰面积(A)为纵坐标,进行线性回归,回归方程为:A=1.288 8×104 C-7.965×103,r=0.999 9(n=7)。结果表明,在上述浓度范围内线性关系良好。
2.4 精密度试验
按“2.3”项下质量浓度为24.0 μg·mL-1的法舒地尔对照品溶液进样20 μL,重复6次,记录色谱。结果,法舒地尔的峰面积RSD为0.09%(n=6)。
2.5 回收率试验
精密吸取盐酸法舒地尔贮备液适量,分别按一定比例加入果糖注射液,并用蒸馏水稀释成含法舒地尔浓度为12.0、24.0、36.0 μg·mL-1的溶液,在275 nm处分别测定吸收度峰面积(A)值,并代入标准曲线方程计算浓度,并计算回收率,结果见表1 。
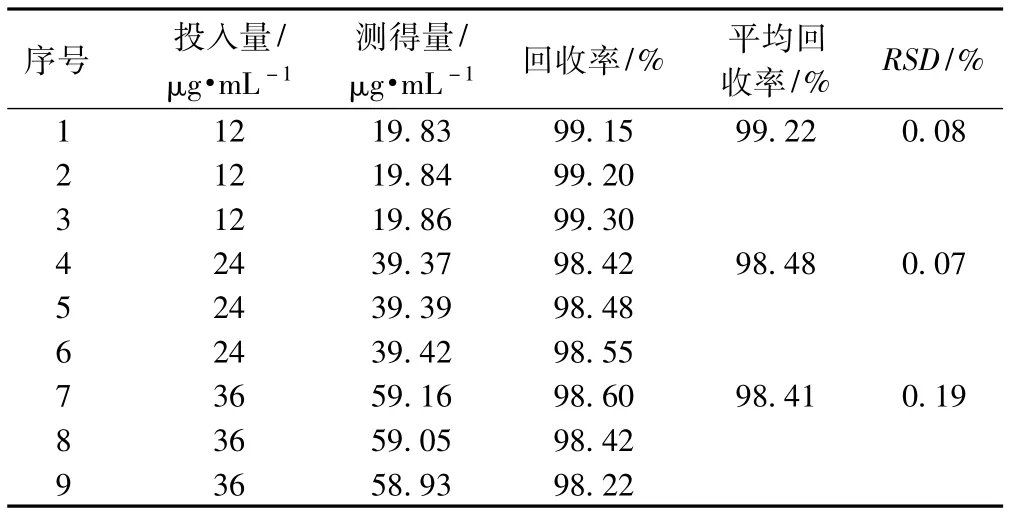
表1 回收率试验结果(n=9)Tab 1Results of recovery test(n=9)
2.6 配伍试验
模拟临床用药的浓度,吸取盐酸法舒地尔注射液1 mL(30 mg),放置于50 mL容量瓶中,用果糖注射液溶解稀释至刻度,吸取供试液置于(25±2)℃且不避光的条件下放置,于0、1、2、4、6 h观察配伍溶液的外观,并测定pH值,同时取样测定其含量并且观察色谱图有无新的物质峰出现。
2.6.1 外观及pH值变化:采用纳氏比色管来观察配伍溶液在0、1、2、4、6 h的变化,均为无色透明液体且未见气泡生成,配伍液在6 h内无颜色变化,也无混浊及沉淀生成。
2.6.2 含量测定:配伍液在不同时刻取样并按“2.1”项下条件进样测定,同时计算盐酸法舒地尔的含量,以配伍溶液0 h为100%为标准,计算在各相应时间药物相对的含量,药物含量和pH值见表2 。
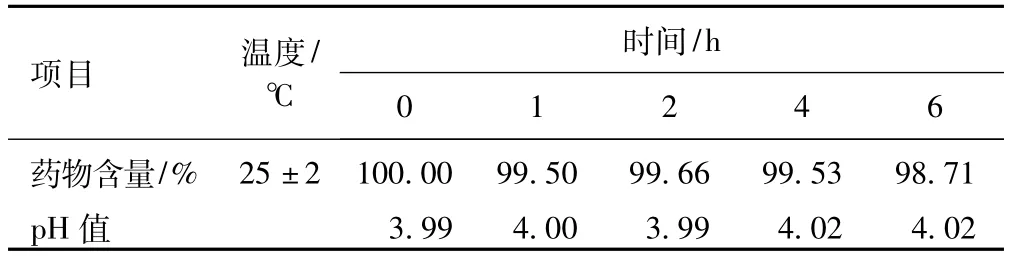
表2 样品及pH值测定结果(n=3)Tab 2Determination results of samples and pH value(n=3)
2.6.3 配伍前后高效液相色谱图比较:配伍前、后盐酸法舒地尔高效液相色谱的图谱峰形及保留时间均未见明显变化,且无其他色谱峰产生。
3 讨论
3.1 测定波长选择
取盐酸法舒地尔注射液适量,用甲醇定量稀释,流动相为空白,于200~400 nm范围进行紫外扫描,结果显示在275 nm波长处有最大吸收,而果糖注射液在此处无明显吸收,故以275 nm作为检测波长。实验证明选择波长为275 nm测定混合液中盐酸法舒地尔的含量的方法是可行的。
3.2 流动相的选择
盐酸法舒地尔溶液在pH值4.0~5.0时比较稳定,但在此范围内随着流动相pH值的降低色谱峰的峰形有所改善,出于对色谱柱使用寿命延长的目的,流动相pH值不应过低,所以选择pH=4.5时流动相最佳。
3.3 配伍稳定性
用高效液相色谱法测定盐酸法舒地尔注射液与果糖注射液配伍后的药物含量,在(25±2)℃及不避光的条件下,6 h内的含量变化不大,其含量均在98%以上,外观及pH值也无显著变化。这一结果提示该试验配伍是可行的,但是为确保临床用药安全,故建议配伍溶液最好在4 h内用完。
本实验仅从理化性质角度对盐酸法舒地尔注射液与果糖注射液配伍稳定性进行初步考察,而其药理及生化方面配伍因素未予考虑,有待进一步研究。
[1]孙华瑜,余国峰.法舒地尔治疗蛛网膜下腔出血并意识障碍36例[J].药物流行病学杂志,2010,19(2):68-69.
[2]郑水莲,俞佳,寿张轩.美洛西林钠在果糖注射液和转化糖注射液中的稳定性考察[J].中国现代应用药学,2008,25(2):160-161.
[3]胡宝荣,李星达,哈力.注射用夫西地酸钠与3种溶剂配伍稳定性研究[J].中国医院用药评价与分析,2011,11(10):917-919.
Compatible Stability of Mixture of Fasudil Hydrochloride Injection with Fructose Injection
XU Mei*,HAN Qiang#(Dept.of Pharmacy,The Affiliated Hospital of Xuzhou Medical College,Jiangsu Xuzhou 221002,China)
OBJECTIVE:To investigate the compatible stability of fasudil hydrochloride with fructose injection at room temperature[(25±2)℃].METHODS:Fasudil hydrochloride at a simulated clinical concentration was added into in fructose injection,after thorough mixing,the appearance of the mixture was observed and its pH value was determined and the content of fasudil hydrochloride was determined by HPLC.Meanwhile,we also observed whether there was formation of new matter.RESULTS:At room temperature[(25±2)℃],no marked change was noted for the mixture of fasudil hydrochloride with fructose injection within 0-6 hours after mixing with regard to its appearance,pH value and the content of fasudil hydrochloride.CONCLUSION:At room temperature[(25±2)℃],the mixture of fasudil hydrochloride injection with fructose injection was stable within 6 hours after mixing.
Fasudil hydrochloride injection;Fructose injection;Compatibility;Stability;HPLC
R969.2
B
1672-2124(2012)09-0814-03
*副主任药师。研究方向:医院药学。E-mail:xumei152@163.com
#通讯作者:副主任药师。研究方向:临床药学、药物配伍稳定性。E-mail:hanqiang1144@163.com
2011-11-17
2012-02-16)
*副主任药师。研究方向:药品检验、六盘山地产药材的质量评价。E-mail:zhangxl2041170@163.com
#通讯作者:副主任药师。研究方向:药品检验、中成药质量标准。E-mail:741252086@qq.com
