一株荧蒽降解菌的筛选及其特性研究*
2012-11-06隋晓斌王丽平王安利
隋晓斌,王丽平,王安利
(1.华南师范大学生命科学学院 广州 510631;2.中国环境科学研究院河口与海岸带创新基地 北京 100012)
一株荧蒽降解菌的筛选及其特性研究*
隋晓斌1,王丽平2,王安利1
(1.华南师范大学生命科学学院 广州 510631;2.中国环境科学研究院河口与海岸带创新基地 北京 100012)
从天津新港潮间带沉积物中筛选出一株能以荧蒽为唯一碳源和能源且生长良好的菌株Y1,并对菌株特性进行了系统研究。实验结果发现菌株Y1为革兰氏阴性菌,适合在低盐度(<1%氯化钠)的环境中生长,最适p H值为6~7,最适的生长温度为25℃~28℃。该菌株对锌、铅、铜、铬和低浓度的镉均有抗性,但对高浓度的镉十分敏感;菌株Y1对常见抗生素卡那霉素、链霉素、氨苄青霉素和利福平具一定抗性,但对四环素较敏感。通过对菌株Y1的16 S r DNA测序和序列比对,并结合其生理生化特性确定其为Sediminibacterium sp.,归属于鞘脂杆菌纲(Sphingobacteria)。Y1在10天内对荧蒽的降解率为14%,且GST酶在Y1降解荧蒽的过程中起着重要的作用。
微生物降解;多环芳烃;潮间带
多环芳烃(poly-aromatic hydrocarbons,PAHs)是一类高分子量有机化合物的统称。这类化合物含有两个或两个以上苯环,极难溶于水,在环境中很难被降解。一些研究表明PAHs具有潜在的毒性,表现在它对生物体具有致癌性、致畸性和致突变性。目前去除环境中的多环芳烃的方法有化学方法、物理方法和生物降解法。物理方法和化学方法虽然处理十分快速,但容易造成二次污染;生物降解方法即经济、安全、残留又少,逐渐得到人们的认可。其中微生物由于生长迅速、变异率高,很容易产生土著的多环芳烃高效降解菌株[1-6]。
近几年来,渤海湾周边地区经济迅速发展的同时,也带来了严重的环境问题,其中一些污染物已经超出了本地环境自身的调节能力,对生态系统健康构成一定的威胁,阻碍了渤海湾经济的健康可持续发展。PAHs是渤海湾潮间带沉积物中的主要污染物之一,且沿岸区含量较高[7],其中含4个苯环的荧蒽是主要的PAHs污染物之一[8]。渤海湾潮间带中高浓度的荧蒽可能会引起本地微生物菌株发生突变而形成可以高效降解荧蒽的菌体。因此,我们从受PAHs污染严重的天津新港区潮间带采集表层沉积物以多环芳烃荧蒽为唯一能源和碳源,筛选优势降解菌株,并对其生理生化特性、生长特征和降解效能等进行了系统研究,以期为以后的生物原位修复提供技术支持。
1 材料与方法
1.1 菌种来源和培养基
1.1.1 样品来源
从天津新港区潮间带采集表层沉积物,放于经紫外消毒过的自封袋中,4℃保存待用。
1.1.2 培养基
营养培养基(g/L):葡萄糖10,牛肉膏3,蛋白胨5。
无机盐培养基(g/L):硝酸铵1.0;磷酸氢二钾0.5;磷酸二氢钾0.5;七水硫酸镁0.5;氯化钠1.0;氯化钙0.1;三氯化铁0.02;酵母膏0.05;p H值7.0~7.2。固体培养基中加入2%琼脂。用丙酮配置20 mg/m L荧蒽母液,0.22μm滤膜除菌,加入灭菌无机盐培养基中作为唯一碳源。
1.2 荧蒽降解菌的筛选、纯化
称取5 g沉积物样品,放入盛有100 m L荧蒽无机盐液体培养基的250 m L三角瓶中,放到摇床上30℃、150 r/min避光富集培养,5天后直接转移10 m L培养液至另一新的含荧蒽无机盐培养基中,之后采用逐步提高荧蒽浓度的方法(最终为100 mg/L),转移5次后获得富集培养物。
将富集培养物经系列稀释后,在含荧蒽的固体培养基上反复划线分离,于恒温培养箱中28℃避光倒置培养,直至平板上出现单个菌落,挑选生长最好的优势菌落(命名为Y1)进行进一步的研究。
1.3 形态观察
1.3.1 显微镜观察
采用光学显微镜(Olympus)进行革兰氏染色,观察菌体形态。
1.3.2 扫描电镜观察
在无菌条件下挑取适量菌体立刻用以p H值7.4磷酸缓冲液配制的2.5%戊二醛固定,1%锇酸后固定,然后经过乙醇系列脱水、常规临界点干燥、样品粘贴和真空镀膜后,在扫面电镜下观察。
1.4 菌株生理生化指标的测定
对菌株进行系列生理生化特性试验,主要包括甲基红(M.R.)试验、乙酰甲基醇(V.P.)试验、淀粉水解试验、过氧化氢酶试验、柠檬酸盐试验、明胶液化试验、硫化氢试验以及吲哚试验等,每组两个平行。
1.5 环境条件对菌株生长的影响
1.5.1 温度对菌株生长的影响
将所筛选菌株活化24 h后,接种于营养培养液中,分别在4℃、20℃、28℃、30℃、37℃和45℃的温度下培养24 h,用722分光光度计测定波长600 nm时的光密度值(OD600),每组两个平行。
1.5.2 p H值对菌株生长的影响
用1 mol/L的氢氧化钠和1 mol/L的盐酸将营养培养基的p H值分别调至4、5、6、7、8和10。将待测菌株活化24 h后接入上述培养液中,28℃培养24 h,用722分光光度计测定不同p H值条件下菌悬液的OD600值,每组两个平行。
1.5.3 盐度对菌株生长的影响
将菌株活化24 h后,分别接种于含0、1%、2%、3%、5%、8%和10%氯化钠(NaCl)的营养培养基中,28℃下培养24 h,用722分光光度计测定盐度下菌悬液的OD600值,每组两个平行。
1.6 对抗生素和重金属的抗性实验
取0.1 m L制备好的菌悬液接种于固体培养基中,用无菌玻璃刮涂抹均匀,将灭菌滤纸浸入供试试剂中,用无菌镊子夹取浸药滤纸片(提前将滤纸沥干),分别平铺于含菌体平板上,并做好记号,28℃下培养72 h后,观察滤纸片周围有无抑菌圈产生,每组两个平行。
选择5种常用抗生素进行敏感试验,其浓度为:卡那霉素,10 mg/L、20 mg/L、50 mg/L;氨苄青霉素,100 mg/L、200 mg/L和400 mg/L;链霉素,10 mg/L、20 mg/L和50 mg/L;四环素,10 mg/L、20 mg/L和50 mg/L;利福平,10 mg/L、60 mg/L和100 mg/L。
金属离子及其浓度如下:镉(Cr6+),10 mg/L、20 mg/L和50 mg/L;锌(Zn2+),100 mg/L、200 mg/L和400 mg/L;铅(Pb2+),100 mg/L、200 mg/L和400 mg/L;铜(Cu2+),10 mg/L、20 mg/L和50 mg/L;铬(Cd2+),20 mg/L、50 mg/L和100 mg/L。
1.7 菌株DNA的提取和PCR扩增
挑取适量菌株于100μL无菌去离子水中,采用水煮法快速提取细菌基因组DNA,离心取上清液作为PCR扩增的待用模版,用于16 S r DNA基因的扩增。所用引物为27 F(5’-AGA GTT TGA TCC TGG CTC AG-3’)和1 492 r(5’-GGC TACCTTGTTACGACTT-3’),反应条件为94℃预变性5 min,94℃变性30 s,56℃退火30 s,72℃延伸1 min 30 s,30个循环,最后72℃延伸10 min。琼脂糖电泳检测,将纯的样品送至上海英俊公司回收并测序。将16 S r DNA的测序结果输入基因库(GenBank)中进行序列比对。
1.8 降解效能的测定
将菌株在液体营养培养基中活化24 h后,取0.6 m L菌液至装有12 m L无机盐液体培养基的三角瓶中,然后加入12μL荧蒽母液,采用液相色谱(HPLC)测定培养瓶中荧蒽初始浓度。然后将3个平行样品放在150 r/min、28℃振荡培养箱中培养。10天后,采用液相色谱(HPLC)测定培养液中荧蒽浓度的变化。
1.9 菌株蛋白质含量和GST酶活性的测定
菌株蛋白质采用考马斯亮兰法测定;GST酶活性采用GST酶试剂盒测定(南京建成生物工程研究所),该试剂盒是通过检测GSH浓度的高低来反应GST活力的大小,GSH(底物)浓度越低则GST活力越大。
2 结果
2.1 菌株的形态特征和生理生化指标
菌株Y1为革兰氏阴性菌,在固体营养培养基上菌株淡黄色、圆形、不透明和边缘规则;在以荧蒽为唯一碳源的固体无机盐培养基上菌株呈白色、半透明和边缘规则。在扫描电镜下菌体细胞为杆状(图1),其部分生理生化特征见表1。

图1 菌株Y1个体形态的扫描电镜观察

表1 菌株Y1的部分生理生化特征
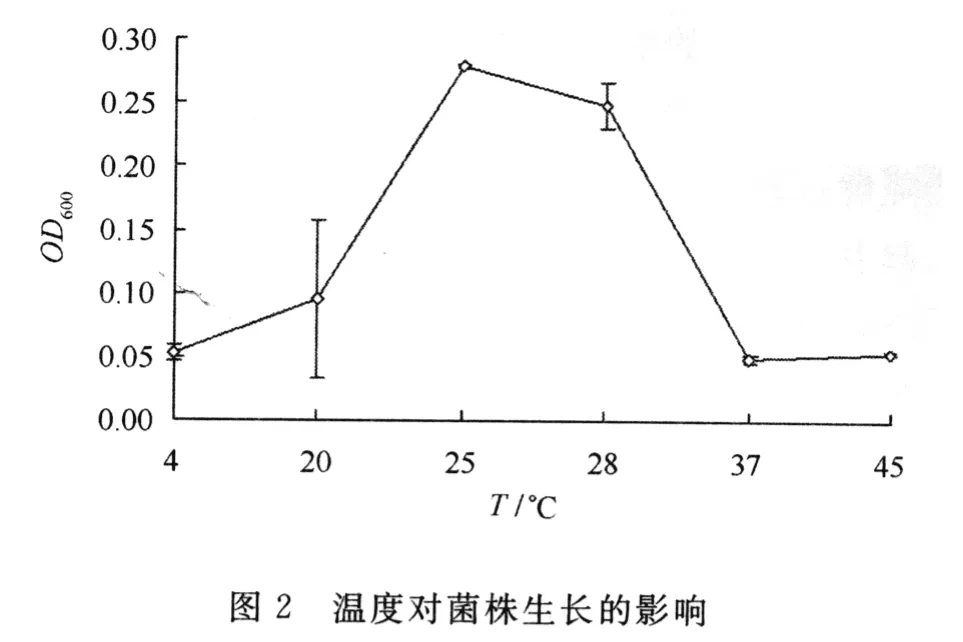
2.2 环境条件对菌株生长的影响
(1)温度对菌株生长的影响。由图2可知,菌株Y1在不大于20℃和不小于37℃条件下生长较差,而在25℃~28℃范围内生长最好。
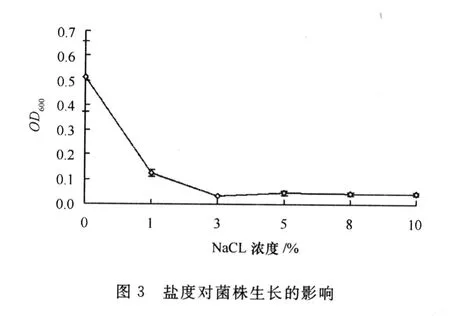
(2)盐度对菌株生长的影响。由图3可见,随着盐度的增加,菌株Y1生长状况逐渐变差,在NaCl浓度为1%时,生长较差;当NaCl浓度达到3%时细菌几乎不能生长。因此菌株Y1在小于1%NaCl的低盐度环境下生长较好。
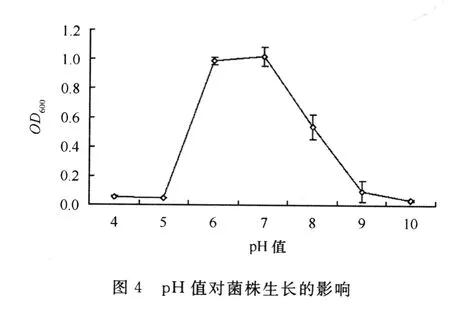
(3)p H值对菌株生长的影响。图4表明,菌株Y1在p H值小于5和p H值大于9的条件下几乎不能生长,而在p H值6~8范围内生长良好,其中在p H值6~7之间生长最好。
2.3 菌株对抗生素和重金属的抗性
2.3.1 抗生素试验
菌株Y1对5种常见抗生素的敏感试验结果发现:在卡那霉素(10 mg/L、20 mg/L、50 mg/L)、链霉素(10 mg/L、20 mg/L、50 mg/L)、氨苄青霉素(100 mg/L、200 mg/L、400 mg/L)和利福平(10 mg/L、60 mg/L、100 mg/L)4种抗生素的各个浓度都没有出现抑菌圈,说明该菌株对这4种抗生素具一定抗性;四环素(10 mg/L、20 mg/L、50 mg/L)各个浓度都出现了抑菌圈,说明菌株对这种抗生素比较敏感。
2.3.2 重金属试验
菌株Y1对5重金属离子抗性实验结果说明:Zn2+(100 mg/L、200 mg/L、400 mg/L)、Cu2+(10 mg/L、20 mg/L、50 mg/L)、Cd2+(10 mg/L、20 mg/L、50 mg/L)和Pb2+(100 mg/L、200 mg/L、400 mg/L)4种金属测定的浓度中都没有抑菌圈出现,说明该菌株对这4种离子有耐受性;在Cr6+试验中,浓度为10 mg/L时没有抑菌圈出现,但在浓度升至20 mg/L和50 mg/L的试验时出现了抑菌圈,说明菌株Y1对低浓度的Cr6+有抗性,但对高浓度的Cr6+很敏感。
2.4 16SrDNA基因的扩增和序列分析
利用细菌16 S r DNA引物27 f和1 492 r进行扩增,获得1 500 bp左右大小的PCR产物,符合预期产物长度,纯化产物并且测定产物的序列,将测序结果输入GenBank中进行BLAST比对,发现该菌株与Sediminibacterium sp.的同源性为95%。
2.5 菌株对荧蒽的降解率试验
试验结果如表2所示,3个平行样品经过10天培养后荧蒽浓度分别降低了16%、14%和18%。
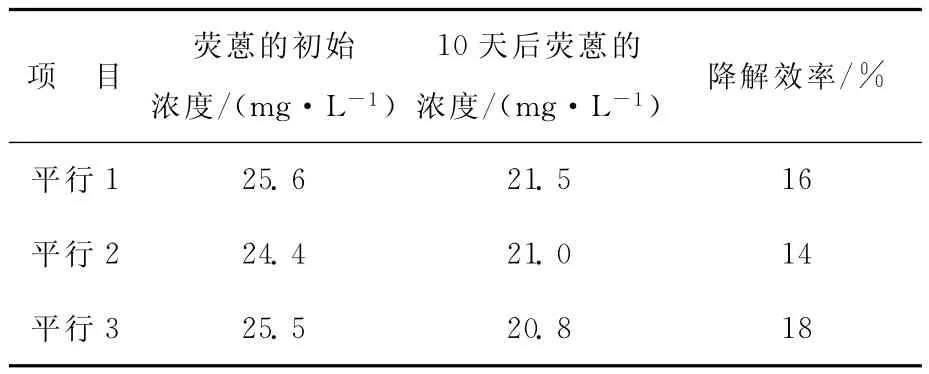
表2 菌株Y1对荧蒽的降解效能
2.6 荧蒽对菌株Y1蛋白质含量和GST酶活性的影响
取活化24 h后的菌液分别接种到营养液体培养基和以荧蒽为唯一碳源的无机培养基中,培养3 d后,取适量菌液,超声波破碎后进行菌体蛋白质含量和GST酶活性的测定,结果如表3所示。由表3可见,经荧蒽诱导培养后,其菌体蛋白质含量和GST酶活性都明显提高。

表3 荧蒽降解菌液蛋白质含量和GST酶活性测定结果
3 讨论与结论
从受污环境中分离、筛选出高效降解菌株,是生物修复受污环境的第一步,也是关键的一步[9],了解其生物学特性是利用降解性微生物进行原位修复的必要理论基础。笔者从天津新港区渤海湾潮间带筛选出一株具有降解多环芳烃荧蒽能力的土著优势菌株,并对其生长和降解特性进行了研究。环境条件对菌株生长的影响为摸索菌株的培养条件及其在环境中的适应性提供实践依据。笔者所筛选菌株Y1,在小于1%NaCl、25℃~28℃和p H值6~8生长最好,同时对常见抗生素和重金属都具一定抗性,10天内对荧蒽的降解率在14%~18%。天津新港高潮带盐度较低,p H值一般在7~8之间,因此初步认为本次所筛选荧蒽降解菌株Y1较适合在春末夏初和秋季(25℃~28℃)用于天津新港潮间带多环芳烃污染的微生物原位修复,但其在自然环境中的生长状况和降解效能仍待于进一步研究。
rRNA广泛存在于真核和原核生物中,功能稳定,由高度保守区和可变区组成。将待测菌株提取其遗传物质,经测序、BLAST比对,并结合其生理生化特征,对菌株加以鉴定是目前应用最为普遍的鉴定方法。笔者在对所筛选菌株进行一系列生理生化试验基础上,采用16 S r RNA同源性序列分析方法鉴定所筛选菌株的种类。16 S r RNA大小为1 500 bp左右,所代表的信息量能反映生物界的进化关系。笔者采用27 f和1 492 r引物对扩增所提取菌株总DNA,经过克隆测序,将序列正确拼接后获得1 620 bp的遗传序列,经BLAST比对后菌株被鉴定为Sediminibacterium sp.,归属于鞘脂杆菌纲(Sphingobacteria)。为进一步确定菌株Y1对荧蒽的降解能力,我们测定了10天内该菌株对荧蒽的降解效能。采用高效液相色谱(HPLC)测定荧蒽浓度的变化,结果证实菌株Y1对荧蒽有较高的降解能力。另外,研究表明:在PAHs降解过程中,谷胱甘肽转移酶(GST)在其中起着重要的作用,曾有人将GST酶作为PAH降解菌存在的分子探针[10-11]。笔者对菌株Y1的蛋白含量和GST酶活性进行了检测,结果发现在培养基中加入荧蒽后,菌体的蛋白含量和GST酶活性明显提高,表明菌体产生了大量与降解多环芳烃相关的蛋白和酶类。
[1] 毛键,骆永明,腾应,等.一株高分子量多环芳烃降解菌的筛选、鉴定及降解特性研究[J].微生物通报,2008,35(7):1011-1015.
[2] 周宏伟,吴锦雅.不同富集方法分离多环芳烃降解菌的比较研究[J].现代生物学进展,7(9):1308-1312.
[3] 韩清鹏,方昉,秦利峰,等.多环芳烃降解菌的获得及应用[J].应用与环境生物学报,2003,9(6):639-641.
[4] 王春明,李大平,刘世贵.4株多环芳烃降解菌的分离鉴定[J].应用与环境生物学报,2007,13(4):546-550.
[5] 温洪宇,廖银章,李旭东.微生物降解多环芳烃的研究进展[J].微生物学杂志,2005,25(6):73-75.
[6] 房妮,俱国鹏.多环芳烃污染土壤的微生物修复研究进展[J].安徽农业科学,2006,34(7):1425-1426.
[7] 张蓬.渤黄海沉积物中的多环芳烃和多氯联苯及其与生态环境的耦合解析[D].青岛:中科院海洋研究所,2009.
[8] 聂利红,刘宪斌,降升平,等.天津高沙岭潮间带表层沉积物中多环芳烃的分布及风险评价[J].矿物岩石,2008,28(2):113-117.
[9] 周启星.污染土壤修复的技术再造与展望[J].环境污染治理技术与设备,2002(3):36-40.
[10]LLOYD-JONES G,LAU P C.Glutathione S-transferase-encoding gene as a potential probe for environmental bacteria isolates capable of degrading polycyclic aromatic hydrocarbons[J].Appl Environ Microbiol,1997,63(8):3286-3290.
[11]LLOYD-JONES G,LAURIE A D,HUNTER D W F et al.Analysis catabolic genes for phenanthrene and naphthalene degradation in contaminate New Zealand soils[J].FEMS Microbiol Ecol,1999,29:69-79.
国家基础研究发展规划项目(“973”项目)(2007CB407306).
