2 型糖尿病患者CD14 + CD16 + 单核细胞的水平及其对LPS 和IL-15 刺激的反应*
2012-12-23杨孟雪汤为学
杨孟雪, 甘 华△, 沈 清, 汤为学
(1 重庆医科大学附属第一医院肾内科,2 重庆市神经病学重点实验室,重庆400016)
越来越多的研究表明,糖尿病患者体内存在细胞因子介导的慢性低度炎症反应状态。非特异性免疫系统激活参与2 型糖尿病(type 2 diabetic mellitus,T2DM)及其并发症的发生、发展其作用途径包括遗传变异、单核/巨噬细胞的促炎作用、慢性感染、Toll样受体(Toll-like receptor,TLR)途径、巨噬细胞迁移抑制因子(macrophage migration inhibitory factor,MIF)水平增高等。CD14+CD16+单核细胞被认为是促炎性单核细胞亚群[1-2]。T2DM 慢性低度炎症时CD14+CD16+表达情况如何,少有报道。本研究的目的是探讨T2DM 患者体内CD14+CD16+单核细胞的比例及其对脂多糖(lipopolysaccharide,LPS)和白细胞介素15(interleukin-15,IL-15)刺激的反应,以了解炎症性免疫反应在T2DM 中的可能作用机制。
材 料 和 方 法
1 研究对象
收集2009 年5 月~2011 年5 月正常对照组20例,男性10 例,女性10 例,平均年龄(49 ±6)岁,均为健康志愿者,经检查体格健康,并排除糖尿病、高血压、冠心病及肾病等内分泌代谢性疾病病史,均无糖尿病家族史。同时收集2009 年5 月~2011 年5月重庆医科大学肾内科及内分泌科T2DM 患者28例,男性15 例,女性13 例,平均年龄(52 ±8)岁,病程(4.4 ±1.9)年。糖尿病诊断均符合1999 年世界卫生组织(WHO)糖尿病诊断和分型标准。且符合以上标准的2 型糖尿病患者谷氨酸脱羧酶抗体(glutamic acid decarboxylase antibody,GADA)水平<1.0,25-羟维生素D3[25(OH)D3]水平= 21 ~29 μg/L,空腹血糖低于7.0 mmoL/L,糖化血红蛋白(hemoglobin A1c,HbA1c)低于6.5%纳入。排除标准:(1)1型及继发性糖尿病;(2)急性感染性疾病;(3)心、肝功能不良;(4)近3 个月发生过糖尿病急性并发症及感染;(5)妊娠、哺乳;(6)其它肾病、结缔组织病和自身免疫性疾病;(7)肿瘤、心脑血管意外、哮喘、使用对研究有影响的药物等。所有入选者(表1)为中国汉族彼此间无亲缘关系的人群。本研究获得患者本人同意及重庆医科大学伦理委员会批准。
表1 2 组入选者的基线特征Table 1. Subject characteristics at baseline(±s)
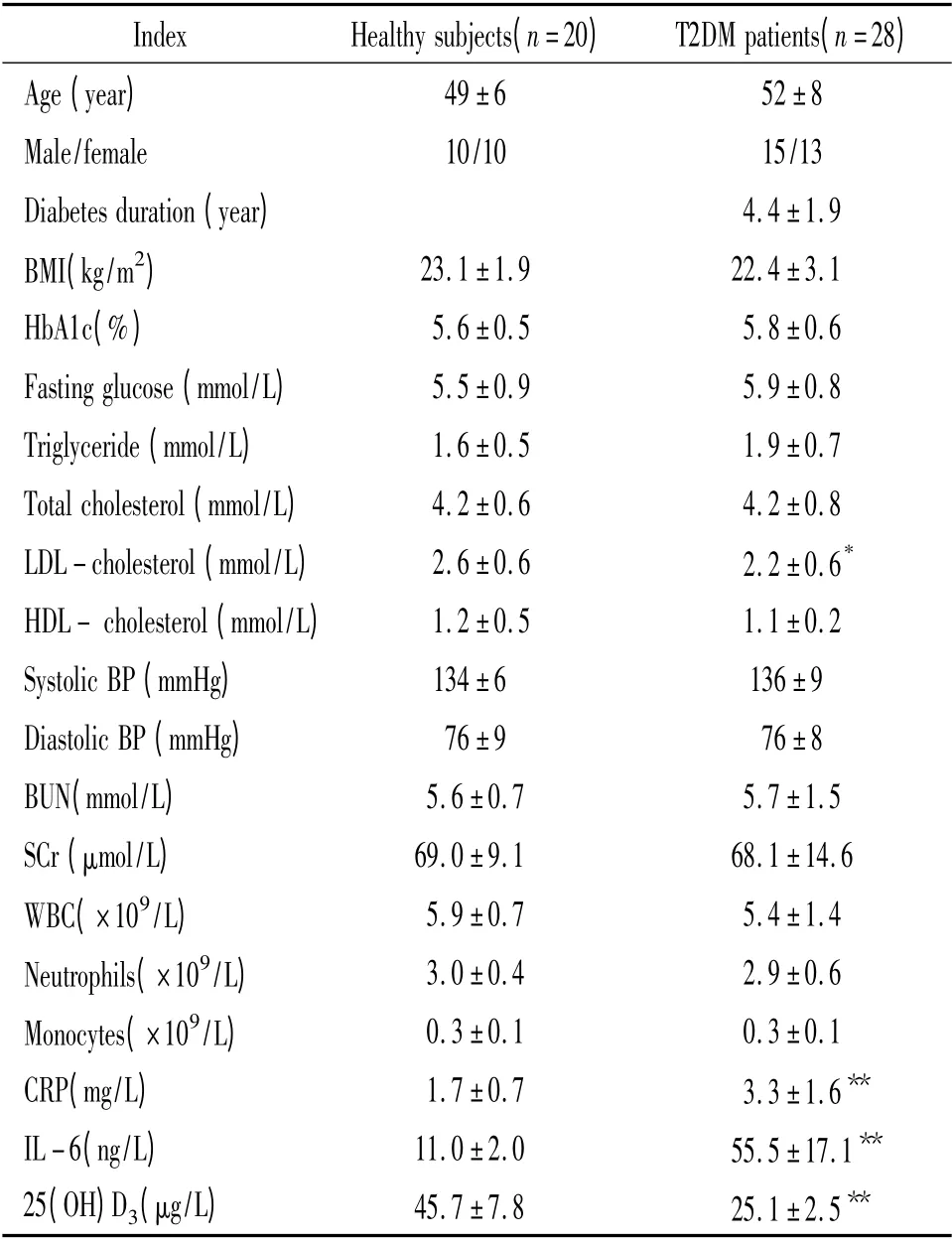
表1 2 组入选者的基线特征Table 1. Subject characteristics at baseline(±s)
BMI:body mass index;HBA1c:hemoglobin A1c;LDL:low- density lipoprotein;HDL:high-density lipoprotein;BP:blood pressure;BUN:blood urea nitrogen;SCr:serum creatinine;WBC:white blood cell;CRP:C-reactive protein;IL-6:interleukin-6;25(OH)D3:25-hydroxyvitamin D3. * P <0.05,**P <0.01 vs healthy subjects.
Index Healthy subjects(n=20) T2DM patients(n=28)49±6 52±8 Male/female 10/10 15/13 Diabetes duration(year) 4.4±1.9 BMI(kg/m2) 23.1±1.9 22.4±3.1 HbA1c(%) 5.6±0.5 5.8±0.6 Fasting glucose(mmol/L) 5.5±0.9 5.9±0.8 Triglyceride(mmol/L) 1.6±0.5 1.9±0.7 Total cholesterol(mmol/L) 4.2±0.6 4.2±0.8 LDL-cholesterol(mmol/L) 2.6±0.6 2.2±0.6*HDL- cholesterol(mmol/L) 1.2±0.5 1.1±0.2 Systolic BP(mmHg) 134±6 136±9 Diastolic BP(mmHg) 76±9 76±8 BUN(mmol/L) 5.6±0.7 5.7±1.5 SCr(μmol/L) 69.0±9.1 68.1±14.6 WBC(×109/L) 5.9±0.7 5.4±1.4 Neutrophils(×109/L) 3.0±0.4 2.9±0.6 Monocytes(×109/L) 0.3±0.1 0.3±0.1 CRP(mg/L) 1.7±0.7 3.3±1.6**IL-6(ng/L) 11.0±2.0 55.5±17.1**25(OH)D3(μg/L) 45.7±7.8 25.1±2.5 Age(year)**
2 主要试剂
RPMI-1640 培养基、胎牛血清均购自Gibco,人淋巴细胞分离液1.077 及LPS 均购自Sigma,重组人IL-15 购自PeproTech。藻红蛋白(phycoerythrin,PE)标记的抗人分化群(cluster of differentiation,CD)14 和异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的抗人TLR4 抗体均购自AbD Serotec,鼠单克隆信号转导和转录激活子5(signal transducer and activator of transcription 5,STAT5)和磷酸化STAT5(phosphorylated STAT5,p-STAT5)抗体均购自Santa Cruz。羊抗小鼠β-actin 抗体购自北京四正柏公司。山羊抗小鼠和兔抗山羊Ⅱ抗均购自北京中杉金桥公司,IL-6 和单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)的ELISA 检测试剂盒由Biosource 提供。25 (OH)D3的ELISA 检测试剂盒由R&D 提供。GADA 测定:采用BioMerica试剂盒,用酶联免疫法测定。HbA1c 测定:采用化学发光法,应用Diastar 糖化血红蛋白分析仪检测。血常规应用XE-2100 全自动分析仪检测。空腹血糖、血脂、肾功能及高敏C 反应蛋白(high-sensitive C-reative protein,hsCRP)的测定:空腹抽取静脉血,采用奥林巴斯全自动生化分析仪检测。
3 主要方法
3.1 血标本的采集及外周血单个核细胞(peripheral blood mononuclear cells,PBMC)的分离和培养 采集研究对象晨起空腹静脉血,低温离心,取血清,置-80 ℃冰箱保存待用。剩余静脉血置于肝素抗凝的试管中,用于流式检测及PBMCs 的分离。Ficoll 淋巴细胞分离液密度梯度离心分离出外周血PBMCs,加入完全RPMl-1640 培养基(含10%的热失活胎牛血清,青霉素及链霉素各1 ×106U/L)制成细胞悬液,混匀后进行细胞计数及台盼蓝鉴定细胞活力(至少>95%)。调整细胞浓度为2 ×108/L 接种至24孔板然后置于37 ℃、5%CO2孵箱中培养,用于后续实验。
3.2 实验分组 分离外周血单个核细胞接种培养于24 孔板中,RPMl-l640 培养基(含10%的热失活胎牛血清、青霉素及链霉素各1 ×106U/L)培养24 h后每组均加入1 mg/L LPS 和100 μg/L 重组人IL-15 干预4 h(每个样本做2 个复孔):(1)健康对照组(n=20);(2)T2DM 组(n =28)。LPS 联合IL-15干预4 h 后收集PBMC 和培养液。LPS 和IL-15 的浓度选择参照预实验和文献[3-4]。
3.3 流式检测CD14+CD16+单核细胞平均荧光强度值(mean fluorescence intensity,MFI) 取EDTA 抗凝的外周全血150 μL 加入流式管底,预留1 管作为空白对照管,不加荧光抗体,其余各管分别加入相应的抗体(CD14-PE 和CD16-FITC 各10 μL),振荡混匀后避光,室温孵育;在上述液体内分别加入红细胞裂解液;然后洗涤细胞;每管内加入多聚甲醛固定;流式细胞仪上检测CD14+CD16+的MFI。同时使用同型对照使其能够有效确保抗体的特异性。
3.4 Western blotting 检测STAT5 和p-STAT5 蛋白表达 冰上裂解细胞,BCA 法测定蛋白浓度。总蛋白上样于12%SDS-PAGE 电泳分离,电转移至PVDF 膜上,以含5%脱脂奶粉的TBST 封闭后,分别加入小鼠抗人STAT5 抗体和小鼠抗人p-STAT5 抗体及羊抗小鼠β-actin 抗体,4 ℃过夜,洗膜,分别加入辣根过氧化物酶标记的山羊抗小鼠和兔抗山羊IgG 孵育,扫描仪成像,自动成像系统分析。
3.5 荧光显微镜下观察单个核细胞p-STAT5 蛋白表达 干预前和干预结束后,PBS 清洗细胞,4%多聚甲醛固定,牛血清封闭,0.3%Triton X-100 透膜处理5 min,1∶200Ⅰ抗(小鼠抗人p-STAT5 抗体)4 ℃孵育过夜,1∶50 荧光Ⅱ抗(FITC 标记的山羊抗小鼠IgG)孵育1 h,DAPI 孵育10 min,荧光显微镜摄像。
3.6 细胞因子检测 ELISA 法检测外周血和上清液IL-6 及MCP-1 的浓度,按照ELISA 试剂盒操作说明操作,IL-6 和MCP-1 含量计算结果以ng/L表示。试剂的批内分析和批间分析变异系数均<10%,所有样本设3 个复孔。
4 统计学处理
用SPSS 16.0 统计软件进行分析。数据用均数±标准差(± s)表示,两个连续变量的关系作Spearman's 相关分析,两组间比较采用t 检验,以P <0.05 为差异有统计学意义。
结 果
1 病人的基线特征
2 组间年龄、性别、体重指数、HbA1c、空腹血糖、血压、肾功能、甘油三酯、总胆固醇、高密度脂蛋白、外周血白细胞和单核细胞绝对计数无显著差异(P >0.05);T2DM 患者外周血低密度脂蛋白、25(OH)D3、IL-6 及hsCRP 水平高于正常对照人群(P <0.01),见表1。
2 CD14+CD16+单核细胞的平均荧光强度
如图1 所示,T2DM 组的CD14+CD16+单核细胞的平均荧光强度值显著高于正常对照组(T2DM组6.9 ±2.3;正常对照组4.6 ±1.5),P <0.01。
3 LPS 和IL-15 干预后STAT5 和p-STAT5 蛋白的表达
LPS 和IL-15 干预4 h,T2DM 组PBMC p-STAT5 蛋白水平表达上调,与正常对照组比较,差异显著(T2DM 组0.37 ±0.08,正常对照组0.12 ±0.04,P <0.05)。但STAT5 总蛋白表达2 组比较没有明显差异(P >0.05),见图2。
4 LPS 和IL-15 干预前后PBMC 中p-STAT5蛋白表达的变化
LPS 和IL-15 干预前T2DM 患者PBMC 核内不表达p-STAT5,经过LPS 联合IL-15 干预后T2DM患者细胞核内有p-STAT5 的表达,提示p-STAT5处于激活状态,但健康对照组LPS 与IL-15 干预前后细胞核内均无p-STAT5 表达,见图3。

Figure 1. MFI of CD14 +CD16 + expression in monocytes from the two groups. A:healthy subjects;B:type 2 diabetes (T2DM)patients.a:identification of monocytes displayed in a representative FSC/SSC dot plot;b:flow cytometry analysis of isotypematched control antibody;c:a representative flow cytometry chart of CD16 expression by CD14-positive monocytes. MFI of CD14 +CD16 + =c/b.图1 2 组CD14 +CD16 +单核细胞MFI 的表达
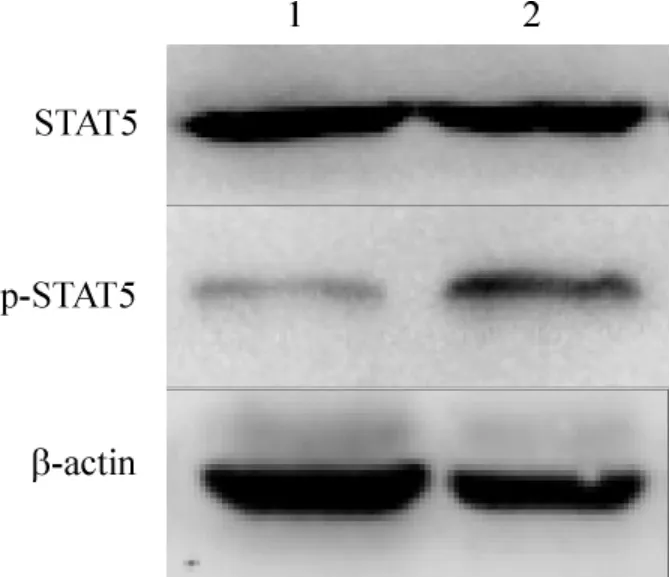
Figure 2. The expression of STAT5 and p-STAT5 protein in LPS- and IL-15-treated PBMC. 1:healthy subjects;2:T2DM patients.图2 LPS 和IL-15 干预后PBMC STAT5 和p-STAT5 的表达
5 LPS 和IL-15 干预后PBMC 培养上清液中IL-6 和MCP-1 水平
LPS 和IL-15 干预后,T2DM 组PBMC IL-6 和MCP-1 水平均明显高于正常对照组(P <0.01),见表2。
6 相关分析
T2DM 组外周血CD14+CD16+单核细胞数量明显高于正常对照组(P <0.01),并与血清CRP 和IL-6水平呈正相关(r=0.394,P <0.05 和r=0.741,P <0.01),与25(OH)D3浓度呈负相关(r =-0. 409,P <0.01),且25(OH)D3水平与CRP 和IL-6 水平呈负相关(r=-0.479 和r=-0.774,均P <0.01)。
表2 LPS 和IL-15 干预后PBMC 培养上清中IL-6 和MCP-1 水平Table 2. The cell supernatant IL-6 and MCP-1 levels in LPS-and IL-15-treated PBMC from the two groups(ng/L. ±s)

表2 LPS 和IL-15 干预后PBMC 培养上清中IL-6 和MCP-1 水平Table 2. The cell supernatant IL-6 and MCP-1 levels in LPS-and IL-15-treated PBMC from the two groups(ng/L. ±s)
* P <0.05 vs healthy subjects.
Group n IL-6 MCP-1 Healthy subjects 20 20.3 ±8.5 18.9 ±8.2 T2DM pratients 28 49.6 ±13.5* 29.1 ±10.4*
讨 论
最近的一些相关研究[5-7]表明单核/巨噬细胞、炎症可能与T2DM 及其并发症的发生发展存在密切关系。在过去几年,多项研究[8-10]已经显示T2DM、炎症与维生素D 缺乏症间存在联系。维生素D 与糖尿病之间的相关性研究是一个新的研究领域。自从在胰岛B 细胞和免疫细胞中发现维生素D 受体后,越来越多的证据表明维生素D 缺乏的个体更易患糖尿病。流行病学研究显示,生命早期的维生素D 缺乏与将来1 型糖尿病的发病存在联系,而补充维生素D 可以预防1 型糖尿病,改善2 型糖尿病的血糖控制。
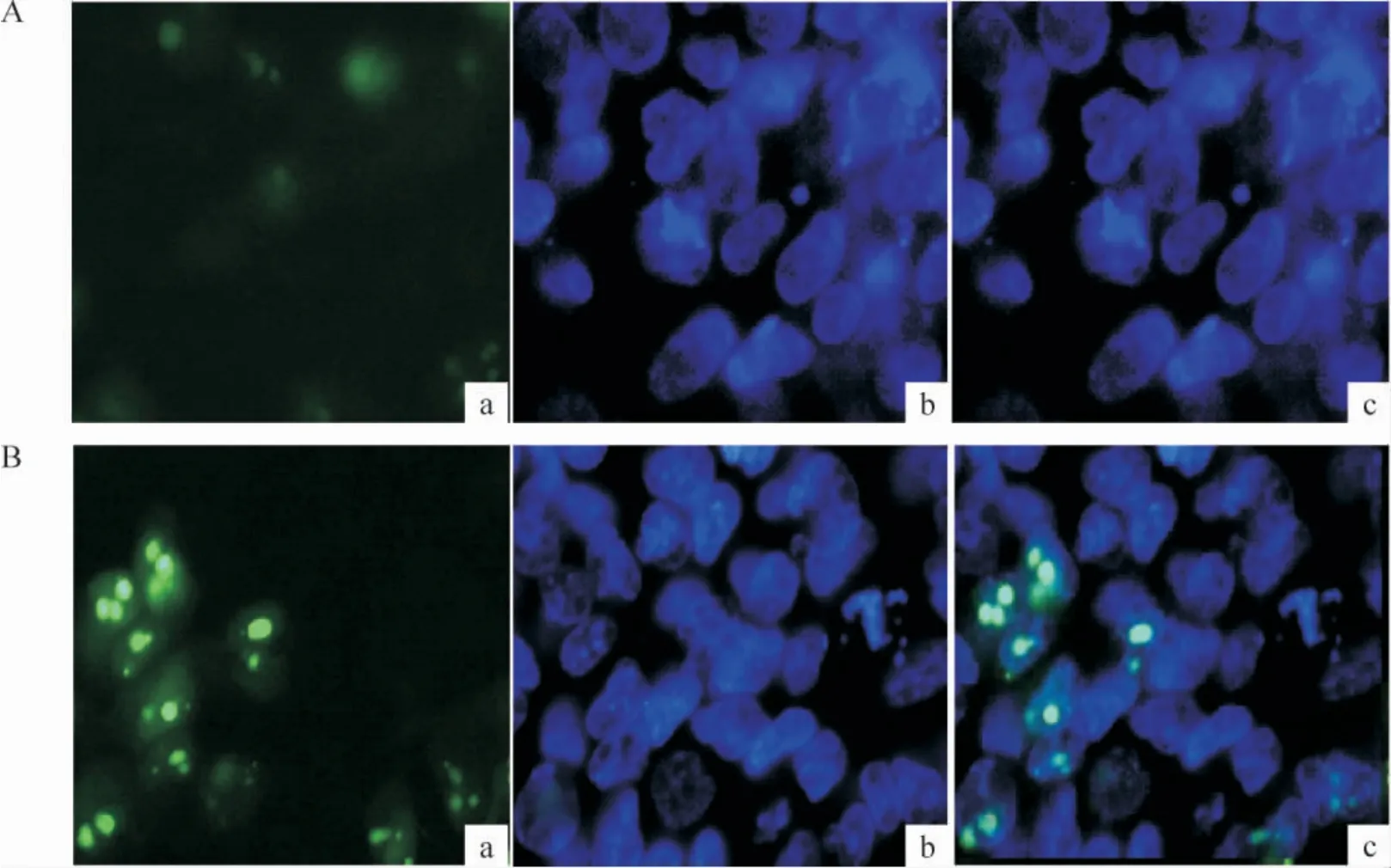
Figure 3. Expression of p-STAT5 in LPS-and IL-15-treated PBMC.A:p-STAT5 expression in PBMC from T2DM group before LPS and IL-15 treatment;B:p-STAT5 expression in PBMC from T2DM group after LPS and IL-15 treatment.a:FITClabeled p-STAT5 ;b:DAPI-labeled nucelus;c:merged.图3 LPS+IL-15 对p-STAT5 在PBMC 中表达的影响
对T2DM 动物模型ob/ob 大鼠的研究证实,维生素D 缺乏时胰岛素的分泌被抑制,补充维生素D 以后,胰岛素水平增加,血糖水平下降[11]。另有研究显示,1,25-(OH)2D3可以显著下调T2DM 患者单核细胞中TNF-α、IL-6、IL-l 和IL-8 的表达,从而证明1,25-(OH)2D3可以调节T2DM 患者单核细胞的炎性反应状态[12]。
DM 的相关体外研究发现,来自1 型DM(T1DM)和T2DM 的单核细胞具有促炎特性,表达炎症因子的能力增强[13-14]。本研究结果显示,与正常对照组相比,T2DM 组外周血CD14+CD16+单核细胞荧光强度值与CRP 和IL-6 水平呈正相关,与25(OH)D3浓度呈负相关,且25(OH)D3水平与CRP和IL-6 水平均呈负相关。IL-15 和LPS 刺激后,检测T2DM 患者PBMC 培养上清IL-6 和MCP-1水平,均高于正常对照组,CD14+CD16+单核细胞被认为是促炎性单核细胞亚群,这表明CD14+CD16+单核细胞的异常表达可能与T2DM 的微炎症状态相关,这一微炎症状态可能与患者体内维生素D 不足有关。
IL-15 是1994 年由Grabstein 发现的可溶性细胞因子,它分布较广泛,尤其在单核/巨噬细胞系统表达最多。IL-15 在很小剂量(10 μg/L)即能诱导中性粒细胞的形态发生改变,呈典型的活化细胞形态,从而证明IL-15 能够启动细胞骨架的重排[15-16]。Alleva 等[17]的研究表明,IL-15 作为一种单核因子通过自分泌的方式作用于单核巨噬细胞,而且单核巨噬细胞对IL-15 的剂量变化非常敏感。高浓度的IL-15(10 ~1 000 μg/L)能增加LPS 活化的单核巨噬细胞产生促炎(proinflammatory)因子(如IL-1、IL-6 和TNF-α),而低浓度的IL-15(<1.0 μg/L)能选择性地抑制促炎因子的产生。
STAT5 是胞浆中潜在的转录因子。在无刺激情况下,细胞内无p-STAT5 表达;在细胞因子、生长因子等外界信号分子的刺激下,STAT5 发生磷酸化和二聚化进入细胞核,结合在基因特定的启动子上调控转录。IL-6、IL-15 等细胞因子与细胞表面的相应受体结合后,可立即激活胞质内与受体偶联的Janus 激酶(Janus kinase,JAK),继而迅速引起STAT5的酪氨酸磷酸化,启动下游的一系列效应[18]。
本研究以IL-15 和LPS 为外界信号分子刺激单核细胞,发现经过LPS 和IL-15 干预4 h,与正常对照组相比,T2DM 组单核细胞p-STAT5 蛋白表达上调,且IL-6 和MCP-1 水平均明显高于正常对照组。本研究还发现T2DM 患者单核细胞STAT5 分子在IL-15 和LPS 刺激前无胞核分布,刺激后发生磷酸化聚集于胞核中,可能是由于构象的改变暴露了核定位序列形成同源或异源二聚体,而促进磷酸化的STAT5 入核,从而参与单核细胞趋化因子和炎症因子等的合成和分泌的调节。而正常对照人群LPS和IL-15 干预前后改变差异不明显。本研究得出的结果与Hormann 等[19]的类似。
本研究显示IL-15 和LPS 可能是PBMC 释放炎症因子和趋化因子的重要刺激因素,IL-15 和LPS 通过增加PBMC 内IL-6 和MCP-1 的生成,激活p-STAT5 信号通路从而参与并放大了动脉粥样硬化炎症免疫反应,这可能是糖尿病患者易患冠心病、糖尿病肾病等动脉粥样硬化性疾病的重要原因之一。
以上结果提示在T2DM 患者体内可能存在单核细胞功能紊乱,这种功能紊乱可能与活性维生素D3不足有关,二者可能参与了T2DM 患者体内免疫炎症反应并与微炎症互为因果,从而导致了T2DM 及其并发症的发生发展。其作用机制可能与STAT5 信号通路的激活有关。因此,后续工作我们将针对性地对以上途径进行研究,深入探讨T2DM 患者单核细胞与微炎症的关系,及炎症调节的机制,以便为T2DM 及其并发症的预防和改善提供新线索。
[1] Ziegler- Heitbrock L. The CD14+CD16+blood monocytes:their role in infection and inflammation[J]. J Leukoc Biol,2007,81(3):584-592.
[2] Poitou C,Dalmas E,Renovato M,et al. CD14dimCD16+and CD14+CD16+monocytes in obesity and during weight loss:relationships with fat mass and subclinical atherosclerosis arterioscler[J]. Arterioscler Thromb Vasc Biol,2011,31(10):2322-2330.
[3] Pramanik R,Asplin JR,Lindeman C,et al. Lipopolysaccharide negatively modulates vitamin D action by down-regulating expression of vitamin D-induced VDR in human monocytic THP-1 cells[J]. Cell Immunol,2004,232(1-2):137-143.
[4] Du T,Zhou ZG,You S,et al. Modulation of monocyte hyperresponsiveness to TLR ligands by 1,25-dihydroxyvitamin D3 from LADA and T2DM[J]. Diabetes Res Clin Pract,2009,83(2):208-214.
[5] Madhumita JB,Marie EM,Hyunjin S,et al. Elevated proinflammatory cytokine production by a skewed T cell compartment requires monocytes and promotes inflammation in type 2 diabetes[J]. J Immunol,2011,186(2):1162-1172.
[6] Juan F,Navarro G,Carmen MF. The role of inflammatory cytokines in diabetic nephropathy[J].J Am Soc Nephrol,2008,19(3):433-442.
[7] Guadalupe OM,Virginia LP,Oscar LF,et al. Suppressors of cytokine signaling abrogate diabetic nephropathy[J]. J Am Soc Nephrol,2010,21(5):763-772.
[8] Sridevi D,Jung MY,Catherine R,et al. Low vitamin D levels correlate with the proinflammatory state in type 1 diabetic subjects with and without microvascular complications[J]. Am J Clin Pathol,2011,135(3):429-433.
[9] Ozfirat Z,Chowdhury TA. Vitamin D deficiency and type 2 diabetes[J]. Postgrad Med J,2010,86(1011):18-25.
[10] Sheena K,Reinhold V,Ravi R,et al. Association of vitamin D with insulin resistance and β-cell dysfunction in subjects at risk for type 2 diabetes[J]. Diabetes Care,2010,33(6):1379-1381.
[11] 杨小清,郑少雄. 维生素D 与糖尿病和代谢综合征[J].国际内分泌代谢杂志,2007,27(3):190-193.
[12] Giulietti A,van Etten E,Overbergh L,et al. Monocytes from type 2 diabetic patients have a pro-inflammatory profile:1,25-dihydroxyvitamin D3works as anti-inflammatory[J]. Diabetes Res Clin Pract,2007,77(1):47-57.
[13] Elizabeth MB,Khadir R,Wassim E,et al. Monocytes from patients with type 1 diabetes spontaneously secrete proinflammatory cytokines inducing Th17 cells[J]. J Immunol,2009,183(7):4432-4439.
[14] Donath MY,Shoelson SE. Type 2 diabetes as an inflammatory disease[J]. Nat Rev Immunol,2011,11(2):98-107.
[15] Pelletier M,Girard D. Interleukin-15 increases neutrophil adhesion onto human respiratory epithelial A549 cells and attracts neutrophils in vivo[J]. Clin Exp Immunol,2005,141(2):315-325.
[16] Girard D,Paquet ME,Paquin R,et al. Differential effects of interleukin-15 (IL-15)and IL-2 on human neutrophils:modulation of phagocytosis,cytoskeleton rearrangement,gene expression,and apoptosis by IL-15[J].Blood,1996,88(8):3176-3184.
[17] Alleva DG,Kaser SB,Monroy MA,et al. IL-15 functions as a potent autocrine regulator of macrophage proinflammatory cytokine production:evidence for differential receptor subunit utilization associated with stimulation or inhibition[J].J Immunol,1997,159(6):2941-2951.
[18] Tripathi P,Kurtulus S,Wojciechowski S,et al. STAT5 is critical to maintain effector CD8+T cell responses[J]. J Immunol,2010,185(4):2116-2124.
[19] Hofmann MA,Schiekofer S,Kanitz M,et al. Insufficient glycemic control increases nuclear factor-κB binding activity in peripheral blood mononuclear cells isolated from patients with type 1 diabetes[J].Diabetes Care,1998,2l(8):1310-1316.
