青蒿琥酯通过抑制ERK1/2 蛋白活化负性调控HSC-T6 细胞cyclin D1 的表达和AP-1 活性*
2012-12-23来丽娜宋晓亮任泽恩杨柳絮王黎敏郑王巧郭春花张晓一
来丽娜, 宋晓亮, 任泽恩, 杨柳絮, 王黎敏, 郑王巧, 郭春花, 张晓一
(长治医学院1药理教研室,3 肝病研究所,4 机能实验室,2 长治市第二人民医院,山西 长治046000)
肝纤维化是所有慢性肝病共有的病理特征,是向肝硬化发展的必经阶段,在此过程中肝星状细胞(hepatic stellate cells,HSCs)的激活是肝纤维化形成的中心环节。目前临床仍没有疗效好、不良反应少的抗肝纤维化药物。我国中药资源丰富,从天然药物中发掘抗肝纤维化药物具有广阔的前景。青蒿琥酯(artesunate,Art)是青蒿素水溶性衍生物,前期实验表明Art 对四氯化碳(carbon tetrachloride,CCL4)导致的大鼠肝纤维化模型和牛血清白蛋白导致的大鼠肝纤维化模型有防治作用[1-2],且体外可抑制HSC-T6 细胞的增殖,阻止其从G0/G1期进入S期[3]。本实验用血小板源性生长因子BB(platelet-derived growth factor BB,PDGF-BB)刺激HSC-T6细胞,观察不同浓度的Art 对HSCs 增殖信号分子的影响,进一步探讨Art 抗肝纤维化作用的分子机制。
材 料 和 方 法
1 材料
1.1 试剂 Art(原料药,广西桂林制药二厂);RNAiso Plus 抽提试剂(TaKaRa),DL2000 DNA marker(TaKaRa),RNA PCR Kit(AMV)3.0(TaKaRa),Western blotting 细胞裂解液(碧云天生物技术研究所),BCA 蛋白浓度测定试剂盒(碧云天生物技术研究所),大鼠Ⅰ型胶原ELISA 试剂盒(上海时代科技发展有限公司),Western Blue® anti-mouse IgG(Promega),小鼠来源甘油醛-3-磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)Ⅰ抗(碧云天生物技术研究所),小鼠来源cyclin D1 Ⅰ抗(Santa Cruz)。磷酸化细胞外信号调节激酶(phosphorylated extracellular signal-regulated kinase,p-ERK)单克隆抗体和ERK 特异性阻断剂PD98059 均购自Promega。PDGF-BB(PeproTech),EMSA/Gel-Shift 试剂盒和EMSA 用AP-1 探针购自碧云天生物技术研究所;核蛋白提取试剂盒购自Active Motif,[γ-32P]ATP 购自北京亚辉生物医学工程公司,PCR 引物由上海生工生物工程公司合成。
1.2 仪器 CL31R 低温超速离心机(Thermo),核酸蛋白分析仪(Bio-Rad),S1000PCR 扩增仪(Bio-Rad),凝胶成像分析系统(Alpha Innotech),MK3 酶标仪(Thermo);IX70 倒置显微镜(奥林巴斯),CO2恒温培养箱(NuAire),SW-CJ-ZFD 超净工作台(中国安泰公司)。
2 方法
2.1 HSC-T6 细胞的培养及实验分组 HSC-T6细胞株由长治医学院肝病研究所赵中夫教授惠赠,用DMEM 常规培养。将指数生长期的细胞按1 ×109/L 密度接种。待细胞铺满约70%时,换无血清的DMEM 培养6 h,而后分为6 组:对照组;PDGF-BB 组(终浓度60 μg/L);PDGF-BB +Art 组(用60 μg/L PDGF-BB 预处理30 min 后再加入6.25 mg/L、25 mg/L 和50 mg/L Art),PDGF-BB +PD98059组(用60 μg/L PDGF-BB 预处理30 min 后再加入终浓度为100 μmol/L PD98059),药物作用24 h。
2.2 ELISA 法测定HSCs 培养上清液中Ⅰ型胶原的含量 采用双抗夹心ELIS(A)法,分组同上。按说明书绘制标准曲线,收集上清液测定Ⅰ型胶原的吸光度(A)值,根据标准曲线计算Ⅰ型胶原的含量。
2.3 RT-PCR 测定ERK1/2 和cyclin D1 mRNA 的表达 RNAiso Plus 提取HSCs 总RNA,核酸蛋白分析仪测定其含量。逆转录反应以总RNA 1 μg 为模板,用oligo (dT)引物反转录RNA 为cDNA,然后加入待测定指标的引物进行扩增。ERK1/2(451 bp)上游引物5'-GCT GAC CCT GAG CAC GAC CA-3',下游引物5'-CTG GTT CAT CTG TCG GAT CA-3';cyclin D1 (449 bp)上游引物5'-TGT TCG TGG CCT CTA AGA TG-3',下游引物5'-ACT CCA GAA GGG CTT CAA TC-3';β-actin (300 bp)上游引物5'-AGC TGA GAG GGA AAT CGT GCG-3',下游引物5'-GTG CCA CCA GAC AGC ACT GTG-3'。PCR反应条件:ERK1/2(94 ℃30 s,55 ℃30 s,72 ℃1 min,30 个循环),cyclin D1(94 ℃30 s,55 ℃30 s,72℃1 min,30 个循环),内参照β-actin(94 ℃45 s,60℃45 s,72 ℃1 min,30 个循环)。PCR 产物进行1.2%琼脂糖凝胶电泳,凝胶成像分析系统照相及测定条带的灰度值,目的条带与同一样品的β-actin条带的灰度值的比值代表mRNA 的表达水平。
2.4 Western blotting 检测细胞内p-ERK 和cyclin D1 蛋白的表达 收集细胞加入裂解液匀浆,低温离心,蛋白定量。取总蛋白50 μg,经10 %聚丙烯酰胺凝胶电泳后转移到硝酸纤维素膜上,封闭后分别加入Ⅰ抗(1∶500),4 ℃过夜,次日洗膜后再与碱性磷酸酶偶联的Ⅱ抗杂交(1∶2 000),Western Blue® Substrate 显色。以目的条带与同一样品的内参照GAPDH 条带的灰度值的比值代表蛋白的表达量。
2.5 EMSA 法检测AP-1 与DNA 结合的活性
(1)细胞核蛋白提取按试剂盒说明书操作。(2)AP-l 寡核苷酸探针的标记:AP-l 的2 段序列为5'-CGC TTG ATG ACT CAG CCG GAA-3' 和3'-GCG AAC TAC TGA GTC GGC CTT-5'。待标记AP-1 寡核苷酸探针(1.75 μmol/L)2 μL,10 ×T4 kanase buffer 1 μL,nuclease-free water 5 μL,[γ-32P]ATP(3.7 ×1014Bq/L)1 μL,T4 polynucleotide kinase 1 μL,总体积10 μL,设立阴性对照(反应体系中未加细胞核提取物),冷探针竞争反应组(在反应体系中加入未标记AP-l 双链探针),37 ℃反应10 min。(3)聚丙烯酰胺凝胶电泳和放射自显影:用考马斯亮蓝G250 试剂盒测定蛋白浓度,取5 μg 核蛋白,按EMSA kit 说明书进行结合反应,室温下孵育20 min。采用6%聚丙烯酰胺凝胶电泳,60 V 电泳1 h。将凝胶置滤纸上,压片,-70 ℃冰箱中放射自显影24 h,冲洗胶片。将显影结果扫描入计算机内,以积分灰度值表示AP-l 与DNA 的结合活性。
3 统计学处理
结 果
1 各组大鼠HSC-T6 细胞I 型胶原的表达情况
与对照组比较,PDGF-BB 组Ⅰ型胶原表达量明显升高(P <0.01)。PDGF-BB +Art 各剂量组Ⅰ型胶原表达量均小于PDGF-BB 组(P <0.05,P <0.01),经PD98059 预处理阻断ERK1/2 通路后,PDGF-BB 的促HSCs I 型胶原表达的作用也受到抑制,与PDGF-BB 组比较差异显著(P <0.05),见表1。
表1 各组HSC-T6 细胞培养上清液Ⅰ型胶原浓度的变化Table 1. Changes of collagen Type Ⅰconcentration in cell culture supernatants of HSC-T6 cells in different groups(μg/L. ±s.n=9)

表1 各组HSC-T6 细胞培养上清液Ⅰ型胶原浓度的变化Table 1. Changes of collagen Type Ⅰconcentration in cell culture supernatants of HSC-T6 cells in different groups(μg/L. ±s.n=9)
△P <0.05,△△P <0.01 vs control group;* P <0.05,**P <0.01 vs PDGF-BB group.
Group Dose Collagen type ⅠControl 90.7±10.1 PDGF-BB 60 μg/L 148.8±12.5△△PDGF-BB +Art 6.25 mg/L 122.6±12.1△*25 mg/L 119.5±14.6△*50 mg/L 94.1±12.4**PDGF-BB +PD98059 100 μmol/L 115.2±13. 8△*
2 ERK1/2 和cyclinD1 mRNA 在各组HSC-T6细胞中的表达
RT-PCR 结果显示:PDGF-BB 可诱导HSC-T6 细胞内ERK1/2 mRNA 的表达增多,但与对照组比较无显著差异(P >0.05),PDGF-BB + Art(50 mg/L)组,HSCs 细胞内ERK1/2 mRNA 的表达量明显低于PDGF-BB 组(P <0.05),而PDGF-BB +Art(25 mg/L、6.25 mg/L)组与对照组比较无显著差异(P >0.05),PDGF-BB + PD98059 组ERK1/2mRNA 的表达明显受到抑制(P <0.01);随着Art剂量增加对cyclin D1 mRNA 表达量的抑制作用逐渐增强,PDGF-BB + Art(25 mg/L、50 mg/L)组与PDGF-BB 组比较有显著差异(P <0.05),PDGF-BB+PD98059 组cyclinD1 mRNA 的表达量与PDGF-BB 组比较也明显下降(P <0.05),见图1。
3 p-ERK1/2 蛋白和cyclin D1 蛋白在各组HSC-T6 细胞中的表达
Western blotting 结果显 示:PDGF-BB 可使HSCs 内p-ERK1/2 蛋白表达明显高于对照组(P <0.01);加入不同剂量Art 后,HSCs 内p-ERK1/2 的表达量下降,随着Art 剂量增加抑制作用越明显;PDGF-BB + PD98058 组HSC-T6 细 胞 内p-ERK1/2 的表达最低,cyclin D1 蛋白表达趋势与p-ERK1/2 蛋白相似,见图2。
4 实验各组AP-1 活化的情况
抽提细胞核提取物进行EMSA 测定AP-1 活性,检测到了AP-1 和DNA 形成的复合体阳性信号,Art 干预HSC-T6 细胞后,AP-1 和DNA 形成的复合体阳性信号逐渐减小,且随Art 浓度的增大,检测到的信号越小,PDGF-BB + PD98059 组信号更弱,与PDGF-BB 组比较差异显著(P <0.01),见图3。

Figure 1. The expression of ERK1/2 and cyclin D1 mRNA in HSC-T6 cells in different groups. A:RT-PCR pictures of ERK1/2 mRNA and cyclin D1 mRNA expression;B:quantitative analysis of the ratios of ERK1/2 and cyclin D1 to β-actin. M:DNA marker;Lane 1:control group;Lane 2:PDGF-BB group;Lane 3:PDGF-BB+Art(6.25 mg/L)treated group;Lane 4:PDGF-BB + Art(25 mg/L)treated group;Lane 5:PDGF-BB + Art(50 mg/L)treated group;Lane 6:PDGF-BB+PD98059(100 μmol/L)treated group. ±s.n=6. △P <0.05,△△P <0.01 vs control group;*P <0.05,**P <0.01 vs PDGF-BB group.图1 实验各组HSC-T6 细胞ERK1/2 mRNA and cyclinD1 mRNA 的表达
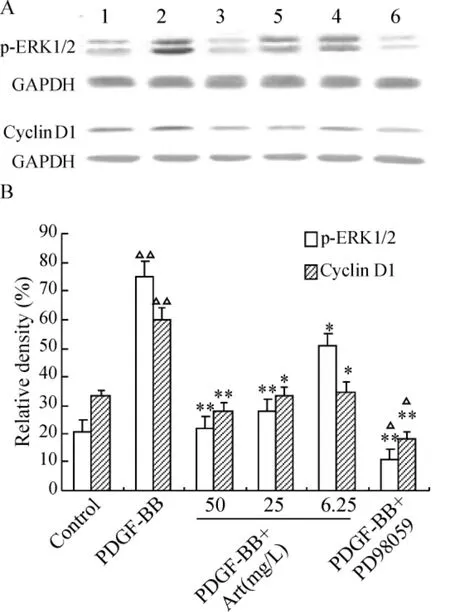
Figure 2. The protein expression of p-ERK1/2 and cyclin D1 in HSC-T6 cells in different groups. A:Western blotting picture of p-ERK1/2 and cyclin D1 protein expression.Lane 1:control group;Lane 2:PDGF-BB group;Lane 3:PDGF-BB + Art(50 mg/L)treated group;Lane 4:PDGF-BB + Art(25 mg/L)treated group;Lane 5:PDGF-BB +Art(6.25 mg/L)treated group;Lane 6:PDGF-BB +PD98059(100 μmol/L)treated group. B:quantitative analysis of the ratio of p-ERK1/2 and cyclin D1 to GAPDH. ± s. n =6. △P <0.05,△△P <0.01 vs control group;* P <0.05,**P <0.01 vs PDGF-BB group.图2 实验各组HSC-T6 细胞p-ERK1/2 和cyclin D1 蛋白的表达
讨 论
肝脏持续的慢性损伤导致细胞增殖和细胞外基质过度沉积逐渐形成肝纤维化。肝纤维化的特征性病理改变是以Ⅰ型胶原为主的细胞外基质在肝内大量沉积。HSCs 的激活是肝纤维化发生、发展的中心环节,被看作是抗纤维化治疗的主要靶细胞[4-5]。

Figure 3. EMSA analysis of AP-1 DNA binding activity of each group in HSC-T6 cells. A:autoradiography picture of EMSA;B:densitometry analysis of EMSA. Lane 1:negative control;Lane 2:control group;Lane 3:PDGF-BB group;Lane 4:PDGF-BB+Art(50 mg/L)treated group;Lane 5:PDGF-BB + Art(25 mg/L)treated group;Lane 6:PDGF-BB +Art(6.25 mg/L)treated group;Lane 7:PDGF-BB +PD98059(100 μmol/L)treated group;Lane 8:[γ- 32P]-labeled AP-1 Oligo plus unlabeled AP-1 Oligo(competitor). ± s. n =6. * P <0.05,**P <0.01 vs PDGF-BB group.图3 AP-1 DNA 结合活性的EMSA 分析
在肝纤维化中,PDGF-BB 是HSCs 最强的有丝分裂原之一,对HSCs 有着极强的促增殖作用。本实验发现Art 能有效抑制PDGF 诱导的HSC-T6 分泌Ⅰ型胶原。丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)是细胞内的一类丝氨酸/苏氨酸蛋白激酶,研究证实,MAPKs 信号转导通路存在于大多数细胞内,被认为是许多信号通路的共同通道,ERK1/2 是其主要成员。ERK1/2 在肝纤维化过程中的作用已被大量实验证明,本课题组也证实了ERK1/2 参与了PDGF-BB 所诱导的HSCs 增殖[6]。ERK1/2 位于胞浆内,被激活后迅速穿过核膜,ERK活化是将信号从细胞膜表面受体转导至细胞核的关键[7]。本实验可以看到Art 可抑制PDGF-BB 诱导的HSC-T6 内p-ERK1/2 的表达,随Art 浓度的增加作用增强。而对ERK1/2 mRNA 的抑制作用不明显,提示Art 对PDGF-BB 刺激的HSCs 增殖和Ⅰ型胶原合成的影响可能主要是抑制ERK1/2 蛋白的活化而实现的。
活化的ERK1/2 通过信号级联反应作用于核转录因子如cyclinD1、AP-l 等调节靶基因转录,引起特定蛋白的表达或活性改变,与细胞的增殖及恶性转化密切相关[8]。本实验前期研究表明Art 体外可阻止HSC-T6 从G0/G1期进入S 期[3]。近年来对细胞增殖周期的研究表明[9],细胞周期中存在2 个重要调控点即G1/S 和G2/M 期调控点,只要G1期内的正性调节因子累积达到一定程度,周期越过G1/S交界点,以后细胞就不再依赖于细胞外促生长因子而顺序完成整个细胞周期,因而G1/S 调控点是影响细胞周期的关键。Cyclin D1 特异性地表达于细胞增殖周期的G1期,调控G0期细胞向G1期的转化,是细胞增殖周期启动的重要调控因子。
转录因子AP-1 在细胞增殖转录时调控细胞多种基因的表达[10-11]。AP-1 由Jun 和Fos 家族成员组成,敲除c-jun 基因小鼠胚胎纤维母细胞存在严重增殖缺陷,cyclin D1、cyclin E 依赖的激酶活性极低,导致细胞不能通过G1/S 限制点,提示AP-1 的活化能促使细胞周期启动[12]。有研究认为AP-1是MAPK 信号通路的作用底物之一。ERK /MAPK主要通过转录因子c-Fos 参与细胞的增殖分化[10]。也有研究表明,在c-Jun/JunB 介导的信号转导通路与细胞周期G1/S 期相关的重要靶基因cyclin D1 之间有直接联系。利用人HeLa 细胞系研究证实,cyclin D1 启动子上有2 个AP-1 样结合位点用以激活cyclin D1 启动子[13],且c-Jun 和JunB 的比例决定cyclin D1 在G1期的转录与细胞周期的平衡,最终调控cyclin D1 启动子活性,影响其表达[14-15],本实验可看到PD98059 可明显抑制cyclin D1 基因和蛋白的表达及AP-1 与DNA 的结合活性。可见AP-1的活性和cyclin D1 基因和蛋白达水平受ERK1/2 通路的调控,但AP-1 和cyclin D1 之间是否也存在相互作用,还需进一步研究。
综上,本实验证实Art 能有效抑制ERK1/2 蛋白的活化,同时剂量依赖性地抑制cyclin D1 基因、蛋白表达水平及AP-1 与DNA 的结合,但抑制作用不如PD98059 明显,提示Art 对cyclin D1 和AP-1 活性的抑制作用不是直接作用,可能是通过有效抑制ERK1/2 蛋白的活化从而下调cyclin D1 表达及AP-1 与DNA 的结合活性。HSCs 的激活和表型变化涉及许多信号通路,并且各条信号通路及信号分子之间存在相互作用。实验中看到Art 抑制Ⅰ型胶原的作用强于PD98059,提示Art 对HSCs 细胞增殖的其它通路可能还有作用。
[1] 方步武,来丽娜,林雅军,等.青蒿琥酯抗四氯化碳致大鼠肝纤维化的作用[J].中国药理学通报,2005,21(6):762-763.
[2] 来丽娜,杨柳絮,郭春花,等. 青蒿琥酯抗大鼠免疫性肝纤维化的作用及机制研究[J]. 中国药理学通报,2011,27(1):125-129.
[3] 来丽娜,方步武.青蒿琥酯对大鼠肝星状细胞增殖的影响[J].中药药理与临床,2006,22(3):25-26.
[4] 主余华,任万华,张春清,等. RNA 干扰抑制肝星状细胞CTGF 表达对细胞外基质分泌的影响[J].中国病理生理杂志,2008,24(11):2245-2250.
[5] 刘立新,张骞骞,韩德五,等. IGFBP2、IGFBP6 在TGFβ1活化的肝星状细胞中表达[J].中国病理生理杂志,2008,24(12):2481-2483.
[6] 来丽娜,任泽恩,杨柳絮,等. ERK1/2 信号通路在青蒿琥酯抑制PDGF-BB 诱导HSC 细胞增殖中的作用[J].中国临床药理学与治疗学,2011,16(2):126-130.
[7] Manning G,Whyte DB,Martinez R,et al. The protein kinase complement of the human genome[J]. Science,2002,298(5600):1912-1934.
[8] Johnson GL,Lapadat R. Mitogen-activated protein kinase pathways mediated by ERK,JNK,and P38 portein kinases[J].Science,2002,298(5600):1911-1912.
[9] Kavurma MM,Khachigian LM. ERK,JNK,and p38 MAP kinases differentially regulate proliferation and migration of phenotypically distinct smooth muscle cell subtypes[J]. J Cell Biochem,2003,89(2):289-300.
[10] Sabapathy K,Wagner EF. JNK2:a negative regulator of cellular proliferation[J]. Cell Cycle,2004,3(12):1520-1523.
[11] Hattori Y,Hattori S,Akimoto K,et al.Globular adiponectin activates nuclear factor-κB and activating protein-1 and enhances angiotensin II-induced proliferation in cardiac fibroblasts[J].Diabetes,2007,56(3):804-808.
[12] Milde-Langosch K,Bamberger AM,Methner C,et al.Expression of cell cycle-regulatory proteins Rb,p16/MTS1,p27/KIP1,p21/WAF1,cyclin D1 and cyclin E in breast cancer:correlations with expression of activating protein-1 family members[J]. Int J Cancer,2000,87(4):468-472.
[13] Herber B,Truss M,Beato M,et al.Inducible regulatory elements in the human cyclin D1 promoter[J]. Oneogene,1994,9(7):2105-2107.
[14] Song X,Tao Y,Zeng L,et al. Epstein-Barr virus-encoded latent membrane protein 1 modulates cyclin D1 by c-Jun/Jun B heterodimers[J]. Sci China C Life Sci,2005,48(4):385-393.
[15] Bakiri L,Lallemand D,Ella BW,et al. Cell cycle-dependent variations in c-Jun and JunB phosphorylation:a role in the control of cyclin D1 expression[J]. EMBO J,2000,19(9):2056-2068.
