细胞自噬对饥饿环境下椎间盘髓核细胞的保护作用*
2012-11-06江立波张小磊徐华梓吴瑞凯杨光永胡旭琪郑旭浩
江立波, 张小磊, 徐华梓, 吴瑞凯, 杨光永, 吴 畏, 胡旭琪, 郑旭浩
(温州医学院附属第二医院脊柱外科, 浙江 温州 325000)
1000-4718(2012)07-1302-06
2012-01-16
2012-03-28
浙江省“重中之重”学科开放基金资助项目(No. 2011GK001)
△通讯作者 Tel:0577-88002854;E-mail:spinexu@163.com
细胞自噬对饥饿环境下椎间盘髓核细胞的保护作用*
江立波, 张小磊, 徐华梓△, 吴瑞凯, 杨光永, 吴 畏, 胡旭琪, 郑旭浩
(温州医学院附属第二医院脊柱外科, 浙江 温州 325000)
目的探讨饥饿条件下椎间盘髓核细胞是否发生自噬及自噬对髓核细胞的作用。方法原代培养SD大鼠髓核细胞,对细胞表型进行鉴定后,将细胞分为正常对照组、3-甲基腺嘌呤(3-methyladenine,3-MA)加DMEM培养基组、3-MA加EBSS培养基组和EBSS饥饿组,接着用单丹磺酰戊二胺(monodansylcadaverine,MDC)染色、透射电镜和Western blotting观察各组细胞的自噬差异,最后采用CCK-8法测定细胞生长抑制率以及TUNEL法测定细胞凋亡率。结果成功培养出SD大鼠髓核细胞。与对照组相比,电镜和荧光显微镜下观察到EBSS培养基诱导的髓核细胞出现自噬囊泡,但是3-MA 抑制后细胞自噬泡明显减少;Western blotting检测发现LC3-II/LC3-I和Beclin-1/β-actin在EBSS处理组明显大于3-MA+EBSS处理组和对照组(P<0.05), 而3-MA+EBSS处理组的细胞抑制率和凋亡率明显高于EBSS处理组(P<0.05)。结论饥饿可以诱导大鼠椎间盘髓核细胞发生自噬,并且3-MA能抑制自噬发生。自噬对饥饿环境下的髓核细胞可能具有一定的保护作用。
髓核细胞; 自噬; 细胞凋亡; 饥饿
椎间盘退变往往伴随着椎间盘细胞数目的减少和活性的降低,同时髓核细胞的减少影响了细胞外蛋白多糖和II型胶原的代谢平衡,这已经被许多文献所认可[1-2]。哺乳动物细胞有3种死亡方式,分别为坏死、凋亡和新发现的自噬,而凋亡已被认为与椎间盘的退变有密切的联系[1],可是细胞自噬在椎间盘领域的研究目前仍然较少。有学者发现SD大鼠的纤维环细胞经无血清饥饿诱导后有自噬现象[2],而椎间盘髓核细胞的自噬现象及其作用尚未有明确的研究,因此本实验通过对髓核细胞进行饥饿诱导的方法来观察髓核细胞的自噬现象及其对细胞的作用。
材 料 和 方 法
1材料
DMEM/F12培养基及胎牛血清(Gibco),Eagle’s balanced salt solution(EBSS)及II型胶原酶(Gibco),3-甲基腺嘌呤(3-methyladenine,3-MA;Sigma),TUNEL凋亡检测试剂盒(Roche),单丹磺酰戊二胺(monodansylcadaverine,MDC)荧光染料(Gibco),Cell Counting Kit-8(CCK-8;Dojind)、RIPA 细胞裂解液、BCA蛋白含量测定试剂、SDS-PAGE凝胶配制试剂盒及ECL发光液(上海碧云天公司),LC3、Beclin-1及β-actin兔抗大鼠多克隆抗体(CST),羊抗兔辣根过氧化物酶IgG(北京康为世纪公司),SD大鼠由温州医学院动物实验室提供,许可证号为SCXK(浙)2010-0044。
2细胞培养及形态学鉴定
取约150 g重的SD大鼠,无菌环境下取出整个腰椎,移至细胞房用10倍显微镜将胶冻状的髓核细胞取出,见图1,置于含有1%青霉素、链霉素的DMEM/F12培养液中,将5只SD大鼠的髓核聚集起来,洗净后,将髓核组织转移到离心管中,用0.1%II型胶原酶和2 kU/L透明质酸酶消化4 h,离心后用吸管将组织种植于25 cm2培养瓶中,2 h后翻转培养瓶,加入含1×105U/L青霉素、2 mmol/L谷氨酰胺,100 mg/L链霉素的DMEM/F12培养基中。当原代细胞在培养瓶中达到80%融合时,用0.25%胰酶传代以3×105细胞接种于6孔板中爬片,待细胞贴壁以后进行II型胶原免疫细胞化学染色、甲苯胺蓝染色及阿利新蓝染色。
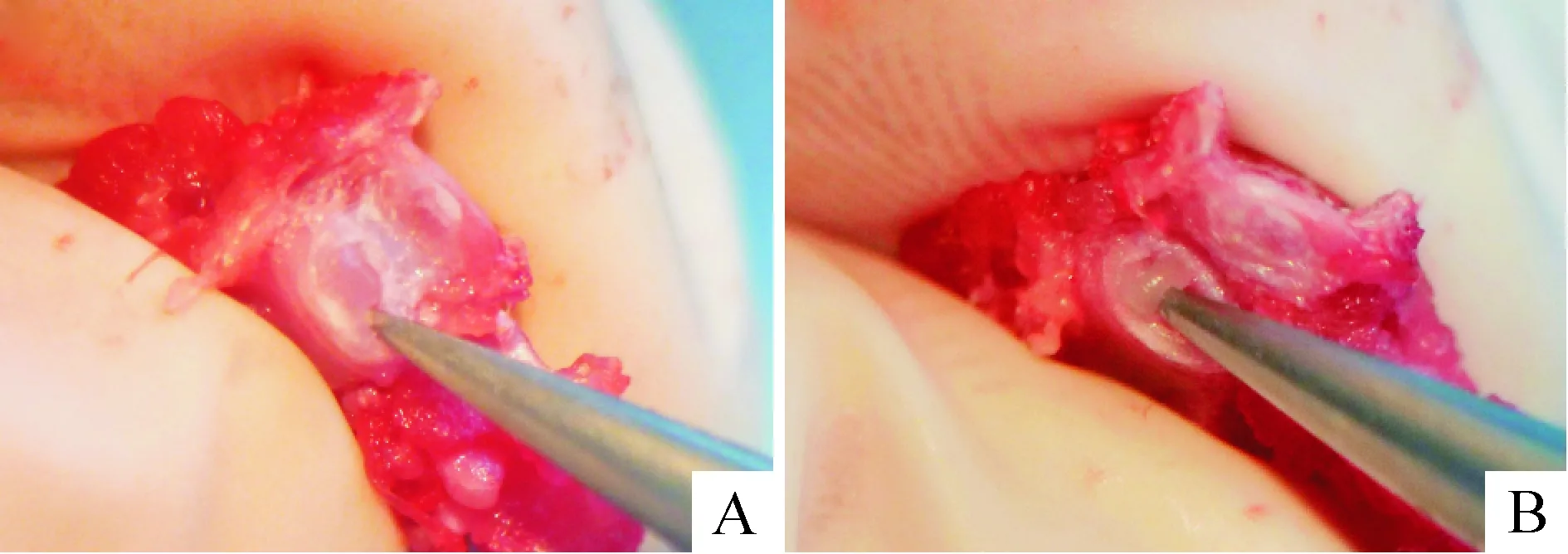
Figure 1. The process of separating gel-like nucleus pulposus from the anulus fibrosus under dissecting microscope.A:the intact intervertebral disc;B:the gel-like nucleus pulposus was isolated from the intervertebral disc when the endplate was cut off by the scissors.
图1显微镜下分离胶冻样髓核组织的过程
3细胞的分组及处理
所用细胞均为第2代细胞,实验均重复3次以上,分组为: (1) 对照组(A组):用上述的DMEM培养基培养髓核细胞; (2)3-MA+DMEM组(B组):含有10 mmol/L 3-MA的上述DMEM培养液培养细胞2 h; (3)3-MA+EBSS(C组):首先用含有10 mmol/L 3-MA的上述DMEM培养液处理预处理细胞1 h,之后换用含有10 mmol/L 3-MA的EBSS平衡盐饥饿髓核细胞2 h; (4) EBSS(D组):用EBSS平衡盐溶液饥饿细胞2 h。
4细胞自噬的鉴定
4.1MDC荧光染色鉴定髓核细胞的自噬泡 采用Biederbick等[3]实验方法,将各组细胞爬片进行处理后,去培养基,用PBS洗2遍,用0.05 mmol/L MDC染料于37 ℃孵育细胞60 min,吸去染料后用4%多聚甲醛固定5 min,PBS洗2次,晾干后立刻用荧光显微镜观察,激发滤片为365 nm,阻断滤片为430 nm。在200倍视野下,随即取100个细胞,计数含有点状自噬泡的细胞,并计算自噬细胞比率=含自噬泡的细胞/100个细胞,重复3次 ,计算平均值。
4.2透射电镜观察髓核细胞的自噬现象 各组取2瓶细胞,分别进行处理并离心成团,在EP管中2%戊二醛4 ℃固定过夜,PBS漂洗,1%锇酸固定,醋酸铀染色,梯度丙酮脱水,预包埋,Epon 812环氧树脂包埋,半薄切片及甲苯胺蓝染色进行定位,LKB-V超薄切片机超薄切片,透射电镜下观察髓核细胞。
4.3Western blotting检测髓核细胞的LC3和Beclin-1蛋白的表达 在6孔板中将各组细胞用PBS洗2遍后,用蛋白提取缓冲液RIPA(radioimmunoprepciption assay)和蛋白酶抑制剂PMSF(phenylmethanesulfonyl fluoride)提取细胞的蛋白,BCA法测定总浓度大小,SDS-PAGE电泳,将LC3目的蛋白转至0.22 μm大小的PVGF膜上,而Beclin-1和内参照则转至0.45μm的膜上,封闭,孵LC3抗体(1∶500)、Beclin-1抗体(1∶500)及β-actin抗体(1∶1 000)4 ℃过夜,孵育辣根过氧化物酶标记的Ⅱ抗(1∶2 500),常规ECL发光液显色。
5细胞生长活性及凋亡水平的检测
5.1CCK-8法测定各组细胞的抑制率 取对数期细胞,将浓度为5×1010/L的细胞接种到96孔板中,每孔为100 μL,每组设置6个复孔,同时设不含细胞的DMEM和EBSS分别作为本底值,A组为空白对照组,各组在培养箱内培养24 h后使其贴壁,用PBS清洗后,分别换用100 μL的不同培养液后,孵育1 h,加入CCK-8反应液10 μL, 于37 ℃下再孵育1 h,总共处理时间为2 h,用酶标仪检测450 nm波长处吸光度(A)值,按下列公式计算细胞生长抑制率:B组细胞生长抑制率= (空白对照组A值-实验组A值)/(空白对照组A值-DMEMA值),C、D组细胞生长抑制率= [(空白对照组A值-DMEMA值)-(实验组A值-EBSSA值) ]/(空白对照组A值-DMEMA值)。
5.2TUNEL荧光比较不同组的凋亡水平 将细胞爬片按照分组进行不同的处理后,吸取处理液后用10%多聚甲醛固定细胞30 min,再加入0.1%Triton X-100的PBS冰浴孵育2 min,按TUNEL凋亡试剂盒说明进行操作后荧光显微镜下观察细胞。在200倍视野下数细胞总数,荧光下数凋亡细胞数目,重复取3个视野,取平均值,计算髓核细胞凋亡率=凋亡细胞数/视野下细胞总数。
6统计学处理
结 果
1细胞培养及形态学鉴定
椎间盘髓核细胞大多为多角形或者梭形,有较长的突起,可以跨越几个细胞的长度,颗粒状的细胞质,细胞质中有分布较大的囊泡,原代培养15 d左右达到融合状态,传代次数增多后细胞逐渐呈长梭形。原代中同时看到圆形的、大于髓核细胞的脊索细胞,内含大量空泡状结构,并且几乎不增殖,周围往往被梭形细胞包绕。II型胶原免疫细胞化学染色可见细胞胞质中棕黄色的颗粒,以核周为著;甲苯胺蓝染色可见细胞胞质异染成紫色;阿利新蓝染色可见细胞质染成淡蓝色,见图2。上述实验结果证明了本实验的细胞为髓核的类软骨样细胞。

Figure 2. The morphological presentation of nucleus pulposus cells (×200). A: under phase-contrast microscope; B: toluidine blue staining;C: Alcian blue staining;D: immunocytochemical staining for type II collagen.
图2髓核细胞形态学表现
2MDC荧光染色观察各组髓核细胞的自噬泡
荧光显微镜下可见D组细胞吸收MDC染料,从而较多细胞均含有大量点状蓝绿色荧光结构,主要分布在核周围,而C组含蓝绿色点状物质的细胞较D组明显减少(且细胞内的点状结构密度也明显降低),A组和B组的细胞内均无明显的自噬泡出现,见图3。计算A、B、C和D组的自噬细胞百分率分别为(4.9±1.2)%、(4.7±1.0)%、(11.1±1.7)%和(67.7±8.8)%, D组与A、B、C组差异均有统计学意义(P<0.05),而A、B、C各组之间无明显差异(P>0.05)。

Figure 3. MDC staining of the autophagic vacuoles in nucleus pulposus cells(×400).A:control;B:3-MA+DMEM;C:3-MA+EBSS;D:EBSS.
图3髓核细胞MDC荧光染色
3电镜下观察细胞超微结构
A组髓核细胞大小约为10 μm,细胞核呈圆形,核膜完整,无明显切迹,胞浆内清晰可见线粒体、内质网和散在的致密糖原颗粒;B组细胞超微形态与A组细胞相似;C组可见细胞明显固缩,较正常髓核细胞小,细胞核亦逐渐固缩,染色质浓集,电子密度增高,并且形成凋亡小体,偶尔亦可见自噬泡,同时可以看到部分细胞坏死,细胞浆崩解,没有完整细胞膜结构。D组可见细胞核仍然呈圆形,并无明显固缩,但是细胞浆内可见大量囊泡状结构,在高倍镜下可见双层膜结构,将各种蛋白质或者细胞器包裹,见图4。
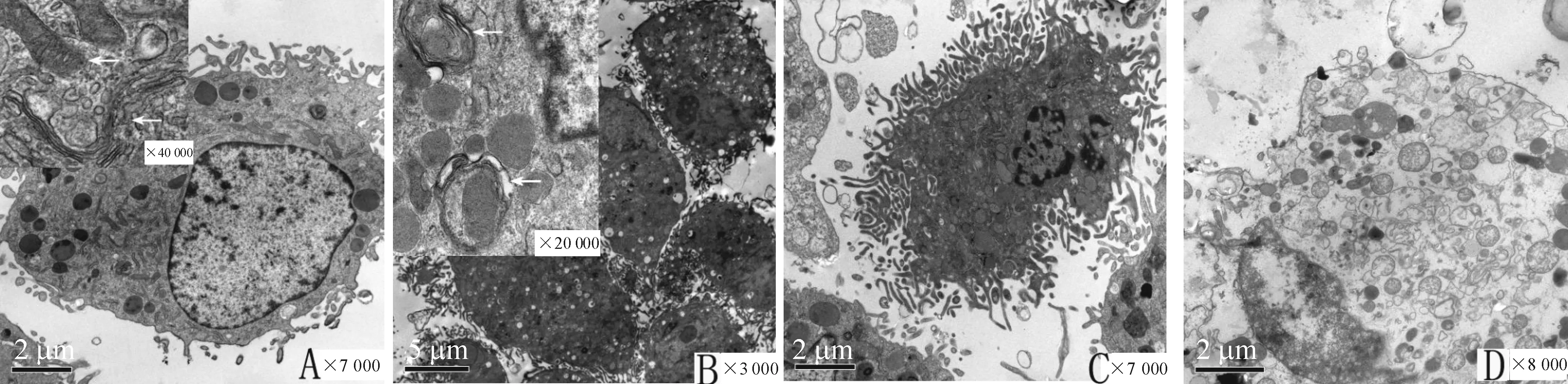
Figure 4. Electron micrographs of nucleus pulposus cells.A:a normal cell; B: the autophagosomes with double-limiting membrane in nucleus pulposus cells of EBSS treatment group; C:apoptotic changes including cell condensation and apoptoic body in 3-MA+EBSS group; D: necrotic cells in 3-MA+EBSS group.
图4髓核细胞的电镜下表现
4各组细胞的LC3和Beclin-1的蛋白表达水平
Western blotting 检测发现D组细胞的LC3-II/LC3- I和 Beclin-1/β-actin的灰度值明显大于A、B和C组(P<0.05),并且C组的LC3-II/LC3- I灰度值比A组和B组大(P<0.05), Beclin-1/β-actin值在A、B、C组中均无明显差异(P>0.05),见图5。
5各组细胞的生长抑制率
A、B、C和D组的细胞生长抑制率分别为0、(1.71±1.05)%、(62.69±6.39)%和(33.39±4.59)%,A组和B组的抑制率无明显差异(P>0.05), C组细胞生长抑制率明显大于其余各组(P<0.05),同时D组亦大于A组和B组(P<0.05),见图6。
6各组细胞的凋亡水平比较
TUNEL荧光染色可见C组有较多阳性细胞,D组相对较少,而A组和B组几乎没有阳性细胞。C组的髓核细胞凋亡率为33.41%,明显高于D组的15.53%(P<0.05),而A组和B组几乎没有细胞发生凋亡,见图7。
讨 论
细胞自噬通过自噬泡与溶酶体结合来降解细胞内老化和损坏的细胞器以及错构和多余的蛋白质,从而产生新的氨基酸和能量,进而参与细胞的各种病理生理过程,这是一种相对保守的机制[4]。细胞自噬往往与老年性疾病有密切联系,Carames等[5]证实人类骨关节炎和小鼠的关节炎模型与自噬密切相关,并且自噬可能对骨关节炎具有保护作用,Ye等[6]人亦证实在大鼠退变的椎间盘中存在自噬现象。椎间盘退变亦作为一种年龄相关性疾病,目前尚不清楚细胞自噬在椎间盘退变中的具体机制。


图5各组细胞的LC3和Beclin-1蛋白的表达


图6CCK-8法测定各组细胞的生长抑制率
细胞周围环境的改变可以引起细胞的各种应激反应,而细胞的应激反应会上调自噬水平。将细胞进行各种物质的饥饿,如氨基酸、生长因子、氧气、能量等,均可以引起细胞自噬,但是最能提高细胞自噬水平的是氨基酸[7],如本实验所用的EBSS培养基就是无氨基酸的培养基。因为细胞自噬通过降解胞浆中的老化蛋白质和细胞器而为细胞和细胞周围环境补充新的氨基酸,如果降低周围环境中的氨基酸的总量,细胞则通过提高自噬水平来负反馈增加细胞周围环境中氨基酸的含量,而这些氨基酸主要用来合成那些适应饥饿的蛋白质,如溶酶体酶、氧化呼吸链上的蛋白以及抗氧化酶等等[8]。本实验通过电镜、MDC观察到了髓核细胞双层膜结构自噬囊泡的形成,并且运用Western blotting检测到自噬相关蛋白LC3-II/LC3- I和 Beclin-1/β-actin较对照组有显著升高,因此作者从多方面证实了无氨基酸的EBSS培养基可以显著提高大鼠椎间盘髓核细胞的自噬水平,这与其它哺乳动物的细胞相似[2]。
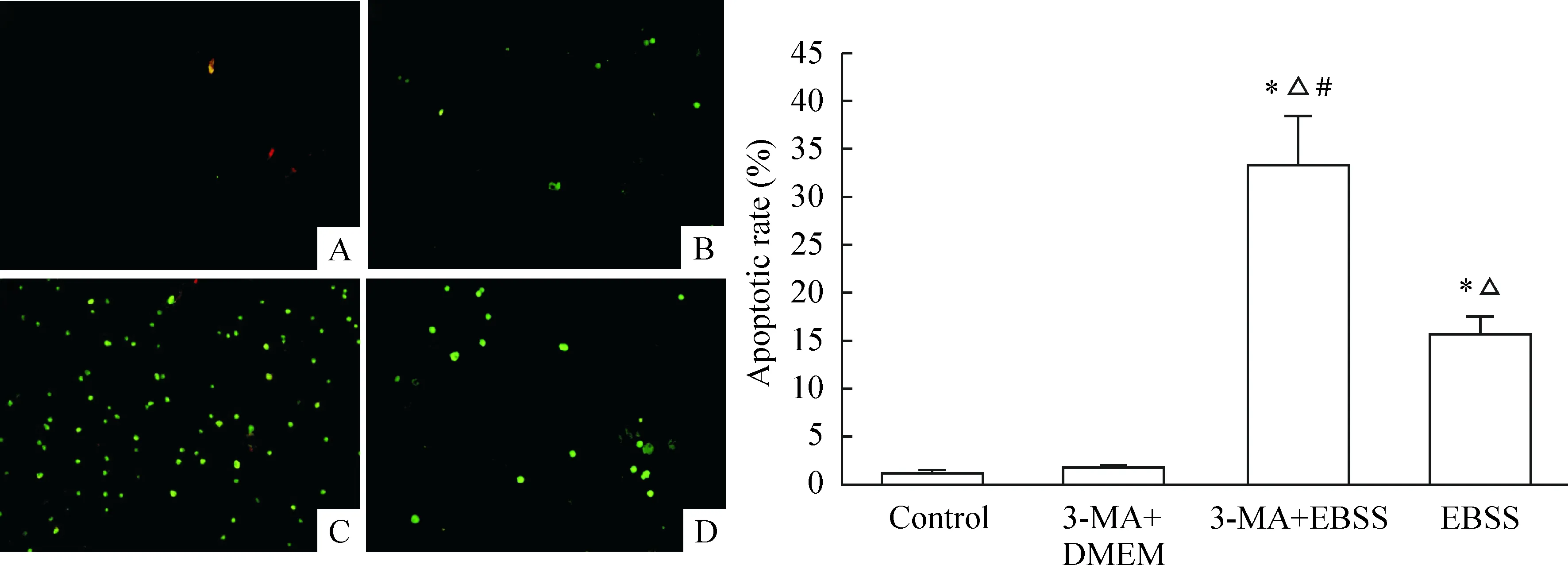

图7各组细胞的TUNEL荧光染色及凋亡率
Shen等[2]证实椎间盘纤维环细胞在无血清饥饿环境下存在24 h后出现自噬现象,但是细胞自噬是对周围环境改变的快速反应过程,往往只需要几小时,并且细胞自噬是一个动态的过程,自噬流(autophagy flux)会随着时间而发生改变[9]。本实验用EBSS培养基只将髓核细胞饥饿2h,能够较为准确地在自噬流高峰期进行检测。椎间盘的营养供应主要依靠终板的渗透和外层纤维环的血供,因此椎间盘退变时终板的钙化主要导致髓核细胞的营养缺乏,使得髓核细胞处于一种相对饥饿的状态;并且伴随椎间盘退变的主要是髓核细胞的减少和活性降低,因此本文以饥饿髓核细胞2 h为研究手段可以更好地探讨体内椎间盘营养缺乏时对于髓核细胞自噬的影响,从而为揭露细胞自噬在椎间盘退变中的作用提供一定的基础。
电镜是证明自噬和凋亡现象的金标准,我们通过电镜在饥饿的髓核细胞中同时观察到了自噬和凋亡现象。自噬和凋亡起源于同一上游信号通路,在各种环境下通过Bcl-2、Bax和Beclin-1的相互结合和磷酸化,调节凋亡和自噬的各自主导优势,如在饥饿的环境下,Bcl-2发生磷酸化并与Beclin-1分离,在Beclin-1作用下细胞逐渐形成大量的自噬泡,对细胞和组织进行保护,并且通过磷酸化的Bcl-2与Bax结合来降低细胞的凋亡水平[10-11]。我们将大鼠的髓核细胞在无氨基酸的EBSS培养基中培养2 h,成功地诱导出自噬现象,另外用自噬特异性抑制剂3-MA处理饥饿细胞后成功地部分抑制了细胞的自噬,但是细胞的凋亡和抑制率反而增加了,而设立的3-MA+DMEM组并没有发现3-MA能诱导正常环境下的髓核细胞发生凋亡或对髓核细胞抑制作用,因此间接地证明了一定限度的细胞自噬可以抑制饥饿环境中髓核细胞的死亡,进而对髓核细胞进行保护。体内退变的髓核细胞亦处于营养缺乏的环境,并且也有研究证明了退变的髓核细胞中存在自噬现象[6],但是体内椎间盘的自噬现象是否与椎间盘的营养缺乏有关,细胞自噬对退变的椎间盘到底有什么样的作用?这些均需要进一步探索。
细胞凋亡已经被认为是参与椎间盘退变的重要因素之一,Ha等[12]通过体内研究发现,在退变的椎间盘髓核和终板中细胞凋亡率明显高于正常椎间盘,并且Sudo等[13]通过siRNA的方法抑制细胞凋亡可以缓解椎间盘退变。本研究间接地发现髓核细胞的自噬亦可以抑制饥饿诱导的细胞凋亡,虽然体外培养的细胞与体内的细胞具有较大差异性,但是本文为未来椎间盘的治疗和具体机制的阐述可以提供一定的基础。
在饥饿环境下,自噬通过降解细胞器和蛋白质为细胞提供能量、氨基酸,从而保护细胞应付周围环境。但是在一定条件下,过度的细胞自噬亦会导致细胞发生程序性死亡——自噬死亡[14],如Xue等[15]发现在神经生长因子撤退的情况下,自噬可能介导了神经元细胞的死亡。本文所使用的EBSS培养基是常规诱导细胞自噬的环境,将髓核细胞饥饿2h并未引起细胞大量的自噬死亡,因此这个诱导自噬的模型能够较为可靠地研究髓核细胞的自噬。但是细胞自噬是一把双刃剑,随着饥饿时间的延长,细胞自噬对髓核细胞的影响尚需要进一步的研究。
[1] Zhao CQ, Jiang LS, Dai LY. Programmed cell death in intervertebral disc degeneration[J]. Apoptosis, 2006, 11(12): 2079-2088.
[2] Shen C, Yan J, Jiang LS, et al. Autophagy in rat annulus fibrosus cells: evidence and possible implications[J]. Arthritis Res Ther, 2011, 13(4): R132.
[3] Biederbick A, Kern HF, Elsasser HP. Monodansylcadaverine (MDC) is a specificinvivomarker for autophagic vacuoles[J]. Eur J Cell Biol, 1995, 66(1): 3-14.
[4] Levine B, Kroemer G. Autophagy in the pathogenesis of disease[J]. Cell, 2008, 132(1): 27-42.
[5] Carames B, Taniguchi N, Otsuki S, et al. Autophagy is a protective mechanism in normal cartilage, and its aging-related loss is linked with cell death and osteoarthritis[J]. Arthritis Rheum, 2010, 62(3): 791-801.
[6] Ye W, Xu K, Huang D, et al. Age-related increases of macroautophagy and chaperone-mediated autophagy in Rat Nucleus Pulposus[J]. Connect Tissue Res, 2011, 52(6): 472-478.
[7] Kroemer G, Marino G, Levine B. Autophagy and the integrated stress response[J]. Mol Cell, 2010, 40(2): 280-293.
[8] Suzuki SW, Onodera J, Ohsumi Y. Starvation induced cell death in autophagy-defective yeast mutants is caused by mitochondria dysfunction[J]. PLoS One, 2011, 6(2): e17412.
[9] Loos B, Engelbrecht AM. Cell death: a dynamic response concept[J]. Autophagy, 2009, 5(5): 590-603.
[10]Giansanti V, Torriglia A, Scovassi AI. Conversation between apoptosis and autophagy: "Is it your turn or mine?"[J]. Apoptosis, 2011, 16(4): 321-333.
[11]Zhou F, Yang Y, Xing D. Bcl-2 and Bcl-xL play important roles in the crosstalk between autophagy and apoptosis[J]. FEBS J, 2011, 278(3): 403-413.
[12]Ha KY, Koh IJ, Kirpalani PA, et al. The expression of hypoxia inducible factor-1α and apoptosis in herniated discs[J]. Spine (Phila Pa 1976), 2006, 31(12): 1309-1313.
[13]Sudo H, Minami A. Caspase 3 as a therapeutic target for regulation of intervertebral disc degeneration in rabbits[J]. Arthritis Rheum, 2011, 63(6): 1648-1657.
[14]Gozuacik D, Kimchi A. Autophagy and cell death[J]. Curr Top Dev Biol, 2007, 78: 217-245.
[15]Xue L, Fletcher GC, Tolkovsky AM. Autophagy is activated by apoptotic signalling in sympathetic neurons: an alternative mechanism of death execution[J]. Mol Cell Neurosci, 1999, 14(3): 180-198.
Protectiveeffectofautophagyonnucleuspulposuscellsunderstarvation
JIANG Li-bo, ZHANG Xiao-lei, XU Hua-zi, WU Rui-kai, YANG Guang-yong, WU Wei, HU Xu-qi, ZHENG Xu-hao
(DepartmentofSpineSurgery,theSecondAffiliatedHospitalofWenzhouMedicalCollege,Wenzhou325000,China.E-mail:spinexu@163.com)
AIM: To explore the possibility that the starvation environment induces autophagy of nucleus pulposus cells.METHODSPrimary rat nucleus pulposus cells was cultured and stained with toluidine blue, Alcian blue and immunocytochemistry for typeⅡ collagen. The cultured cells were divided into 4 groups: control group, 3-methyladenine (3-MA)+DMEM group, 3-MA+EBSS group and EBSS group. The cells were detected for autophay using monodansylcadaverine (MDC) staining, electron microscopy and Western blotting. At the same time, the inhibitory rate and apoptotic rate of the cells were detected by Cell Counting Kit-8(CCK-8) assay and TUNEL staining, respectively.RESULTSCompared with control group, the autophagosomes were observed in nucleus pulposus cells under electron microscope and fluorescence microscope in EBSS group, and the 3-MA+EBSS treatment suppressed the formation of autophagosomes. The results of Western blotting analysis showed that the ratios of LC3-II/LC3- I and Beclin-1/β-actin in EBSS treatment group were higher than those in control group and 3-MA+EBSS treatment group. However, the apoptotic rate of nucleus pulposus cells and the inhibitory rate of cell viability were increased in 3-MA+EBSS treatment group.CONCLUSIONAutophagy of nucleus pulposus cells is induced by nutrient starvation, and 3-MA suppresses the response. Autophagy may have a protective effect on nucleus pulposus cells under the condition of starvation.
Nucleus pulposus cells; Autophagy; Apoptosis; Hunger
R329.25
A
10.3969/j.issn.1000-4718.2012.07.028
