祛湿除痹复方对急性痛风性关节炎模型大鼠关节症状的作用及其机制*
2012-11-06陈建雄
姚 红, 陈建雄, 童 娟
(广州医学院第一附属医院中医科,广东 广州 510120)
1000-4718(2012)07-1292-05
2012-05-08
2012-07-03
广东省自然科学基金资助项目(No.9451018201003652);广东省中医药局课题(No.2009253)
△通讯作者:Tel:020-83062043;E-mail:quen918@yahoo.com.cn
祛湿除痹复方对急性痛风性关节炎模型大鼠关节症状的作用及其机制*
姚 红, 陈建雄, 童 娟△
(广州医学院第一附属医院中医科,广东 广州 510120)
目的探讨祛湿除痹复方对大鼠急性痛风性关节炎的可能作用机制,验证急性痛风性关节炎的湿热痹阻病机。方法将40只Wistar大鼠随机分5组,每组8只,即空白组、模型组、秋水仙碱组、中药低剂量组和中药高剂量组。采用尿酸单钠晶体溶液踝关节注射法建立急性痛风性关节炎模型。以祛湿除痹复方与秋水仙碱对比治疗,观察祛湿除痹复方对大鼠关节各种症状(炎症、肿胀度及活动障碍)及大鼠关节组织内白细胞介素1β(IL-1β)、白细胞介素1受体(IL-1R)和髓样分化因子88(MyD88)表达水平的影响。结果灌胃给药7 d后秋水仙碱组和中药各剂量组与模型组比较,大鼠关节肿胀程度差异显著(P<0.01), 秋水仙碱组和中药高剂量组比较差异有统计学意义(P<0.05)。各组大鼠关节炎症指数及功能障碍指数积分比较,模型组积分最高。造模后8和72 h各组积分均降低(P<0.05),模型组与各用药组比较差异显著 (P<0.05)。关节软组织内IL-1β、IL-1R及MyD88的平均吸光度以模型组为最高,中药低剂量组和秋水仙碱组比较无明显差异(P>0.05),而与中药高剂量组比较有显著差异(P<0.05)。结论祛湿除痹复方能有效抑制实验性急性痛风性关节炎大鼠关节组织内炎症因子的表达,从而改善模型大鼠各种关节症状。
中草药; 关节炎,痛风性; 细胞因子类
痛风(gout)是由于嘌呤代谢紊乱导致血尿酸水平增高,尿酸盐结晶沉积于关节滑膜及其它组织中引起的一组代谢性疾病[1]。痛风性关节炎急性发作期,沉积在关节腔内的尿酸钠晶体刺激炎症细胞,释放炎症因子,其中白细胞介素1(interleukin-1,IL-1)、白细胞介素1受体(interleukin-1R,IL-1R)以及信号转导途径中的主要接头蛋白髓样分化因子88(myeloid differentiation factor 88,MyD88)在痛风的关节炎症反应过程中起着至关重要的作用。白细胞介素1β(interleukin-1β,IL-1β)是IL-1存在于关节滑膜内的主要形式,是引起关节破坏和诱导痛风性关节炎急性发作期关键的炎症因子[2-3]。中医认为,痛风性关节炎之急性期临床多见红肿热痛等湿热痹阻为特征的表现,采用祛湿除痹法治疗痛风疗效肯定且毒副作用很小。本实验通过观察祛湿除痹复方对痛风性关节炎大鼠关节症状的改善及关节软组织内IL-1β、IL-1R及MyD88表达的影响,探讨祛湿除痹复方对急性期痛风性关节炎关节症状的作用及机制。
材 料 和 方 法
1动物
Wistar大鼠40只,雄性,180~200 g(由南方医科大学实验动物中心提供,生产许可证号为SCXK粤2006-0015),饲养环境:广州医学院实验动物中心SPF级实验室(许可证号为4402100561)。
2主要试剂
尿酸单钠(monosodium urate,MSU;Sigma);大鼠免疫组化试剂盒(Abcam;包括抗IL-1β抗体,抗IL-1R抗体,抗MyD88抗体);DAB显色试剂盒(深圳杰特伟生物科技有限公司);动态浊度法鲎试剂(厦门市鲎试剂实验厂有限公司生产)。祛湿除痹复方(七叶莲、土茯苓和萆薢,由广州医学院第一附属医院中药房提供)。秋水仙碱(50 mg, 片剂,西双版纳药业有限公司生产)。
3主要方法
3.1MSU结晶及MSU溶液的制备[4]无菌条件下将 800 mg MSU和155 mL生理盐水混合,置于烧瓶中加热煮沸至MSU完全溶解,迅速小滴滴入1 mol/L HCl调整pH值至7.0±0.2,自然降温后于3 000 r/min离心,离心至晶体不再析出后,置于4 ℃冰箱保存备用,用前混悬于PBS缓冲液中配成所需浓度。采用鲎试剂动态浊度法检测内毒素,内毒素<0.0625Eu/mL (Eu为内毒素单位)。
3.2中药制备 七叶莲、土茯苓和萆薢按1∶1∶1比列放置在套式恒温器中,加入蒸馏水,水量为药材的10倍,武火煮沸后改文火煎煮2 h,滤出药液,药渣加入8倍水继续煎煮2 h,2次滤液合并,蒸馏悬蒸浓缩药液至2 kg/L,冰箱保存备用。
3.3动物分组及给药方法 大鼠随机分为5组,每组8只,即空白组、模型组、秋水仙碱组和中药低剂量组、中药高剂量组。根据药物剂量换算公式[5],中药低剂量组给予27 g·kg-1·d-1(相当于成人临床常规用量)中药;中药高剂量组给予54 g· kg-1·d-1(相当于临床用量的2倍) 中药;秋水仙碱组给予0.009 g·kg-1·d-1秋水仙碱;空白组及模型组予以蒸馏水10 mL·kg-1·d-1。造模后当天各组开始分别给予相应药物或蒸馏水,每天(早上9点)1次,连续灌胃7 d。
3.4大鼠急性痛风性关节炎模型的制备 参照改良后的Cdoerre造模方法[6]。适应性喂养大鼠3 d后开始造模。空白组不做任何处理,其余4组大鼠腹腔注射水合氯醛30 mg/kg麻醉,选受试大鼠左侧踝关节背侧,常规消毒后,用4.5号注射针与胫骨成45方向插入踝关节,将0.1 mL MSU溶液(50 g/L)注入到踝关节腔,形成大鼠关节局部红肿热胀并不同程度的跛行,即大鼠急性痛风性关节炎模型。第7 d灌胃后3 h处死大鼠取材。
3.5炎症指数及功能障碍指数测定 根据Coderre炎症指数及功能障碍指数分级评定标准[7],造模后8和72 h分别观察大鼠炎症指数及功能障碍指数。
3.5.1炎症指数分级标准 0:正常;1:关节皮肤红斑,轻度肿胀,骨性标志可见;2:关节明显红肿,骨性标志消失,但肿胀局限于关节部位;3:关节以外肢体肿胀。
3.5.2功能障碍指数分级标准 0:正常步态,双足均匀着地;1:足着地减轻,足趾未展开,轻度跛行;2:足屈起,趾背着地,明显跛行;3:足完全离地,呈3足行走步态。
3.6大鼠关节肿胀度(足跖容积的变化)测定[7]造模前3 d开始,用记号笔在大鼠左后肢踝关节周围作上记号并拉直,放入足跖容积测定仪内,使足标记与其刻度相平,测量每只鼠未注射MSU晶体溶液前左后足容积并记录。注射MSU晶体溶液后2 h再次测量大鼠左后足容积并记录,根据注射MSU前后大鼠左后足容积之差计算足跖肿胀度(mL)。注射MSU后2 h的测量值为造模后第1 d测量值。以后每天灌胃前测量大鼠关节肿胀度,连续测量7 d。
3.7关节软组织免疫组化法检测 石蜡切片常规脱蜡至水化,过氧化氢去内源性酶,胰酶消化暴露抗原,滴加Ⅰ抗4 ℃孵育过夜,依次滴加生物素标记Ⅱ抗、酶标记链霉卵白素过氧化物酶,DAB显色。光镜下(×400)观察,将呈现棕黄色的区域视为阳性目标,每张切片选3个胞浆内棕黄色着色最深、面积最大的视野区域,测量阳性着色面积及积分吸光度值。测量参数选择:(1)面积;(2)积分吸光度;(3)平均吸光度。图像分割选彩色HSV分割。经计算机摄像系统选择采样后,采用Image Pro-Plus 6.0图像处理分析软件对信号强度进行定量分析,得出阳性染色面积(area)及积分吸光度值(integral absorbance values,IA),以3个视野所得数据平均值代表样本的阳性结果。以测量照片上全部被选中的棕黄色的吸光度总和(IASum)与阳性面积(area)的比值作为平均吸光度(mean absorbance)值,即平均吸光度 = (IASum) / area。平均吸光度是没有单位的相对数值。
4统计学处理

结 果
1各组大鼠炎症指数及功能障碍指数积分比较
各组大鼠造模后炎症指数及功能障碍指数积分均有不同程度的升高,且模型组的积分在造模8 h、72 h均比其余用药组高,显著差异(P<0.05);造模后72 h与8 h相比较,各组大鼠炎症指数及功能障碍指数积分有下降趋势,差异显著(P<0.05),见表1。

表1 各组大鼠炎症指数积分及功能障碍指数积分比较
▲P<0.05vsmodel group;*P<0.05vs8 h.
2各组大鼠左足跖肿胀度的比较
造模后2 h(即第1 d)起直到第7 d,模型组、秋水仙碱组、中药低剂量组、中药高剂量组大鼠足肿胀度均比空白组高,差异显著(P<0.01),除空白组外,其余4组间足肿胀度比较无显著差异(P>0.05);造模后第7 d,各用药组与模型组比较,大鼠足肿胀程度均有所缓解(降低),差异显著(P<0.01),秋水仙碱组与中药低剂量组比较无显著差异(P>0.05),而中药高剂量组则比秋水仙碱组降低,显著差异(P<0.05),见表2。

表2 各组大鼠左足跖肿胀度的比较
△△P<0.01vsblank group;▲▲P<0.01vsmodel group;*P<0.05vsTCM high-dose group.
3各药物组对IL-1β、IL-1R和MyD88表达的影响
模型组、秋水仙碱组、中药各剂量组与空白组比较,IL-1β、IL-1R和MyD88平均吸光度均升高,差异显著(P<0.01)。而各药物治疗组IL-1β、IL-1R和MyD88平均吸光度均较模型组低,且差异有统计学意义(P<0.05)。秋水仙碱组、中药低剂量组与中药高剂量组比较,IL-1β、IL-1R和MyD88平均吸光度均显著升高,差异有统计学意义(P<0.05),而秋水仙碱组与中药低剂量组之间比较无显著差异(P>0.05),见图1~3和表3。

Figure 1. The IL-1β expression in joint and soft tissues of rats(immunohistochemical staining,×400).A:blank group;B:model group;C:colchicines group;D:TCM low-dose group;E:TCM high-dose group.
图1大鼠关节软组织IL-1β表达

Figure 2. The IL-1R expression in joint and soft tissues of rats (immunohistochemical staining,×400).A:blank group;B:model group;C:colchicines group;D:TCM low-dose group;E:TCM high-dose group.
图2大鼠关节软组织IL-1R表达
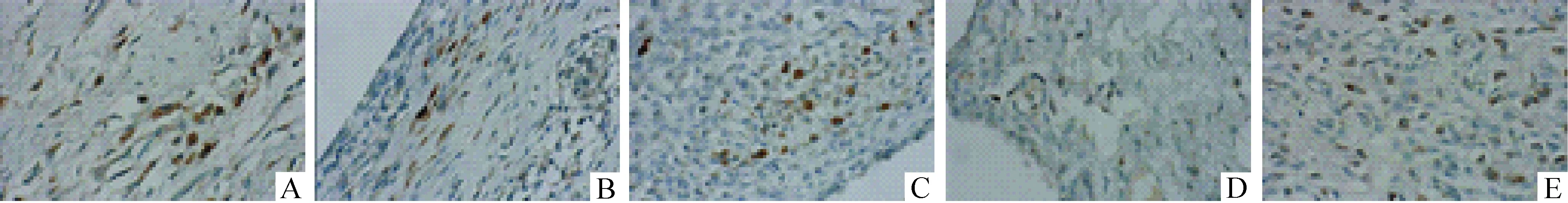
Figure 3. The MyD88 expression in joint and soft tissues of rats (immunohistochemical staining, ×400).A:blank group;B:model group;C:colchicines group;D:TCM low-dose group;E:TCM high-dose group.
图3大鼠关节软组织MyD88表达

表3 各组大鼠IL-1β、IL-1R和MyD88表达的比较
△△P<0.01vsblank group;▲P<0.05vsmodel group;*P<0.05vsTCM high-dose group.
4大鼠足肿胀度与关节内炎症因子相关性分析
大鼠足肿胀度与关节内IL-1表达的相关系数为r=0.706,大鼠足肿胀度与关节内IL-1R表达水平之间的相关系数为r=0.720,均P<0.01,呈正相关性。
讨 论
本实验运用已公认的大鼠踝关节内注入MSU晶体溶液制备急性痛风性关节炎模型的方法,造模后大鼠关节出现红、肿、热和功能障碍等表现, 其病理表现与临床急性痛风性关节炎极为相似,充分地模拟了人类急性痛风性关节炎的发作过程。实验结果表明,造模后8和72 h,秋水仙碱组、中药低剂量组及高剂量组的关节炎症指数和功能障碍指数与模型组比较,积分均降低并有显著性差异,3个用药组之间无明显差异。在灌胃第7 d,模型组大鼠关节肿胀度最高,与秋水仙碱组、中药各剂量组比较有显著差异,说明药物对关节肿胀起到了抑制作用,中药低剂量组与秋水仙碱组之间无显著差异,而中药高剂量组的肿胀度低于秋水仙碱组,说明中药高剂量组具有更强的关节消肿作用,其治疗后关节消肿效果更接近空白组。实验结果提示,中药各组和秋水仙碱均能缓解急性痛风性关节炎大鼠的关节肿胀等症状。
在痛风性关节炎急性发作期,炎症细胞异常活跃。沉积于关节内的尿酸结晶,被多形核白细胞和关节囊滑膜内层细胞吞噬, 吞噬尿酸盐的白细胞迅速脱颗粒、分解,激活炎性复活体,释放炎症趋化因子,使白细胞介素类细胞因子活化,募集更多的白细胞聚集,进行趋化运动,引起免疫级联反应,导致关节组织炎症和破坏性病变[8]。由细胞因子介导的炎症是痛风性关节炎的核心所在。IL-1是人类主要的致炎细胞因子,它通过IL-1转换酶分泌到细胞膜的外面发挥致炎作用,在痛风性关节炎的发展过程中起重要作用[9-10]。IL-1主要分为IL-1α和IL-1β,在血液中IL-1α和IL-1β同时存在,在关节中主要以IL-1β为主。IL-1的作用主要通过TLR/MyD88信号通路产生。Toll样受体(Toll-like receptors,TLRs)可激活细胞内的信号转导通路触发免疫系统。MyD88是负责承接TLR 活化信号的主要接头蛋白[11]。由此推测,若能在痛风性关节炎急性发作期阻断IL-1R的表达可减少IL-1R相关激酶(IL-1 receptor-associated kinase, IRAK-1)产生、降低MyD88的结合率使血清内和关节组织内的炎症因子含量减少,从而达到缓解炎症的作用。在5组关节组织内IL-1β、IL-1R和MyD88平均吸光度值的结果显示:空白组最低,与其余4组比较均有统计学意义;模型组高于各用药组并具有统计学意义。中药高剂量组低于秋水仙碱组和中药低剂量组,与此两组比较有统计学意义。说明各用药组均可抑制TLR/MyD88信号通路,减少炎症因子的产生及活化。其作用随中药剂量的增加而增强。我们发现造模7 d后各组大鼠足肿胀度与关节内炎症因子的表达水平呈现正相关,提示炎症因子表达水平的变化直接影响模型大鼠关节肿胀等症状的改善。
综上所述,祛湿除痹复方可能通过阻断TLR/MyD88信号通路,减少炎症因子的产生,从而改善急性痛风性关节炎关节肿胀等症状,可以认为该复方在痛风性关节炎急性期的治疗是以抗炎治疗为主。但单味药及其活性成分的抗痛风性炎症的作用及其机制有待深入研究。
[1] Pascual E, Pedraz T. Gout [J]. Curr Opin Rheumatol,2004,16(3):282-286.
[2] O’Neill LA. The interleukin-1 receptor/Toll-like receptor superfamily: 10 years of progress[J].Immunol Rev,2008,226:10-18.
[3] 刘 挺, 刘元禄, 高 岱, 等.痛风定胶囊对实验性骨膜组织IL-8和TNF-α影响的研究[J]. 中国中医骨伤科杂志,2005, 13(1):24-26.
[4] 黄火高, 孙运峰, 胡 明,等. 大鼠急性痛风性关节炎模型的建立及特点[J]. 军事医学科学院院刊, 2005,29(6):538-542.
[5] 赵 伟,孙国志.不同种实验动物间用药量换算[J].畜牧兽医科技信息,2010,(5):52-53.
[6] 姚 丽,刘树民,于书仪.痛风性关节炎动物模型的改良[J]. 中国实验动物学报,2009,17(3):210-212.
[7] 刘晓玲,刘 琼, 陈光星,等.通痹合剂对佐剂性关节炎模型大鼠软骨保护作用的机制研究[J]. 广州中医药大学学报, 2010,27(3):246-249,318.
[8] Renner P,Roger T,Calandra T,et al. Macrophage migration inhibitory factor gene polymorphisms and susceptibility to inflammatory diseases[J].Clin Infect Dis,2005,41(Suppl 7):S513-S519.
[9] Palmer G,Guerne PA ,Mezin F, et al. Production of interleukin- 1 receptor antagonist by human articular chondro-cytes[ J]. Arthritis Res, 2002, 4(8): 226-231.
[10]嵇 波,刘清国,符永鋆,等. 针刀松解法、电针对膝关节骨关节炎兔IL-1β、IL-6、TNF-α含量影响的比较[J].中国病理生理杂志, 2009, 25(6):1165-1169.
[11]Fernandes JC,Martel-Pelletier J, Pelletier JP. The role of cytokines in osteoarthritis pathophysiology[J]. Biorheology, 2002, 39(1-2): 237-246.
Anti-arthralgiceffectsofQushi-Chubicompoundprescriptiononacutegoutyarthritisinrats
YAO Hong, CHEN Jian-xiong, TONG Juan
(DepartmentofChineseTraditionalMedicine,theFirstAffiliatedHospitalofGuangzhouMedicalUniversity,Guangzhou510120,China.E-mail:quen918@yahoo.com.cn)
AIM: To investigate the role of arthralgia due to dampness in the pathogenesis of acute gouty arthritis and to observe the anti-arthralgic effects of Qushi-Chubi compound prescription of traditional Chinese medicines (TCM) on gouty arthritis in a rat model.METHODSForty SPF Wistar rats were randomly divided into 5 groups: blank group, model group, colchicine group, TCM low-dose group and TCM high-dose group. Monosodium urate crystals were injected into the rat ankle to induce acute gouty arthritis. The decoction of Qushi-Chubi compound prescription was given intragastrically for 7 days. Colchicine was used as a positive model drug in the model rats. The expression levels of interleukin-1β (IL-1β), interleukin-1 receptor (IL-1R) and myeloid differentiation factor 88 (MyD88) in the joint tissues were observed.RESULTSSeven days after intragastrical administration, the degrees of joint swelling in colchicine group and TCM treatment groups were significantly lower than that in model group (P<0.01), and that in TCM high-dose group was even lower than that in colchicine group with statistical significance. The index of inflammatory responses and joint dysfunction in model group was the highest and was higher than those in colchicine group and TCM treatment groups. The serum levels of IL-1β and IL-1R in TCM high-dose group were significantly lower than those in model group and colchicine group (P<0.05).CONCLUSIONThe Qushi-Chubi compound prescription effectively inhibits the expression of inflammatory cytokines in rats with acute gouty arthritis, and also attenuates the inflammatory responses of the arthralgia joints.
Drugs, Chinese herbal; Arthritis, gouty; Cytokines
R285.6
A
10.3969/j.issn.1000-4718.2012.07.026
