胃癌患者辅助化疗后的生活质量及相关影响因素
2012-11-06林铁素潘钰婷胡孙宽
林铁素 潘钰婷 胡孙宽 周 琴 金 嵘
随着现代生物-心理-社会医学模式的提出,以及人们对疾病诊治需求和生活质量要求的不断提高,越来越多的研究者开始关注癌症患者和慢性病患者的生活质量(quality of life,QOL)。有报道指出,QOL是癌症治疗临床试验的一个重要终点,QOL评估对于接受术后辅助治疗的患者也很重要[1]。目前QOL评定已广泛用于心脑血管疾病、糖尿病及其他慢性病干预的疗效评价,多种恶性肿瘤的治疗研究,新药临床试验评价以及预防保健措施的效果评价等多个领域[2]。我国是胃癌高发国家,胃癌的发病率和病死率居国内恶性肿瘤首位。胃癌患者在生理和心理上都受到肿瘤带来的严重影响。我们注重患者治疗疗效提高的同时,还要从患者的主观感受考虑,提高患者的QOL。
资料与方法
1.调查对象:选取2007年9月~2009年10月在温州医学院附属第一医院收治的胃癌患者64例。所有病例均为胃癌术后病人,并经影像学检查证实体内未测到影像学可见肿瘤病灶。化疗前患者血常规、肝肾功能均正常,心电图无明显异常功能状况。所有病例胃癌术后均接受以氟尿嘧啶和铂类为基础的辅助化疗至少3个治疗周期。该研究所涉及的各项处理均取得病人及家属的知情同意。
2.研究方法:(1)患者一般资料:包括性别、年龄、文化程度、工作情况、婚姻状况、居住情况、收入情况、医疗支付方式、与人交流及参加集体活动情况、是否吸烟喝酒、病理类型、KPS评分及TNM分期等。(2)生活质量调查表:调查问卷采用欧洲癌症研究与治疗组织的生活质量核心量表[EORTC QLQC30(V 3.0中文版)]。该量表共有30个条目,可分为15个领域,包括5个功能领域(躯体、角色、认知、情绪和社会功能)、3个症状领域(疲劳、疼痛、恶心呕吐)、1个总体健康状况/生活质量领域和6个单一条目(每个作为一个领域),对各项的每一答案赋予一定的分值,将各个领域所得的粗分,再经极差化线性变换转化为0~100取值的标准化得分。5个功能领域和1个总体健康状况/生活质量总评分得分越高说明功能状况和QOL越好,对于症状领域和单一条目得分越高表明症状或问题越多,QOL越差[3]。(3)评定方法:在入院后由病人填写一般资料调查表,向病人说明调查目的及相关填写方法后进行基线QOL测评,并当场回收。根据患者病情及手术情况选择不同辅助化疗方案并分为FOLFOX-4组和XELOX组,方案一直持续至少3个疗程直至疾病进展、不可预料的不良反应或者病人拒绝治疗,并于化疗方案实施后3、6和12个月分别随访1次,完成相应生活质量调查表和KPS量表。具体化疗方案如下:1)FOLFOX-4方案:L-OHP(注射用奥沙利铂,江苏恒瑞医药公司)85mg/m2加入5%葡萄糖250m l中静脉滴注2h,第1天;CF(注射用亚叶酸钙,江苏恒瑞医药公司)200mg/m2加入生理盐水250m l中静脉滴注2h,第1、2天;5-FU(注射用5-FU啶,天津金耀氨基酸有限公司)400mg/m2静脉推注后,续以5-FU 600mg/m2微量泵入22h,第1、2天;每2周重复1次为1个周期。2)XELOX方案:L-OHP 130mg/m2加入5%葡萄糖溶液中静脉滴注2h,第1天,Xeloda(口服用5-FU类复合物,上海罗氏制药有限公司)1000mg/m2,每日2次,饭后半小时口服,服1周,休1周,每3周重复。
3.统计学方法:本研究采用SPSS 13.0统计软件对调查数据进行统计分析。采用t检验对患者基线生活质量总得分进行比较;应用重复测量方差分析,比较两组内及两组间4个时间点生活质量随时间变化的规律;按0.05纳入标准,0.10排除标准,应用Logistic满足条件逐步回归分析辅助化疗及其他因素对胃癌患者QOL的影响,P<0.05为差异有统计学意义。
结 果
1.一般情况:纳入统计的胃癌患者共64例,年龄33~76岁,平均年龄60.2±11.5岁,其中男性45例(70.3%),女性 19 例(29.7%),淋巴转移 38 例,脏器转移8例,全胃切除23例,胃次全切除41例,合并器官切除58例,平均住院时间11.7±4.8天,随访1年,平均生存时间为23.5±6.5周。
2.QLQ-C30量表比较:FOLFOX-4组生命质量总体得分为66.1 ±31.4 分,XELOX 组为60.8±22.3分,经成组t检验,表明两组患者的基线生活质量总体得分差异无统计学意义,具有可比性(t=0.751,P=0.456)。化疗前后4个时间点的各领域得分情况见表1。经重复测量设计的方差分析(α=0.05)、Huynh-Feldtt系数对自由度进行校正,表明随着辅助化疗方案实施时间的推移,胃癌患者的生活质量有所提高(F=13.421,P <0.001,图1),情绪功能、社会功能显著改善(分别为 F=7.740,P=0.002 和F=4.553,P=0.019),疲倦症状、经济困难有所缓解(分别为 F=8.484,P=0.002 及 F=4.836,P=0.013),但不同化疗方案间的生活质量无明显差异(P>0.05)。
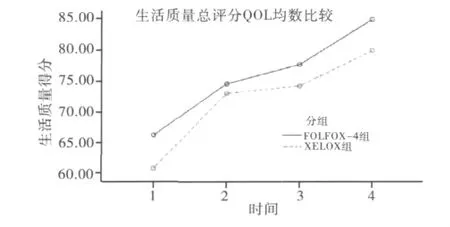
图1 两组生活质量总评分QOL均数比较
3.生活质量影响因素分析:在QLQ-C30中的生活质量总评分第50个百分位点截取,分为QOL好和差,分别赋值为0和1,以此为应变量,以单因素分析P<0.10的14个因素为自变量,包括年龄、文化、收入、工作情况、参加集体活动、KPS评分、浸润深度、淋巴转移、脏器转移、肿瘤大体分型、病理类型、TNM分期、手术方式及合并器官切除,满足条件逐步前进法Logistic回归,结果进入主效应模型的自变量是:淋巴转移、合并器官切除、KPS评分、手术范围及工作情况(表2)。
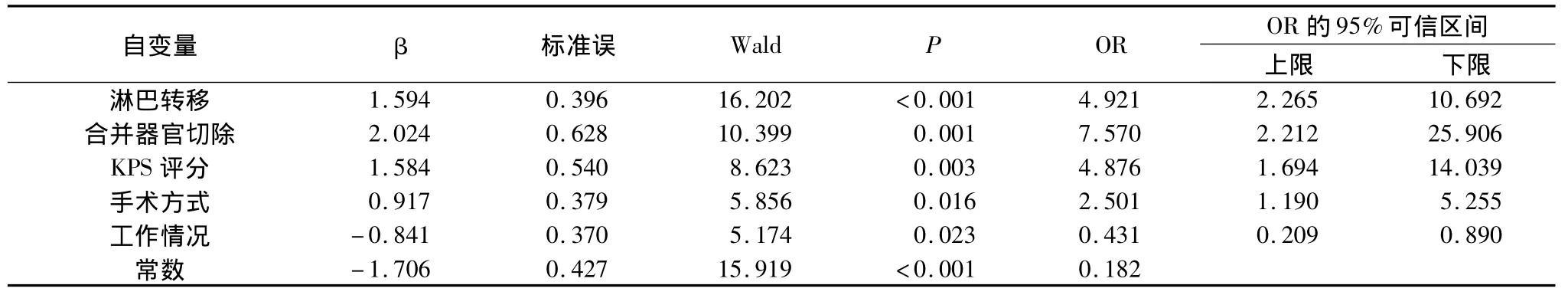
表2 影响胃癌术后辅助化疗患者QOL的多因素Logistic回归分析结果
讨 论
QOL是个体在不同的文化背景和价值体系下,与个体目标、期望、标准及所关心的事物有关的生存状况体验,受人际关系、社会结构、心理状况等多种因素影响[4]。本研究采用的EORTC QLQ-C30核心量表能反映出QOL的多维结构,经过在欧洲的临床论证,具有良好的信度、效度、灵敏度,具有良好的心理学特性,可用于中国癌症病人的生活质量测定[3,5~7]。本研究表明,淋巴转移、合并器官切除、KPS评分较差(≤60)及全胃切除是患者生活质量差的独立危险因素,而无工作的胃癌患者的生活质量偏向较差的概率是有工作患者的2.32倍(即1/0.431),可能原因是在职患者比无工作患者的社会存在感强,社会心理状况较后者好,生活质量自评也较后者要好。
1.手术方式:本研究显示,全胃切除患者的生活质量偏向较差的可能性是远端胃大部切除患者的2.501倍,全胃切除对患者的生理功能和生活质量影响很大,与其他研究结果一致[8,9]。全胃切除破坏了正常的胃肠道结构及其神经支配,使原有生理功能受到损害,内因子缺乏,营养吸收障碍,术后胃肠功能紊乱,发生腹痛、饱胀、恶心呕吐、腹泻、倾倒综合征等,严重影响患者的 QOL[10,11]。可见,手术切除范围越小,胃肠功能破坏越小,患者QOL越高。因而在保证根治的前提下,应尽可能保留胃组织。
2.合并脏器切除:本研究表明,合并脏器切除患者的生活质量偏向较差的可能性是无合并脏器切除患者的7.570倍。说明合并脏器切除患者的生理、心理和社会功能等方面的恢复明显低于未合并脏器切除者,与相关报道相同[12]。但是如果确有周围器官组织浸润而没有联合脏器切除,会失去最佳治疗时机而影响生存时间。因此,术中是否合并脏器切除应慎重。
3.肿瘤本身的影响:单因素Logistic分析显示浸润深度、淋巴转移、脏器转移、肿瘤大体分型、病理类型、TNM分期对胃癌患者的生活质量有一定影响,结合多因素分析显示淋巴转移患者的QOL偏向差的概率是无淋巴转移患者的4.921倍。说明肿瘤的恶性程度越高,患者在生理、心理上遭受疾病的损耗越大,日后QOL就越差,这也是癌症三级预防的原因所在。
4.KPS评分:KPS量表,即Karnofsky(1948年)的行为表现量表(karnofsky performance status,KPS),由医务人员根据病情变化对癌症病人的身体功能状况进行测评。该量表评分虽不包括病人的主观感受,但有较好的重复性、评定者信度和结构性效度。本研究表明,KPS评分较差(KPS≤60)的患者的QOL偏向差的概率是KPS评分较好(KPS>60)者的4.876倍,且KPS评分与生活质量总评分具有相关性(Pearon相关系数为0.368,P <0.001)。Simes等和 Morita等也提出应包含辅助性QOL信息,如医生评估的健康状况在内。可见KPS评分对患者QOL自评有一定参考价值,在评估患者QOL时可综合考虑KPS评分与患者的生活质量自测量表。
有研究指出,胃癌术后采用辅助化疗可提高治愈率,降低复发风险。但目前关于化疗对胃癌患者QOL的影响尚无定论。氟尿嘧啶类及铂类药物是目前化疗的主要药物,其中以5-FU、奥沙利铂最为常用。故本研究采用XELOX及FOLFOX-4辅助化疗方案探讨辅助化疗对胃癌患者QOL的影响。本研究中两化疗方案间QOL无明显差异,而随着联合化疗方案实施时间的推移,胃癌患者的生活质量、情绪功能、社会功能均有所改善,疲倦症状、经济困难有所缓解,与Conroy、Park及Bouché等的研究结果基本一致。然而Kassam等的研究指出,胃癌患者QOL在辅助放化疗之时和之后后一段时间明显降低,此后再逐渐恢复至基线水平。不排除本研究中患者QOL在化疗进行时曾一度下降,但随着化疗方案实施时间的推移,患者对化疗的耐受性的提高,生活及社会功能逐渐恢复,化疗后3个月及之后的随访时间里QOL表现为较基线水平有所提高。也有文献指出在化疗后6~12个月患者QOL仍在基线水平之下,这可能与化疗的剂量有关。同时,这也正说明了化疗的两面性,既有抗肿瘤作用使胃癌患者QOL提高,又同时伴有明显的不良反应使QOL下降。因而在选取化疗方案及化疗药物剂量时,如何在提高化疗抗肿瘤作用的同时,又尽量减少化疗相关的毒性不良反应,提高患者的QOL,是每个临床医师应当反复斟酌、权衡利弊的。以客观疗效为主,主观疗效为辅,从患者的主观感受出发,将QOL评估和各项临床指标相结合是评价治疗疗效的有效终点之一。
1 Morita S,Kaptein A,Tsuburaya A,et al.Assessmentand data analysis of health-related quality of life in clinical trials for gastric cancer treatments[J].Gastric Cancer,2006,9(4):254 -261
2 王吉耀.循证医学与临床实践[M].北京:科学出版社,2006:211-227
3 万崇华,陈明清,张灿珍,等.癌症患者生命质量测定量表EORTCQLQ-C30中文版评介[J].实用肿瘤杂志,2005,20(4):353-355
4 WHO.The development of the WHO Quality-of-Life Assessment Instrument[R].Geneva:WHO,1993
5 Scott NW,Fayers PM,Bottom ley A,et al.Comparing translations of the EORTC QLQ-C30 using differential item functioning analyses[J].Quality of Life Research,2006,15(6):1103 -1115
6 Fayers P,Bottomley A.Quality of life research within the EORTC QLQ -C30[J].Eur JCancer,2002,38(4):125 -133
7 Morten P,Mogens G,Neil A,et al.Multidimensional computerized adaptive testing of the EORTC QLQ-C30:Basic developments and evaluations[J].Quality of Life Research,2006,15(3):315 -329
8 Zhang H,Sun Z,Xu HM,et al.Improved quality of life in patients with gastric cancer after esophagogastrostomy reconstruction [J].World JGastroenterol,2009,15(25):3183 -3190
9 Sun Y,Yang Y.Study for the quality of life following total gastrectomy of gastric carcinoma[J].Hepatogastroenterology,2011,58(106):669-673
10 张延亮,牟洁,孙栋,等.胃癌根治术后患者近期生活质量的研究[J].中国现代普通外科进展,2009,12(10):861 -865
11 李文英,曹淑红,张晓峰,等.胃癌术后患者生活质量研究[J].现代预防医学,2011,8(21):4441-4446
12 刘统成,詹文华,汪建平,等.胃癌根治术后患者生活质量的研究[J].中华胃肠外科杂志,2002,5(1):20-23
