慢性牙周炎龈组织中Smac和Bax的表达及其对细胞凋亡的作用
2012-11-05董跟喜孙晓玮
冯 利,董跟喜,孙晓玮
(甘肃兰州730000:1.兰州大学基础医学院;2.兰州大学口腔医学院)
线粒体(mitochondria,Mi)作为凋亡的中心环节,已在许多凋亡系统中被证实。Smac(second mitochondria-derived activator of Caspase Smac)是一种由线粒体释放的凋亡相关蛋白,Smac表达可增加细胞对凋亡刺激的敏感性。当Mi接受凋亡信号后,Smac蛋白的Mi定位信号肽被切除,形成有活性的Smac蛋白释放到细胞质中,可与所有凋亡抑制蛋白IAPs结合,使其丧失抑制Caspase活性的作用,从而促进凋亡[1]。Bax为促凋亡蛋白并具有多功能,主要定位于细胞质,一旦细胞受到凋亡因子的诱导后,便会从胞质移位而伸入到Mi膜中,通过寡聚化在 Mi外膜形成 Bax通道[2],促进Cyt-C、Smac/Diablo、AIF 等释放并进入胞质,使 bcl-2与Apaf-1分离,后者可激活 Caspase,从而诱导细胞凋亡[3-4]。Smac、Bax 蛋白是细胞凋亡过程中的重要诱导基因,本文旨在探讨Smac、Bax在慢性牙周炎(Chronic Periodontitis,CP)龈组织的表达及其分布的意义。
1 材料和方法
1.1 病例筛选和样本采集
27例CP标本来自兰州大学口腔医学院门诊病人因患牙不能保留的龈组织,其中男14例,女13例,年龄39~57岁。口内每个区有2个以上的牙牙周附着丧失≥4 mm,牙周袋﹥5 mm,X线片显示牙槽骨吸收超过根长的1/2,牙松动。另外再从门诊病人中选择牙周健康,所有牙附着丧失≤2 mm,因阻生或错位而拔除牙的牙龈组织作为正常对照组,共27例,男12例,女15例,年龄37~55岁。所有病例均无全身性疾病,就诊前3个月内未服用抗生素和半年内未做过牙周系统治疗。在病人知情同意下拔除牙齿,CP组和健康组各12例取4 mm×4 mm×4 mm牙龈组织分成3份,40 g/L多聚甲醛固定,分别用作HE染色(核实病理诊断)和免疫组化染色;另取2组各12例标本用25 mL/L戊二醛前固定,用作电镜超薄切片处理;剩余2组各3例用于流式细胞仪检测。
1.2 主要试剂
Smac-Diablo测定试剂盒(北京奥博森生物技术有限公司);Bax测定试剂盒(即用型)、SP-9000试剂盒(即用型)、DAB显色剂(北京中衫金桥生物技术有限公司);罗丹明 123(RH123,Sigma)。
1.3 方法
1.3.1 HE 染色观察
牙龈组织常规石蜡包埋,制作4 μm切片,HE染色,光镜观察。
1.3.2 免疫组织化学检测Smac、Bax蛋白的表达
组织切片脱蜡水化,微波修复,蒸馏水洗,30 mL/L过氧化氢液中和内源性过氧化氢酶,PBS漂洗,滴加一抗(兔抗小鼠Smac、Bax)4℃过夜,PBS洗涤,再加生物素化二抗,37℃ 20 min,PBS洗涤,滴加SABC 37℃ 20 min,DAB显色,苏木素复染,盐酸乙醇分化,脱水、透明,封片,镜检。以PBS代替一抗做阴性对照。
1.3.3 牙龈组织超微结构观察
固定的牙龈组织用1/15 M PBS冲洗,10 g/L过氧化锇液后固定,PBS漂洗,梯度乙醇脱水,浸透,EPON812包埋,热聚合,制作超薄切片,枸橼酸铅和醋酸铀染色,透射电镜观察。
1.3.4 流式细胞仪检测线粒体膜电位
将新鲜牙龈组织剪碎,2.5 g/L胰蛋白酶消化(37℃),PBS终止消化,200目和400目铜筛网分别过滤,离心,收集细胞,PBS洗涤,加入终浓度为15 μg/mL 的Rh123,37℃避光孵育30 min,PBS洗涤2次,加500 μL PBS,上机检测线粒体膜电位(△Ψm)荧光强度变化。
1.4 统计学分析
采用SPSS 17.0统计软件进行统计分析,组间比较采用t检验,并对Smac、Bax两者之间的相互关系进行linear regression分析,P<0.05为差异有统计学意义。
2 结果
2.1 牙龈组织HE染色观察
牙周炎龈组织中上皮钉突呈网状突起伸入结缔组织中,并可见凋亡的上皮细胞(图1);结缔组织水肿,有大量炎性细胞浸润,其中有凋亡细胞,表现为细胞核呈蓝黑色,核染色质致密浓缩,核碎裂等,胞浆呈淡红色,并分散于组织中(图2)。胶原纤维排列紊乱,部分纤维发生断裂。而健康牙龈组织上皮钉突较长,伸入结缔组织中,炎性细胞较少,未见凋亡细胞。
2.2 牙龈组织超微结构观察
CP龈上皮细胞、结缔组织中的浆细胞、巨噬细胞和成纤维细胞有凋亡发生,胶原原纤维破坏。上皮基底凋亡细胞核固缩,核膜部分突起,线粒体有形态结构改变,粗面内质网(RER)呈空泡;凋亡的浆细胞有核染色质凝集、核周间隙宽窄不等、线粒体肿胀,空泡变等一些非特异性改变,细胞质中可见多泡体和自噬体(图3)。凋亡的成纤维细胞核固缩,凝集成块,聚集在核膜周边,RER变性,形成空泡,并有RER腔扩张,壁向腔内呈乳突状增生,形成腔内隔离;Mi内外膜融合,嵴减少且紊乱(图4)。凋亡的巨噬细胞可见核膜突出,染色质凝集,Mi肿大,溶酶体增多等特异形态。健康龈上皮细胞、结缔组织细胞的形态和结构未见凋亡现象。
2.3 牙龈组织细胞线粒体膜电位(△Ψm)
CP组织细胞△Ψm平均荧光强度(MFI=11.6±0.82),明显低于正常组织细胞△Ψm(MFI=14.5 ±0.98),差异有统计学意义(P <0.05)。
2.4 免疫组化检测Smac、Bax蛋白的表达
Smac、Bax蛋白的表达以细胞核不着色,胞质被染成棕黄色或浅黄色者为阳性细胞。每张切片在高倍镜下随机选择5个视野进行图像分析(BI-2000图像分析系统)。结果显示:正常龈组织和CP龈组织均有Smac、Bax阳性表达。在CP组织中Smac、Bax阳性表达主要位于上皮的棘细胞层和基底细胞层,炎性结缔组织中可见浆细胞、巨噬细胞和成纤维细胞有阳性表达,淋巴细胞未见阳性表达(图5~8)。CP龈组织中Smac、Bax在上皮组织、结缔组织的表达增加,与正常龈组织相比差异均有显著意义(P<0.05)(表1)。
2.5 Smac、Bax蛋白表达的相关性分析
根据平均光密度采用linear regression分析,以Bax为自变量X,Smac为应变量Y,根据散点图的形式,经统计学处理对正常龈组织、CP龈组织的Bax、Smac指标建立linear regression模型。结果表明,在 CP组中两者的表达具有正相关性(P <0.05)(表2)。
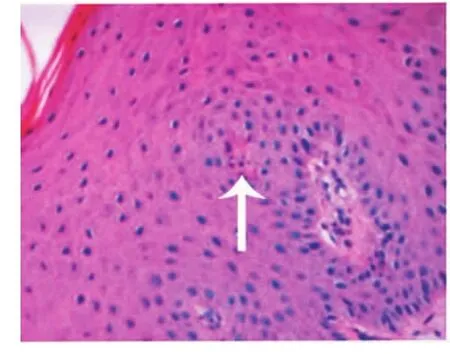
图1 牙周炎上皮组织区凋亡的细胞(箭头示)(HE,400×)

图2 牙周炎结缔组织区凋亡的细胞(箭头示)(HE,400×)
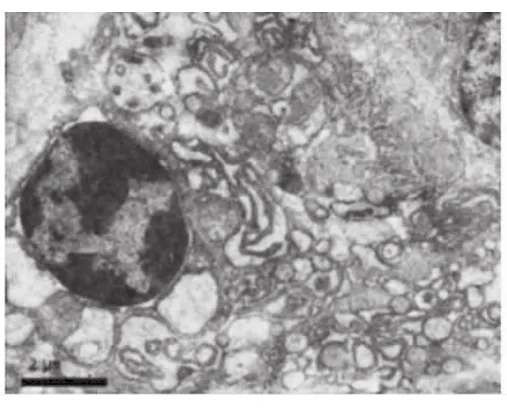
图3 凋亡的浆细胞 染色质凝集,RER形成空泡,Mi肿胀,细胞质中可见自噬体及多泡体(8000×)
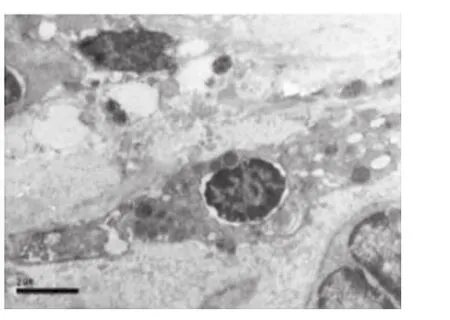
图4 凋亡的成纤维细胞 染色质固缩,RER变性,Mi内、外膜融合,嵴减少且紊乱(10000×)

图5 Smac在正常牙龈组织中的表达(DAB,400×)
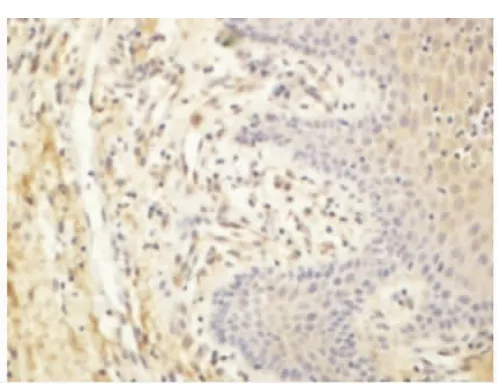
图6 Smac在CP牙龈组织中的表达(DAB,400×)

图7 Bax在正常牙龈组织中的表达(DAB,400×)

图8 Bax在CP牙龈组织中的表达(DAB,400×)
表1 牙周组织中各测试区Smac、Bax蛋白表达的平均光密度比较(n=12,)

表1 牙周组织中各测试区Smac、Bax蛋白表达的平均光密度比较(n=12,)
组织Smac健康组 CP组 P值Bax健康组 CP组 P值上皮组织 0.210 ±0.050 0.263 ±0.057 0.025 0.216 ±0.068 0.266 ±0.044 0.044结缔组织 0.383 ±0.103 0.493 ±0.114 0.021 0.375 ±0.077 0.417 ±0.114 0.019

表2 牙周组织中各测试区Bax、Smac蛋白表达的平均光密度regression分析
3 讨论
CP是菌斑微生物与宿主免疫反应相互作用所致的牙周组织破坏的炎症性疾病,临床观察及动物实验研究发现:牙周组织的细胞凋亡与牙周组织的炎症反应和破坏程度呈正相关,凋亡细胞多见于炎症细胞浸润部位,即表浅的结合上皮和其下的结缔组织[5-6],据此,本研究在光镜下选定测试区,以便观察牙周组织表达Smac、Bax的全貌,了解病理变化的程度。
Mi形态改变与其功能改变和细胞活力降低密切相关。①细胞凋亡早期出现△Ψm降低,这种变化早于细胞凋亡的其他特征性变化,如核DNA片段出现,所以△Ψm的正常与否可作为凋亡的特征性标志,而△Ψm的改变亦与Mi通透性变化相关;②Mi内外膜通透性的变化:△Ψm的降低提示Bax与ANT或VDAC相互作用促使MPTP(Mi permea bility transition pore,MPTP)开放,形成 Bax 通道,但当细胞凋亡时,MPTP能将Bax集中到自身周围,使通道持续开放,跨内膜梯度消失,使呼吸链解耦联,引起基质高渗腔加大,Mi空泡化,Bax与BaK在外膜形成聚集灶,引起Cyt-C、Smac等促凋亡因子的释放,进而引起细胞凋亡[7]。本结果显示:牙周炎组的△Ψm明显低于健康组,而且电镜观察可见凋亡细胞的Mi管状结构破坏,区室化消失,也表明Mi的功能变化(图3~4)。
本研究免疫组化法检测结果显示:无论是横向或纵向分析,CP组Smac、Bax阳性表达在上皮组织、结缔组织均明显高于健康对照组,差异有显著统计学意义(P﹤0.05),提示在损伤组织表达明显。CP组织中Smac与Bax的表达呈显著正相关性(P﹤0.05)。说明Smac、Bax二者在线粒体内源性凋亡途径中发挥促凋亡的重要作用。但R2值比较低,可能由于样本量少和其他因素的影响,今后有待进一步探讨。
根据慢性牙周炎龈组织的光镜和电镜观察所见,上皮组织中凋亡细胞多位于基底层和棘细胞层,致使基底细胞不能进行正常分化,引起上皮细胞的凋亡,结果造成牙周组织的损伤。结缔组织中浆细胞的凋亡,降低宿主局部体液免疫功能,从而促进牙周炎的发展。巨噬细胞根据其凋亡特异形态学变化,具有发挥完成吞噬凋亡细胞的利他作用,也通过凋亡发挥生理作用[8]。本研究认为激活巨噬细胞的凋亡,是机体限制巨噬细胞的有害炎症介质对局部组织损伤的一种方式。成纤维细胞的凋亡,胶原纤维松散且断裂无序,造成牙周膜的破坏,影响基质形成细胞增殖、分化降低细胞的活性,其临床意义在于引起牙周组织的丧失,牙周袋的形成,促进牙周组织病变的发展。
[1]Chai J,Du C,Wu J,et al.Structeral and biochemical basis of apoptotic activation by SMAC/DIABLO[J].Nature,2000,406(6798):855-862.
[2]Shoshan Barmatz V,Kein N,Abu-Hamad S,et al.Apoptosis is regulatedby the VDAC N-terminal region and by VDAC oligomerization:release of cytochrome C AIF and Smac/Diablo[J].Biochim Biophys Acta,2010,1797:1281 -1291.
[3]Li P,Nijhawan D,Budihardjo J,et al.Cytochroma and dATP-dependent formation of Apaf-1/Caspase-9 complex initiates an apoptotic protease cascade[J].Cell,1997,91(4):479 -89.
[4]Pan G,O’Rourke K,Dixit M.Caspase-9 bcl-x and apaf-1 form fermary complex[J].Biol Chem,1998,273(10):5841 -5845.
[5]Leone CW,Bokhadhoor H,Kuo D,et al.Immunization enhance inflammation and tissue destruction in response to Porphyromonas gingivlis Infect[J].Infect Immun,2006,74(4):2286-2292.
[6]梁敏,凌均棨.牙周炎发病过程中的细胞凋亡[J].中华口腔医学杂志,2010,45(9):573 -576.
[7]Nechushtan A,Smith CL,Lamensdorf I,et al.Bax and Bak coalesce into novel Mi- associated clusters during apoptosis[J].Cell Biol,2001,153:1265.
[8]黄行许,黄肖国.巨噬细胞凋亡及其调控[J].生物化学与生物物理进展,2000,27(2):140-141.
