内毒素对人牙周膜细胞Toll样受体2和Toll样受体4表达的影响
2012-11-05段立立许丽华杨冬茹蒋强国
段立立,许丽华,王 洁,杨冬茹,蒋强国
(河北医科大学口腔医院,省口腔重点实验室,河北石家庄 050017)
Toll样受体(Toll like receptors,TLRs)是天然免疫受体家族中的一员,通过识别病原体的病原相关分子模式(pathogen association molecular pattern,PAMP),引起细胞内信号传导,从而引起细胞因子分泌,启动炎症反应。牙周病是以G-厌氧菌为主的混合感染,内毒素(lipopolysaccharide,LPS)是其主要毒力因子,可穿过上皮进入深部的结缔组织与TLR2和TLR4结合,促进牙周病的发生和发展。牙周膜细胞(periodontal ligament cells,PDLCs)是牙周膜内的主体细胞,具有较强合成胶原的能力,对牙周组织健康的维持以及牙齿的稳固十分重要。PDLCs是否可以作为免疫细胞参与牙周组织的局部免疫反应是目前关注的热点,本研究采用免疫细胞化学染色法检测体外培养的PDLCs是否表达TLR2和 TLR4,同时观察 LPS刺激不同时间对PDLCs表达TLR2和TLR4的影响,以期了解TLRs在牙周病中的免疫学作用。
1 材料和方法
1.1 主要试剂和仪器
高糖DMEM培养液(北京索莱宝科技有限公司);胎牛血清(浙江天杭科技有限公司);兔抗人TLR2多克隆抗体、兔抗人TLR4多克隆抗体(北京博奥森生物技术有限公司);鼠抗人波形蛋白单克隆抗体、鼠抗人角蛋白单克隆抗体、免疫组化试剂盒、DAB显色试剂盒(北京中杉金桥生物技术有限公司);胰蛋白酶、MTT、DMSO(Sigma,美国);二氧化碳培养箱、生物安全柜(NUNR,美国);荧光倒置显微镜(Olympus,日本);酶标仪(TECAV,奥地利);离心机、系列移液器(EPPENDORF,德国);细胞培养瓶、培养板(Coring Costar,美国);多功能真彩色细胞图像分析管理系统(Media Cyberneties,美国)。
1.2 PDLCs原代培养和鉴定
取12~26岁志愿者因正畸减数拔除的牙周组织健康的前磨牙,无菌湿润条件下刮取根中1/3的牙周膜组织,采用组织块法进行PDLCs的原代培养,待细胞从组织块中爬出并铺满瓶底达80%时进行首次传代。取第3代细胞进行免疫细胞化学染色,通过波形蛋白和角蛋白染色鉴定细胞来源。
1.3 PDLCs生长曲线的绘制
取第4代生长良好的处于对数生长期的PDLCs,用DMEM培养液制成4×104/mL的单细胞悬液后取接种于96孔板(共铺7板,每板复种3孔,每孔200 μL,同时设不加细胞的调零孔,置于CO2培养箱内标准条件下进行培养。分别于培养后 1、2、3、4、5、6、7 d,各取出 1 板,用四唑盐比色法(Methlthazoletrazolium,MTT)检测细胞生长情况,并绘制生长曲线。
1.4 检测LPS刺激后TLR2和TLR4在PDLCs中的表达
取第4代生长良好的PDLCs以5×104/mL的密度接种于每孔底部放有圆形盖玻片的24孔培养板,加入适量DMEM培养液,放入CO2培养箱中标准条件下进行培养。待细胞均匀贴壁生长并基本铺满盖玻片后,弃原培养液,实验组加入含LPS终末浓度为10 μg/mL的DMEM培养液,对照组加入不含LPS的DMEM培养液,继续培养。分别于培养后 4、8、12、24 h,收集各组细胞爬片,丙酮固定,运用免疫细胞化学染色SP法检测TLR2和TLR4在牙周膜细胞中的表达,一抗分别为兔抗人TLR2和TLR4多克隆抗体,抗体浓度为1∶100。以PBS代替一抗作为空白对照。
利用多功能真彩色细胞图像分析管理系统对染色标本进行图像分析,每张爬片随机选择5个高倍视野(×400),根据Soslow[1]的评分方法进行免疫组化评分(Immunohistochemical score,IHS),分别计算TLR2和TLR4在各组各时间点的平均分值。
1.5 统计学分析
使用SPASS 13.0软件对所得数据进行单因素方差分析,两两比较用t检验,检验水准α=0.05。
2 结果
2.1 PDLCs原代培养和鉴定
原代培养的PDLCs以组织块为中心呈放射状排列,倒置显微镜下见细胞呈长梭形,有2~4个细胞突,胞体丰满,胞浆均匀,核圆形或卵圆形,核仁清晰,数量1~3个不等。免疫细胞化学染色结果显示:体外培养的PDLCs均为抗波形蛋白染色阳性,阳性部位位于胞浆;抗角蛋白染色阴性,证实细胞来源于中胚层,符合成纤维细胞的生物学特性。
2.2 PDLCs生长曲线
取第4代PDLCs继续培养,其生长曲线呈典型的“S”形,经历了潜伏期、对数生长期和平台期3个生长阶段(图1)。
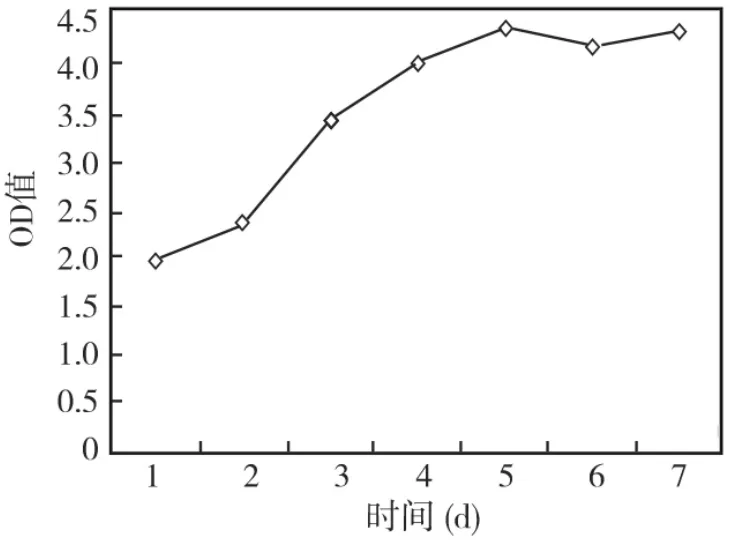
图1 PDLCs生长曲线
2.3 10 μg/mL LPS 对 PDLCS表达 TLR2 和 TLR4的影响
PDLCs爬片的免疫细胞化学染色结果显示,TLR2和TLR4主要表达于细胞膜和细胞浆中,细胞核内不表达,阳性部位呈棕黄色(图2~3)。
免疫组化评分(IHS)结果显示,TLR2和TLR4表达情况相似,以PBS替代一抗的空白对照组染色均为阴性;无LPS刺激的对照组TLR2和TLR4均为为弱阳性;加入LPS后染色增强,且随LPS刺激时间增加而增加,LPS刺激后各时间的TLR2和TLR4的HIS分值与对照组相比均有显著差异(P<0.05),PLS刺激后各时间点两两相比,除12 h组与24 h组无显著性差异(P>0.05)外,其他各时间点相比均有显著性差异(P<0.05)(表1)。
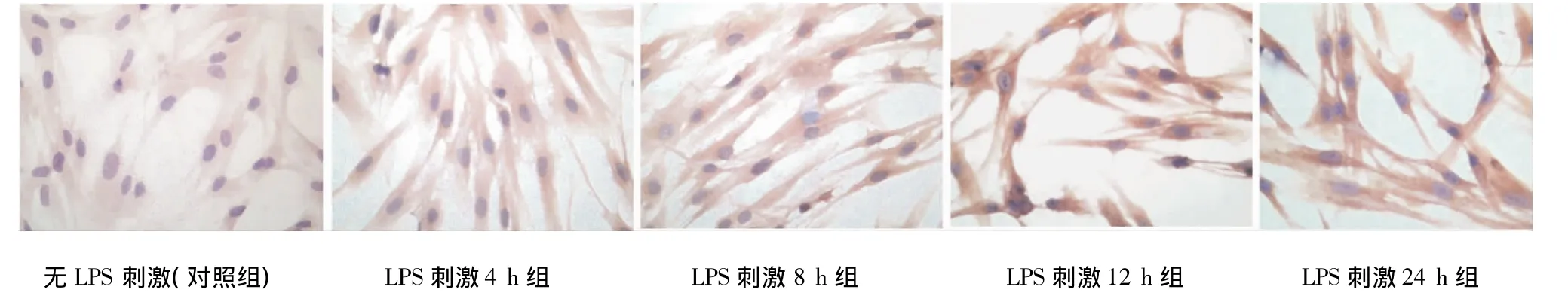
图2 10 μg/mL LPS刺激后不同时间PDLCs表达TLR2的免疫细胞化学染色(SP×400)
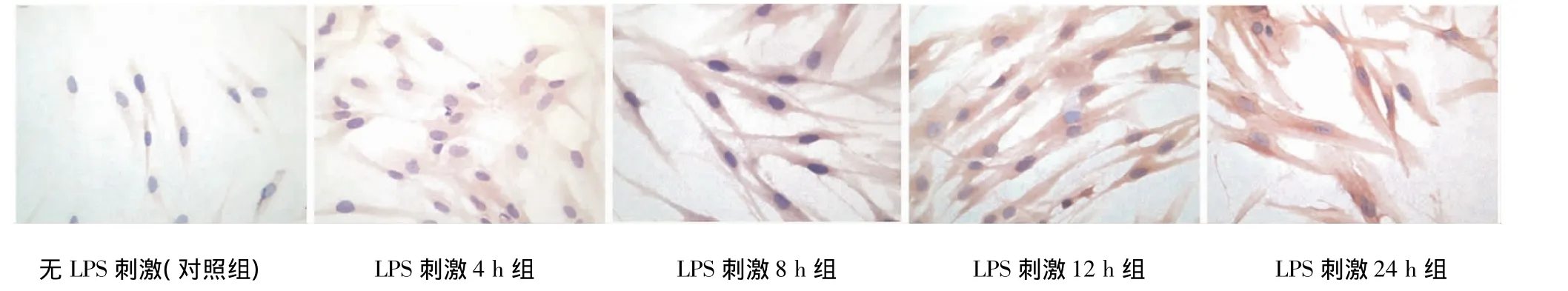
图3 10 μg/mL LPS刺激后不同时间PDLCs表达TLR4的免疫细胞化学染色(SP×400)
表1 10 μg/mL LPS刺激后各时间点TLR2和TLR4的IHS分值

表1 10 μg/mL LPS刺激后各时间点TLR2和TLR4的IHS分值
* 组间比较P>0.05,其他各时间点间相比P<0.05
指标 对照组 4 h组 8 h组 12 h组 24 h组TLR2 0.42 ±0.05 0.73 ±0.04 1.62 ±0.13 2.77 ±0.06* 2.81 ±0.05*TLR4 0.19 ±0.03 0.40 ±0.05 1.18 ±0.33 2.33 ±0.49* 2.48 ±0.45*
3 讨论
TLRs是LPS跨膜信号转导的模式识别受体,属于Ⅰ型跨膜蛋白,由胞外区、跨膜区和胞内区3部分组成。TLRs分布较广泛,主要表达于单核细胞、巨噬细胞、中性粒细胞等免疫细胞表面,在内皮细胞、上皮细胞和成纤维细胞等非免疫细胞表面也有表达[2-3]。有研究发现,牙龈卟啉单胞菌的LPS可通过牙龈成纤维细胞膜上的TLR4相结合而向胞内传导,刺激牙龈成纤维细胞释放炎症因子,激活破骨细胞,引起牙槽骨吸收,从而促进牙周疾病的发生和发展[4]。亦有研究发现[5]慢性牙周炎病人唾液和血浆中TLR2、TLR4的表达水平均显著增高。以上研究结果提示,TLR2和TLR4与牙周炎症密切相关,存在于口腔内的病原体可引起TLRs信号传导从而导致牙周炎的发生。
本结果显示,无LPS刺激组PDLCs中TLR2和TLR4表达呈弱阳性,说明尽管牙周组织健康,PDLCs也可以表达TLR2和TLR4,可能是因为龈沟液中存在的少量LPS穿过沟内上皮和结合上皮进入深部的牙周膜组织,使部分PDLCs处于受刺激状态并少量表达TLR2和TLR4,可能是PDLCs的一种自我防御功能的表现。而经LPS刺激后各组表达TLR2和TLR4显著增强,表明PDLCs参与了牙周组织的局部免疫反应,LPS刺激可上调其TLR2和TLR4的表达。
本结果与一些学者的研究结果类似,Scheres等[6]通过体外培养的健康者和牙周炎者的PDLCs进行研究发现,牙周炎组的PDLCs有TLR1、TLR4、TLR7和CD14的mRNA的高表达。吴安平等[7]报道,在健康PDLCs中有TLR4表达,牙龈卟啉菌的LPS可刺激牙周膜细胞TLR4基因的上调。Sun等[8]研究发现,体外培养的人牙周膜细胞经LPS刺激后,TLR4和IL-6表达明显增加。以上研究结果提示,存在于口腔内的病原体可引起TLR4的信号传导而导致牙周炎,牙周膜细胞参与牙周组织的免疫应答。
TLRs的信号传导是一个非常复杂的过程,深入研究TLRs的配体识别、信号转导等各个环节,对进一步研究牙周免疫系统的结构与功能具有重要意义。同时还可尝试通过开发相应的药物来阻断LPS与TLR2、TLR4的结合从而阻断TLRs的信号传导通路,减轻LPS诱发的炎性细胞因子的释放,从而为牙周病的治疗和预防提供新途径。
[1]Soslow RA,Dannenberg AJ,Rush D,et al.Cox-2 is expressed in human pulmonary colonic and mammary tumors[J].Cancer,2000,89:2637-2645.
[2]Takeda K,Akira S.Toll-like receptors in innate immunity[J].Int Immune,2005,11(7):1 -14.
[3]Ozinsky A,Underhill DM,Fontenot JD,et al.The receptor for pattern recognition of pathogens by the innate immune systerm isdefined by cooperation between toll-like receptors[J].Proc Natl Acad Sci USA,2000,97(25):13766-13771.
[4]Wang PL,Mari O,Takeo F.Heterogeneous expression of tolllike receptor 4 and downregulation of Toll-like receptor 4 expression on human gingival fibroblasts by Porphyromonas gingivalis lipopolysaccharide[J].J Dent Res,2001,80(1):687 -694.
[5]Buduneli N,Ozcaka O,Nalbantsoy A,et al.Salivary and plasma levels of toll-like receptor 2 and toll-like receptor 4 in chronic periodontitis[J].J Periodontol,2010,11(7):114 -116.
[6]Scheres N,Laine ML,Sipos PM,et al.Periodontal ligament and gingival fibroblasts from periodontitis patients are more active in interaction with Porphyromonas gingivalis[J].J Periodontal Res,2011,17(10):146 -154.
[7]吴安平,束蓉,李昊妍,等.TLR-4在人牙周膜成纤维细胞中的表达研究[J].口腔医学研究,2005,21(6):609-611.
[8]Sun Y,Shu R,Zhang MZ.Toll- like receptor 4 signaling plays a role in triggering periodontal infection[J].FEMS Immunol Med Microbiol,2008,52(3):362 -369.
