Runx2介导TGF-β1调控成釉细胞MMP20基因表达的研究
2012-11-05孙学玲张娟娟梁广智刘晓影高玉光
孙学玲,孙 岩,张娟娟,赵 娜,梁广智,刘晓影,成 敏,高玉光
(山东潍坊医学院口腔医学研究所,山东潍坊 261053)
金属基质蛋白酶-20(matrix metalloproteinase 20,MMP20)是牙齿特异性表达的蛋白酶,在牙釉质蛋白的降解中发挥主要的作用。有研究表明[1],MMP20基因敲除小鼠的牙釉质矿化程度及硬度均显著降低。我们在以往研究中发现[2-3]TGF-β1参与了牙釉质发育并调控成釉细胞MMP20基因的表达。为进一步研究TGF-β1调控MMP20的分子机制,本实验观察了转录因子Runx2在TGF-β1调控MMP20基因表达中的作用。
1 材料和方法
1.1 主要材料
小鼠成釉细胞系(日本Akita大学Sugiyama教授馈赠);双荧光素酶报告基因检测系统试剂盒、TransFastTMTransfection Reagent(Promega公司);RNAiso Plus、MutanBEST Kit、蛋白酶 K(TaKaRa 公司);SYBR Green PCR Master Mix(Roche公司);TGF-beta1(Perotech Inc公司);胰蛋白酶、DMEM培养基(Hyclone公司);胎牛血清(杭州四季青公司);割胶回收试剂盒、质粒小抽提取试剂盒、pepstatin、aprotinin9(BBI公 司);IQ5TMPCR 仪(Bio-Rad 公 司 );SirinsL Tube Luminometer(Berthold公司);protein A agarose beads(Upstate公司);质粒 PGL3-basic、内参照质粒 pRL40均为实验室保存。
1.2 方法
1.2.1 细胞培养
小鼠成釉细胞系(ALC)常规复苏后,用DMEM(含100 mL/L胎牛血清)培养液在37℃、50 mL/L CO2、饱和湿度条件下进行培养并传代,细胞传至5代以上,用于实验。
1.2.2 双荧光素酶报告基因检测
待细胞长满至70% ~80%时,按照TransFastTMTransfection Reagent操作说明书进行质粒转染。以PGL3-basic为阴性对照,pRL40为内参对照,实验分4 组。组1:PGL3-basic;组2:PGL3-basic+TGF-beta1;组 3:PGL3-MMP20;组 4:PGL3-MMP20+TGF-beta1;其中PGL3-MMP20为本实验室克隆并保存的鼠MMP20启动子不同长度的荧光素酶表达载体的质粒。待培养30 h后,加入0.5 ng/mL TGF-β1,继续培养3 h。成釉细胞裂解前先用PBS洗涤1次,再用100 μL细胞裂解液PLB裂解细胞;在加样管加入100 μL的Luciferase Assay ReagentⅡ(LARⅡ),吸取20 μL细胞裂解液与之混匀,并加样于荧光素酶检测仪,检测10 s时的萤火虫荧光素酶(Firefly luciferase)激发底物释放荧光的数值U1。然后加入100 μL 的stop&Glo Reagent,检测样品中海肾荧光素酶(Renilla luciferase)激发底物释放荧光的数值U2。每一样品均取U1/U2之值为该质粒报告基因的荧光素酶相对活性,每组3个样本,重复3次。
1.2.3 染色体免疫共沉淀
利用TFSEARCH、AliBaba 2.1工具分析得到Runx2结合的特异性序列“TGTGGG”,该位点位于MMP20启动子-383~-375区域内。针对这一潜在结合位点设计引物,上游 P1:5’-ATTCTTTTACAATAGGATGC-3’;下游 P2:5’-TTCAGTGACTCTTTACTCTTTA-3’。预计片段为 163 bp,由宝生物工程大连有限公司合成。反应条件94℃4 min,94℃ 30 s,51℃ 30 s,72℃ 20 s,34个循环后72℃延伸5 min。取成釉细胞用终浓度为10 mL/L的甲醛溶液在37℃下固定10 min,裂解细胞并取上清液,用超声波将DNA破碎至500 bp左右后,实验组按浓度1∶500滴加兔抗鼠Runx2抗体(Santa Cruz公司),同时IgG组滴加等浓度的羊抗兔无关抗体,阴性对照不加任何抗体,4℃孵育过夜,琼脂糖珠A沉淀离心,收集蛋白质染色体免疫复合物,经解交联、消化蛋白后,每组取等量DNA纯化液用PCR进行DNA鉴定。其中阳性对照组取等量DNA破碎原液为模板。
1.2.4 基因突变及双荧光素酶报告基因载体的构建
根据MutanBEST Kit试剂盒说明设计5’端邻接,3’端方向相反的引物,用以导入突变位点。将Runx2结合位点由“TGTGGG”突变为“TGTAAG”。上游引物 P3:5’-CCTGTAAGTGCAAATAAAGAGTAAAG-3’;下游引物 P4:5’-CAAGCCTGATGACCTGGGTT-3’;以本实验室克隆并保存的鼠MMP20启动子序列(-488~+23)为模板;将导入突变位点的启动子序列连至PGL3-basic,经酶切测序鉴定正确后,命名质粒为 PGL3-MMP20(-488~ +23)-MUT。
1.2.5 Western Blot
待Runx2 siRNA和control siRNA(均为实验室保存)转染成釉细胞60 h后,裂解细胞,并提取蛋白上清,经SDS-PAGE、半干转印,转移到硝酸纤维素滤膜上(转印条件15 V,转印时间25 min),用兔抗鼠的Runx2抗体与膜上的蛋白进行抗原抗体反应,ELC试剂盒检测。
1.2.6 实时定量 RT-PCR
以成釉细胞提取的总RNA逆转录的cDNA为模板,进行实时定量PCR,用于检测MMP20基因表达的改变。引物序列:内参对照GAPDH,F:5'- TGTGTCCGTCGTGGATCTGA-3';R:5'-TTGCTGTTGAAGTCGCAGGAG -3';MMP20,F:5'-GGCGAGATGGTGGCAAGAG-3';R:5'-CTGGGAAGAGGCGGTAGTT-3'。反应条件94℃ 4 min,94℃ 10 s,60℃ 15 s,72℃ 25 s,80℃ 15 s采集荧光,40个循环后72℃延伸5 min。反应在IQ5TMPCR仪进行,每个样本3个复孔,重复3次。用配对t检验分析实时定量RT-PCR结果。
2 结果
2.1 TGF-β1调控成釉细胞MMP20启动子的转录活性
首先观察TGF-β1对MMP20启动子的转录活性的影响。待细胞长满至70% ~80%,分别将PGL3-basic或 PGL3-MMP20(图 1a)与 pRL40 质粒共转染30 h 后,加入0.5 ng/mL TGF-β1,继续培养3 h。TGF-β1刺激成釉细胞后,PGL3-MMP20荧光活性在-87~+23区域无明显变化外,其他各区域活性均上调,其中-488~+23区域荧光素酶的活性显著增强(P﹤0.05)(图1b)。
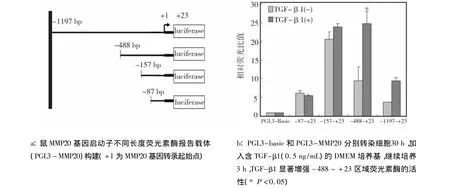
图1 TGFβ-1调控成釉细胞MMP20启动子的转录活性
2.2 Runx2调控成釉细胞MMP20启动子的转录活性
首先利用TFSEARCH、AliBaba 2.1工具分析得到Runx2结合的特异性序列“TGTGGG”,该序列“TGTGGG”位于MMP20启动子-383~-375区域内(图2a)。由图2b所示用PCR方法鉴定Runx2抗体沉淀分离出的特异性DNA序列。其中实验组与其他各组对照后,得到清晰显著的条带,与预计的大小相符,说明该位点“TGTGGG”是Runx2特异性结合位点。进一步将该位点突变后连至PGL3-Basic。以PMD 18 Simple T-MMP20(-488~ +23)(实验室保存)为模板,P3、P4为引物,扩增出约3203 bp大小的片段,经自身连接(环化反应)后,抽提质粒连至PGL3-Basic,酶切测序鉴定证实特异性结合位点“TGTGGG”突变为“TGTAAG”(图 2c、d)。最后将PGL3-MMP20(-488 ~ +23)-WT、PGL3-MMP20(-488~+23)-MUT与10 ng的Runx2共转染细胞30 h。与野生型MMP20启动子相比,Runx2结合位点的突变明显抑制MMP20启动子的活性(P﹤0.05)(图2e)。
2.3 TGF-β1和 Runx2 siRNA调控成釉细胞MMP20基因表达的研究
为进一步明确 Runx2参与介导 TGF-β1对MMP20基因表达的调控,首先Western Blot结果显示:成釉细胞中 Runx2蛋白表达水平显著减弱(图3a)。表明Runx2 siRNA有效阻断Runx2蛋白的表达。将Runx2 siRNA转染细胞60 h后,加入含TGF-β1(0.5 ng/mL)的 DMEM 培养基,继续培养3 h。Runx2基因沉默后,显著抑制 TGF-β1对成釉细胞MMP20 mRNA表达水平的上调作用(P ﹤0.05)(图3b)。
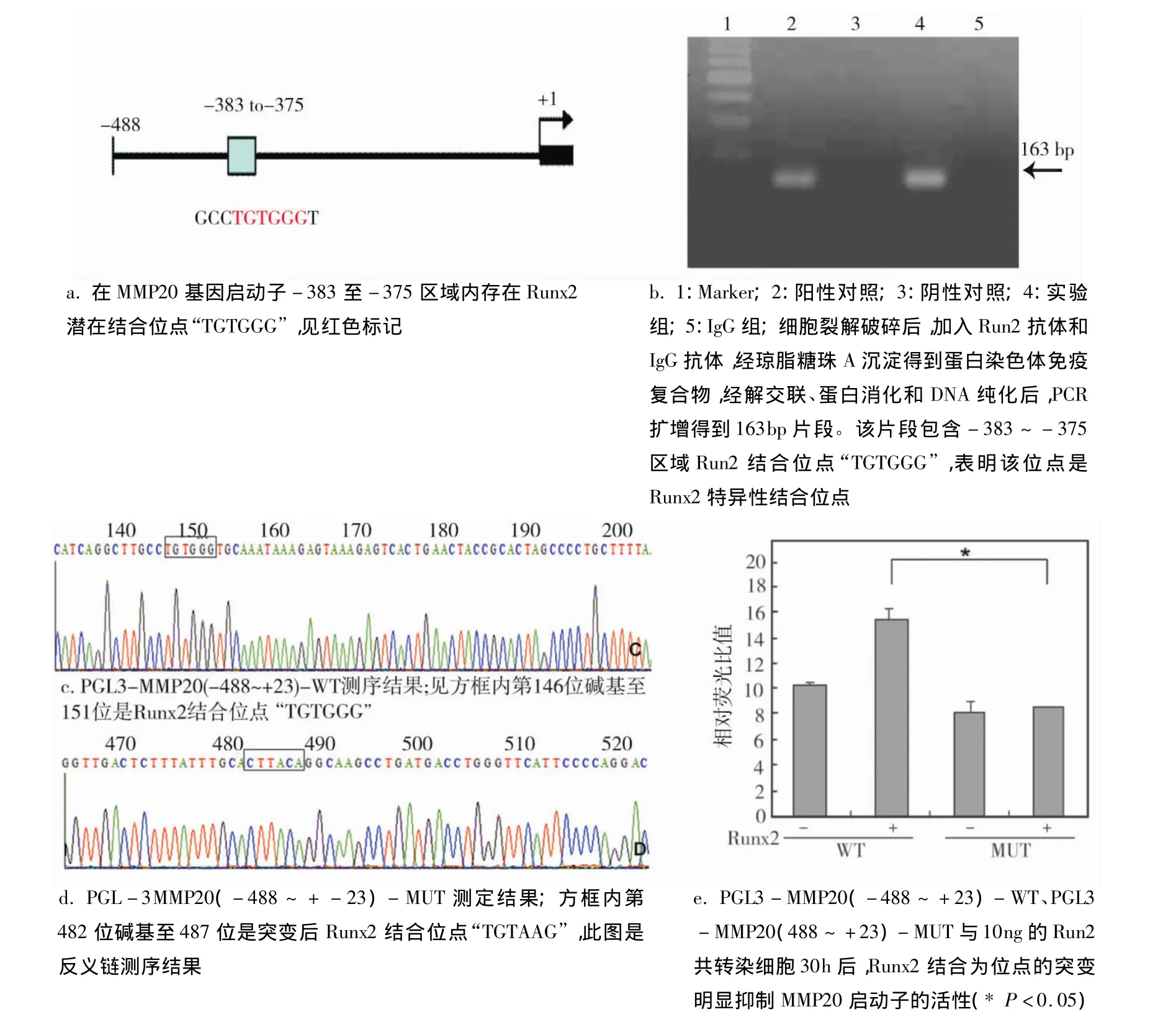
图2 Runx2调控成釉细胞MMP20启动子的转录活性
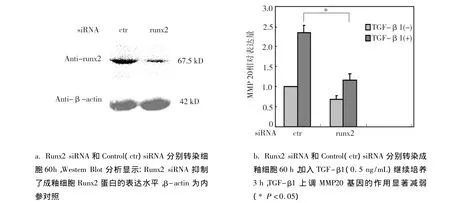
图3 Runx2介导TGF-β1调控MMP20基因的表达
3 讨论
Runx2是牙齿发育过程中起关键作用的转录因子之一,研究已证实[4-5]:Runx2基因表达缺陷小鼠无牙本质和釉质发生。临床上Runx2表达缺陷会导致锁骨颅骨发育不全[6-8],而且牙齿成熟延迟,但Runx2在釉质发育中发挥作用的分子机制尚不清楚。在釉质发育过程中,TGF-β1信号通路参与了 MMP20 基因表达的调控[2-3],并且TGF-β1与MMP20在釉质基质的分泌期与成熟期早期呈现共表达特征[3,9],因此推测 Runx2 可能参与TGF-β1信号通路调控MMP20的表达。本实验以小鼠成釉细胞系为模型,首先利用双荧光素酶基因报告系统探讨了TGF-β1对不同长度MMP20启动子转录活性的影响。我们以往研究表明,TGF-β1参与了成釉细胞MMP20启动子转录活性的调控[3]。本研究通过荧光素酶分析进一步发现,对于不同长度MMP20启动子,TGF-β1的作用存在明显不同(图1b)。我们利用生物学信息工具分析了MMP20启动子,发现该启动子在-383~-375区域内存在潜在的Runx2结合位点“TGTGGG”,因此我们利用染色体免疫共沉淀技术观察了Runx2与MMP20启动子“TGTGGG”序列的相互作用(图2b),进一步表明成釉细胞内Runx2与MMP20启动子存在相互作用。运用基因定点突变技术我们将“TGTGGG”突变为“TGTAAG”后,再利用双荧光素酶基因报告系统检测MMP20启动子转录活性。与野生型 MMP20启动子相比,Runx2上调MMP20转录活性的作用因Runx2位点的突变而不明显(图2e),提示转录因子Runx2参与了调控MMP20启动子的转录活性。因此我们推测Runx2可能参与了成釉细胞MMP20基因的表达。我们将Runx2 siRNA片段转染成釉细胞后,Runx2蛋白表达水平下降,TGF-β1上调MMP20基因表达的作用显著减弱(图3),表明Runx2介导TGF-β1调控MMP20基因的表达。本实验分别在基因转录和基因表达水平上探讨了Runx2在TGF-β1诱导MMP20基因表达中的作用机制,进一步阐明了釉质发育的分子调控机制。
[1]Barlett JD,Beniash E,Lee DH,et al.Decreased mineral content in MMP-20 null mouse enamel is prominent during the maturation stage[J].J Dent Res,2004,83:909 - 913.
[2]Gao Y,Li D,Han T,et al.TGF-beta1 and TGFBR1 are expressed in ameloblasts and promoter MMP20 expression[J].Anat Ret(Hoboken),2009,292(6):885 -890.
[3]韩婷婷,孙岩,张娟娟,等.TGF-beta1调控基质金属蛋白酶-20(MMP20)启动子转录活性的研究[J].牙体牙髓牙周病学杂志,2009,19(5):251 -255.
[4]Dsouza RN,Aberg T,Gaikwad J,et al.Cbfa1 is required for epithelial-mesenchymal interactions regulating tooth development in mice[J].Development,1999,126(13):2911 -2920.
[5]Aberg T,Cavender A,Gaikwad JS,et al.Phenotypic changes in dentition of Runx2 homozygote-null mutant mice[J].J Histochem Cytochem,2004,52:131-140.
[6]Jensen BL,Kreiborg S.Development of the dentition in cleidocranial dysplasia[J].J Oral Pathol Med,1990,19:89 -93.
[7]McNamara CM,ORiordan BC,Blake M,et al.Cleidocranial dysplasia:radiological appearances on dental panoramic radiography[J].Dentomaxillofac Radiol,1999,28:89 -97.
[8]Shaikh R,Shusterman S.Delayed dental maturation in cleidocranial dysplasia[J].ASDC J Dent Child,1998,65(5):325 -355.
[9]Tsuchiya M,Sharma R,Tye CE,et al.Transforming growth factor-beta1 expression is up-regulated in maturation-stage enamel organ and may induce ameloblast apoptosis[J].Eur J Oral Sci,2009,117(2):105-112.
