熊果酸自微乳给药系统的制备及质量评价
2012-11-01钦富华林杭娟高建青
钦富华,林杭娟,高建青
(1.浙江医药高等专科学校,浙江 宁波 315100;2.浙江大学药学院,浙江 杭州 310058)
熊果酸又名乌索酸,是广泛存在于植物中的五环三萜类化合物。研究表明熊果酸具有抗肝炎、抗菌、抗肿瘤、抗溃疡、降低血糖等广泛的生物学效应,且毒性低,不良反应小,具有广泛的开发前景[1-2]。熊果酸在水中的溶解度极小,溶出速度很慢,生物利用度低。已有文献报道将熊果酸制成固体分散体、包合物、滴丸及纳米粒等[3-6],以期提高其溶出及口服生物利用度。
自微乳化给药体系 (self-microemulsifying drug delivery system,SMEDDS)是由油相、表面活性剂及助表面活性剂组成的均一、透明的溶液,一旦与水相混合,在环境温度(通常指体温37℃)下只需要温和搅拌就能自发形成透明或者半透明的微乳。微乳可增加药物的溶解度和吸收面积,处方中含有表面活性剂,可提高药物的溶出,增加小肠上皮的渗透性,有助于提高药物的生物利用度[7-8]。自微乳化给药体系制备简单,性质稳定,将溶液分装于软胶囊中,剂量准确且服用方便,是提高难溶性药物口服吸收的良好载体。本研究制备了熊果酸自微乳制剂,并对其体外性质进行了考察。
1 材料与仪器
1.1 材料 熊果酸对照品 (上海源叶生物科技有限公司,批号YY20100425);熊果酸原料药 (西安飞达生物技术有限公司,纯度>98%);Labrafil M 1944CS、Labrasol、Transcutol P(法国佳法赛公司);Cremophor EL(德国巴斯夫公司);甲醇、乙腈为色谱纯,其他药品、试剂均为国产分析纯。
1.2 仪器 Dionex Ultimate 3000高效液相色谱仪 (美国戴安公司);Nanosize-90粒径测定仪 (马尔文仪器有限公司);TU-1810SPC型紫外分光光度计 (北京普析通用仪器有限公司);SHA-B型数显水浴恒温振荡器 (上海金鹏分析仪器有限公司);SB25-120超声波清洗机 (宁波新芝生物科技股份有限公司);METTLER TOLEDO电子分析天平(梅特勒-托利多仪器有限公司);高速离心机 (上海安亭科学仪器厂)。
2 方法与结果
2.1 熊果酸HPLC方法的建立[9]色谱条件 Agilent TCC18色谱柱 (250 mm×4.6 mm,5μm);流动相为乙腈-0.3%磷酸 (85∶15);体积流量为1.0 mL/min;检测波长为210 nm;柱温为30℃;进样量为20 μL。在上述色谱条件下,熊果酸色谱峰理论塔板数大于3000,辅料不干扰熊果酸的测定。熊果酸质量浓度在2.5~120 mg/L的范围内与峰面积呈良好的线性关系,A=0.0852ρ+0.0033,r=0.9999,高、中、低质量浓度的平均回收率为101.3%、101.7%和101.9%,RSD为0.15%、1.11%和1.59%。日内和日间精密度 (RSD)均小于2.0%,符合含量测定要求。
2.2 熊果酸自微乳的处方筛选
2.2.1 熊果酸在油相、乳化剂和助乳化剂中溶解度考察
本研究选择了植物油、油酸乙酯等不同的油相,吐温、Cremophor EL等HLB值较高的乳化剂及乙醇、PEG400等助乳化剂,进行了熊果酸的溶解度考察。各取约2 g的油相、乳化剂及助乳化剂,加入过量的熊果酸,涡旋分散均匀,25℃水浴平衡48 h,10000 r/min离心10 min,上清液用0.22 μm的微孔滤膜过滤,续滤液用甲醇稀释适宜倍数后用HPLC测定。平衡溶解度结果显示熊果酸在油相中溶解不理想,在油酸乙酯和Labrafil M 1944 CS中相对较好,分别为 (1.41±0.07)mg/g和 (2.35±0.26)mg/g;在乳化剂和助乳化剂中,特别是Cremophor EL和Transcutol P中溶解较好,分别为 (10.80±1.58)mg/g和 (10.76±1.21)mg/g。
2.2.2 油和乳化剂的配伍 将油相与乳化剂按2∶3(w/w)的比例在37℃的水浴中振荡混合后观察其分散情况,再加入100倍量的蒸馏水,轻微振荡,观察其乳化情况。根据文献将自微乳化情况分为5个级别:(A)溶液呈澄清或微泛蓝色;(B)略浊,呈蓝白色;(C)呈亮白色不透明液体;(D)色泽暗,呈灰白色,略带油状;(E)难乳化,一直有油滴存在。结果见表1。配伍实验表明以Cremophor EL为乳化剂的乳化效果最为理想,外观呈现透明带蓝色乳光,因此确定乳化剂为Cremophor EL。以辛癸酸甘油酯、肉豆蔻酸异丙酯和油酸乙酯为油相的效果相差不大,但结合考虑药物的溶解能力,最终确定油酸乙酯为油相。
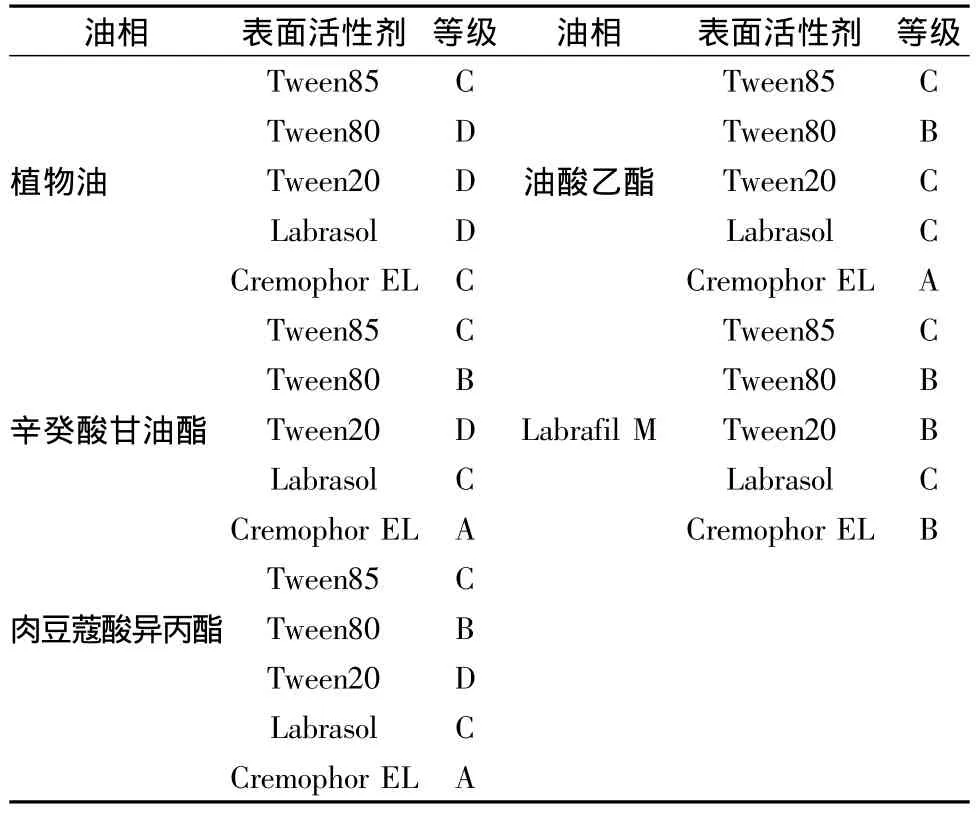
表1 不同油相和乳化剂的的配伍情况
2.2.3 助乳化剂的选择 采用滴定法绘制伪三元相图,固定油相为油酸乙酯、表面活性剂为Cremophor EL,考察不同助表面活性剂无水乙醇、1,2—丙二醇、PEG400和Transcutol P形成微乳的能力,将表面活性剂和助表面活性剂按质量比 (Km)1∶1混匀,再与油相以9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9的比例混匀。37℃水浴磁力搅拌条件下,滴加水相至形成澄清透明溶液,记录微乳形成时各组分的量,Origin软件绘制伪三元相图。以相图中微乳存在区域的大小来筛选助乳化剂,结果见图1。从相图中可知,以PEG400为助乳化剂时所形成的微乳区域最大,但是由于PEG400和Cremophor EL的互不相溶性,自乳化浓缩液不澄明,体系不稳定。以Transcutol P、乙醇和1,2—丙二醇为助乳化剂时效果相似,但Transcutol P略好,同时药物在Transcutol P中的溶解度较大,故选择Transcutol P为助乳化剂。
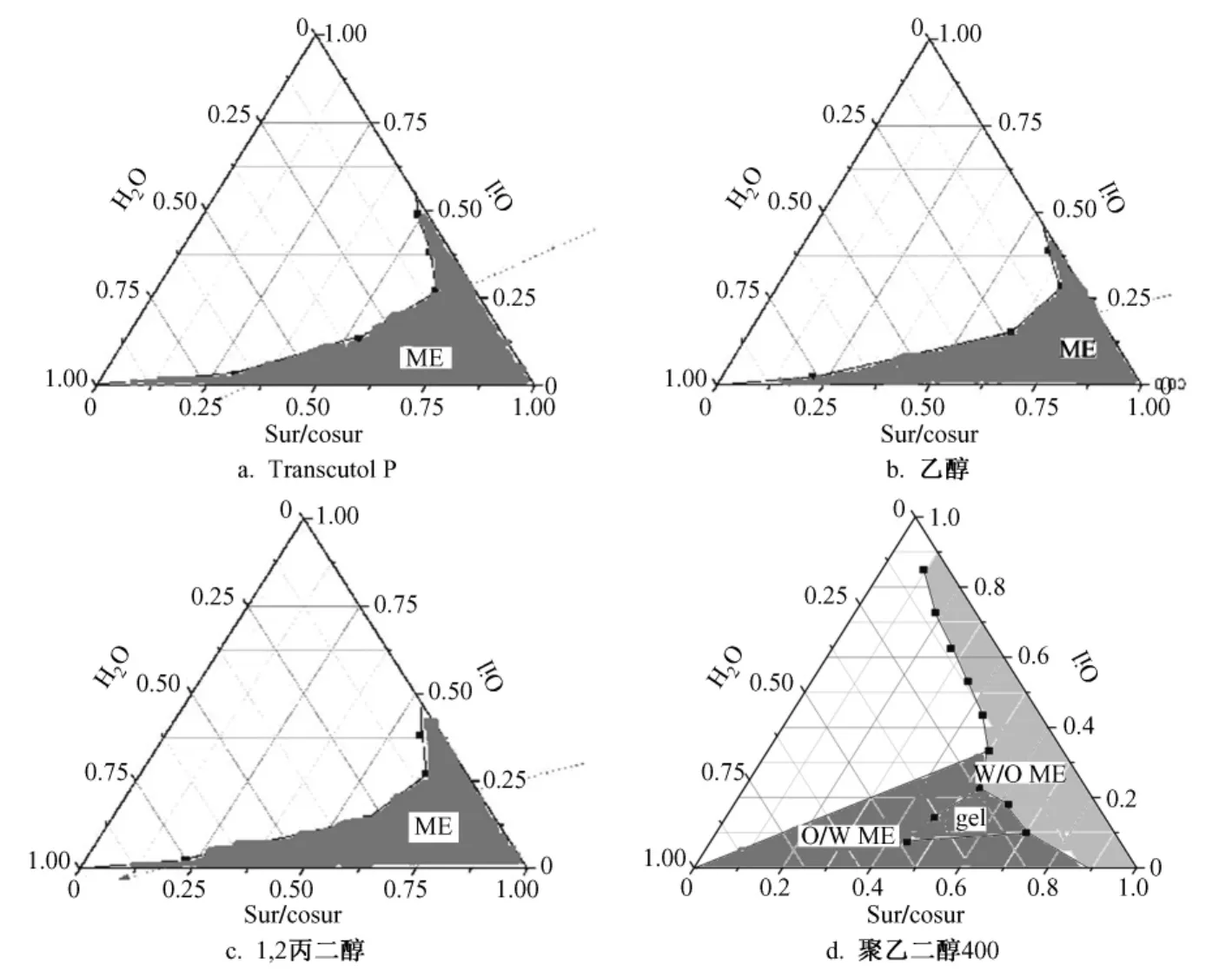
图1 含不同助乳化剂的相图
2.2.4 处方优化 对EO/Cremophor EL/Transcutol P进一步进行优化,考察不同Km对自微乳化区域的影响,以粒径大小和分布情况、体系载药量大小为评价指标,最终确定体系的组成为油相为油酸乙酯 (15.0%),表面活性剂为Cremophor EL(40.0%),助表面活性剂为 Transcutol P(45%),熊果酸质量分数为10 mg/g。
2.3 微乳形态和粒径分布 取熊果酸SMEDDS,加蒸馏水稀释50倍,待自乳化完全后,取适量滴在铜网上,用2%的磷钨酸 (pH4.47)负染色,晾干后电镜观察 (见图2),并用粒径测定仪测定微乳的粒径和电位 (见图3)。熊果酸SMEDDS用蒸馏水稀释50倍后形成的微乳在电镜下观察,乳滴呈圆球形,形态良好。粒径分析仪测定微乳的平均粒径为23.18 nm,多分散指数PDI为0.146,粒径分布集中。微乳的zeta电位为-5.35 mv。

图2 熊果酸微乳透射电镜照片 (×29000)
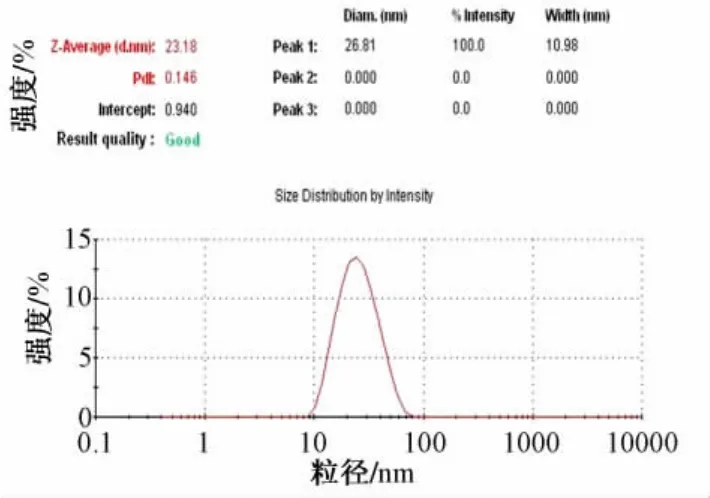
图3 熊果酸微乳粒径分布图
2.4 体外溶出 取自制熊果酸自微乳胶囊 (含熊果酸5 mg)和熊果酸胶囊 (含熊果酸10 mg),按照《中国药典》2010年版附录溶出度测定法 (转篮法)测定,以0.5%十二烷基硫酸钠水溶液500 mL为溶出介质,转速100 r/min,温度37℃。依法操作,分别于5、10、20、30、45、60 min取样5 mL,立即补充5 mL介质。样品经0.45 μm滤膜滤过后,取续滤液,加甲醇稀释后HPLC法测定,外标法计算溶出介质中熊果酸含有量,计算累积溶出百分数,结果见图4。体外溶出结果表明,熊果酸SMEDDS在10 min内溶出达80%以上,而胶囊60 min溶出仅20%左右。SMEDDS可大大提高熊果酸的体外溶出。
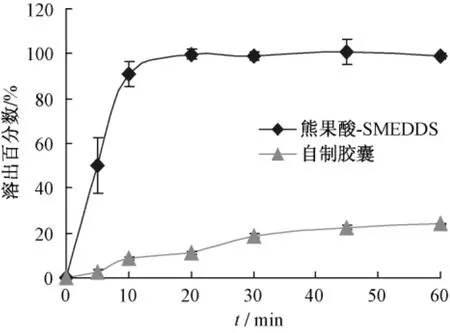
图4 熊果酸SMEDDS与熊果酸胶囊的体外溶出比较
3 讨论
3.1 溶解度测定的过程中,表面活性剂、助表面活性剂和多数油相均能溶于甲醇,但是植物油、色拉油、橄榄油等不能完全溶于甲醇,故本实验采用了甲醇提取的方法,将少量植物油与甲醇涡旋混合、离心取上清液后测定。
3.2 根据Pouton[10]提出的脂质制剂的分类方法,可以将自微乳化制剂归纳为两类,一类是油相比例较高且不含助乳化剂,一类是油相比例较低并含有助乳化剂。由于熊果酸在油相中的溶解度不是很理想,而在助乳化剂中溶解度较好,因此本研究选择含助乳化剂的体系。助乳化剂的作用一方面协助降低油水界面张力促使微乳易于形成;另一方面也是很重要的助溶剂,能提高微乳的载药量。
3.3 在处方优化的过程中,本研究考察了Km对微乳区域形成的影响,Km增加,微乳形成的区域变大,但是相应的体系的黏度也增大,自微乳化的时间延长。Km值减小,乳滴的粒径变大,且会出现药物析出的现象,可能是助乳化剂中药物被大量稀释后出现“搁浅”现象。
3.4 中药中提取得到的大多数活性成分水溶性均较差,其体外溶出和口服生物利用度较低。自微乳制剂能明显地提高药物的溶出并增加吸收,是难溶性中药的有效载体。自微乳制剂已被证明能增加熊果酸的体内吸收。欧晓霞等[11]以油酸为油相、吐温20和乳化剂OP为乳化剂、异丙醇为助乳化剂制备了熊果酸的自微乳制剂,并以缓释片和混悬液为对照,进行了大鼠体内生物利用度的研究,结果表明自微乳制剂的相对生物利用度为326.5%。本制剂的体内吸收情况有待于研究。
[1]夏国豪.熊果酸抗肿瘤作用研究进展[J].国外医学肿瘤学分册,2002,29(6):420-422.
[2]孟艳秋,陈 瑜,王 趱,等.熊果酸的研究进展[J].中国新药杂志,2007,16(1):25-28.
[3]赖 玲,杨 光,杨 昕.熊果酸固体分散体的制备与体外溶出度测定[J].医药导报,2005,24(6):517-518.
[4]权 鹏,李 瑞,刘东飞.正交试验设计与灰色关联度分析用于熊果酸包合物载药量的影响因素研究[J].中国药房,2008,19(13):973-974.
[5]邹盛勤,陈 武,伍晓春.熊果酸滴丸的制备工艺优化[J].中国医院药学杂志,2009,29(2):103-105.
[6]Yang L,Sun Z,Zu YG,et al.Physicochemical properties and oral bioavailability of ursolic acid nanoparticles using supercritical anti-solvent(SAS)process[J].Food Chem,2012,132(1):319-325.
[7]陈祝康,吴丹旎,冯轶杉,等.辛伐他汀自微乳化释药系统在Beagle犬体内的药动学特征[J].中国临床药学杂志,2008,17(3):166-169.
[8]马俐丽,朱照静.普罗布考自微乳化释药系统大鼠体内药动学研究[J].重庆医科大学学报,2010,35(8):1232-1234.
[9]刘 炜,吴义忠.健胃消食片中熊果酸的含量测定[J].中国现代药物应用,2010,4(1):5-6.
[10]Pouton C W.Lipid formulation for oral administration of drugs:nonemulsifying,self-emulsifying and ‘self-microemulsifying’drug delivery systems[J].Eur J Pharma Sci,2000,11(Suppl):93-98.
[11]欧晓霞,汪征明,封 亮.熊果酸自微乳的制备及其生物利用度[J].中国实验方剂学杂志,2012,18(1):36-39.
