肺表面活性物质鼻内给药对豚鼠急性分泌性中耳炎的治疗作用△
2012-11-01朱正华胡炯炯郭燕明崔佳文费刚马兆鑫
朱正华 胡炯炯 郭燕明 崔佳文 费刚 马兆鑫
急性分泌性中耳炎(otitis media with effusion,OME)是以中耳积液及听力下降为主要特征的中耳炎性疾病,是耳鼻咽喉头颈外科多发病之一,尤其在儿童发病率较高[1-2]。临床治疗颇为棘手,若治疗不当将导致儿童听力障碍及言语发育不良。在美国,OME仍然是耳鼻喉科领域尚未解决的临床难题,每年有2200万患儿被诊断为OME;药物治疗失败后,约有100万儿童不得不接受鼓膜置管治疗,造成的直接和间接经济损失达40亿美元[3-4]。在我国虽然未见准确的统计数据,但从临床资料看也不容乐观。积极有效治疗OME对防聋、治聋具有重要意义。国内外学者在用表面活性物质治疗OME方面作了许多有益的探索,但是比较系统地建立OME实验动物模型,并应用生物性肺表面活性物质(pulmonary surfactant,PS)鼻内给药治疗OME还鲜有报道。
1 材料与方法
1.1 材料
1.1.1 灭活流感嗜血杆菌悬浮液 流感嗜血杆菌由复旦大学上海医学院病原生物系提供,孵育繁殖,制成细菌悬浮液(磷酸缓冲液pH=7),每毫升含108菌落或集群。水浴65℃ 30 min灭活细菌,接种前再做细菌培养,确保无细菌生长。
1.1.2 外源性肺表面活性物质 固尔苏(curosurf 3.0 mL:0.24 g;猪肺磷脂注射液),意大利凯西Chiesi Farmaceutici SPA生产,批号为H20100428。
1.2 造模和分组
1.2.1 豚鼠 OME模型的制作[5]氯胺酮70 mg/kg肌内注射+戊巴比妥钠30 mg/kg皮下注射全身麻醉(下同)。采用灭活的流感嗜血杆菌鼓室内注射,建立豚鼠OME的动物模型。动物模型的评估:耳内镜下观察鼓膜,声导抗鼓室图,听性脑干反应(auditory brainstem response,ABR)测听。
1.2.2 实验分组 50只杂色豚鼠,购自上海斯莱克实验动物有限公司(中国科学院上海实验动物中心),健康、耳廓反射灵敏,耳镜检查排除外耳道及中耳病变。随机取10只作为正常组(A组,随机数字表法,下同);40只造模,5 d后,31只造模成功(双侧中耳积液、听力下降),而后随机分为3组:造模组(B组)10只,造模后不作任何治疗;生理盐水组(C组)10只,以生理盐水滴鼻,给药方式同PS组;PS治疗组(D组)11只。根据 Chandrasekhar等[3]研究的沙土鼠给药剂量推算,每只豚鼠(体质量300~400 g)滴鼻给药4 mg/d,每次滴鼻含PS 1 mg(用生理盐水稀释至0.1 mL),双侧鼻腔2 mg,每天给药2次,连续7 d。
1.3 检测方法
1.3.1 鼓膜图 0°耳内镜(Hopkins 1218A,STORZ公司,德国)。耳内镜检查正常及OME豚鼠的鼓膜,并拍照存档。
1.3.2 声导抗鼓室图 GSI中耳分析仪(GSI,美国),1000 Hz纯音探头测试鼓室压图。
1.3.3 ABR 测听 ABR 仪(TDT,美国),全身麻醉下测定各组豚鼠的ABR阈值,记录ABR各波潜伏期和反应阈的变化。采用透皮针形电极,记录电极置颅顶中线,参考电极和零电极分置两侧耳后乳突皮下。声场开放式扬声器放置头部前方10 cm,给声刺激为短声(click),听力级(dB HL),刺激频率 11.1/s,带通滤波50~3000 Hz,叠加次数为 1000次,记录时程10 ms。测反应阈值时采用递减法,近反应阈值时递减5 dB。记录ABR阈值及90 dB时 ABR I、III、V波潜伏期。
1.4 统计学处理 采用SPSS19.0统计学软件对数据进行处理,计量数据采用单因素方差分析。
2 结果
2.1 耳内镜检查鼓膜图 A组豚鼠,鼓膜透亮,光锥存在(图1A)。造模后5 d鼓膜像紧张部前方见穿刺孔愈合,鼓膜充血内陷,鼓室积液。1周后B组见穿刺瘢痕,鼓膜充血减退,鼓膜内陷,光锥变形、变短,鼓室积液,可见液平(图1B);C组,较造模后5 d鼓膜充血减退,鼓膜内陷,光锥变形,鼓室积液,多数见液平(图1C)。D组,鼓膜充血进一步消退,形态大致正常,光锥存在,鼓膜稍浑浊,积液征基本消失(图1D)。
2.2 声导抗检测
2.2.1 声导抗鼓室图形态 A组:鼓室图A型,尖峰状,鼓室压0~ +100 da Pa。B组(鼓室注射后第12天):鼓室图仍平坦,B或C型鼓室图,鼓室压-100~-300 da Pa居多。C组:用药1周后,与B组类似,B或C型鼓室图,峰较平坦。D组:1周后,鼓室图多为B型,鼓室负压减小,±100 da Pa之间居多。
2.2.2 鼓室压 A组声导抗鼓室压(34±63)da Pa(均数 ±1.96 SD,95%可信区间,下同)。B组声导抗鼓室压降低到(-135±107)da Pa,和A组比较差异有统计学意义(P<0.001)。C组鼓室压(-118±93)da Pa,和B组比较,差异无统计学意义(P=0.257)。D组PS治疗1周后,声导抗鼓室压为(1±103)da Pa,和B组、C组比较,差异有统计学意义(P<0.001)(表1~2)。PS可以显著降低OME豚鼠中耳负压,改善通气。
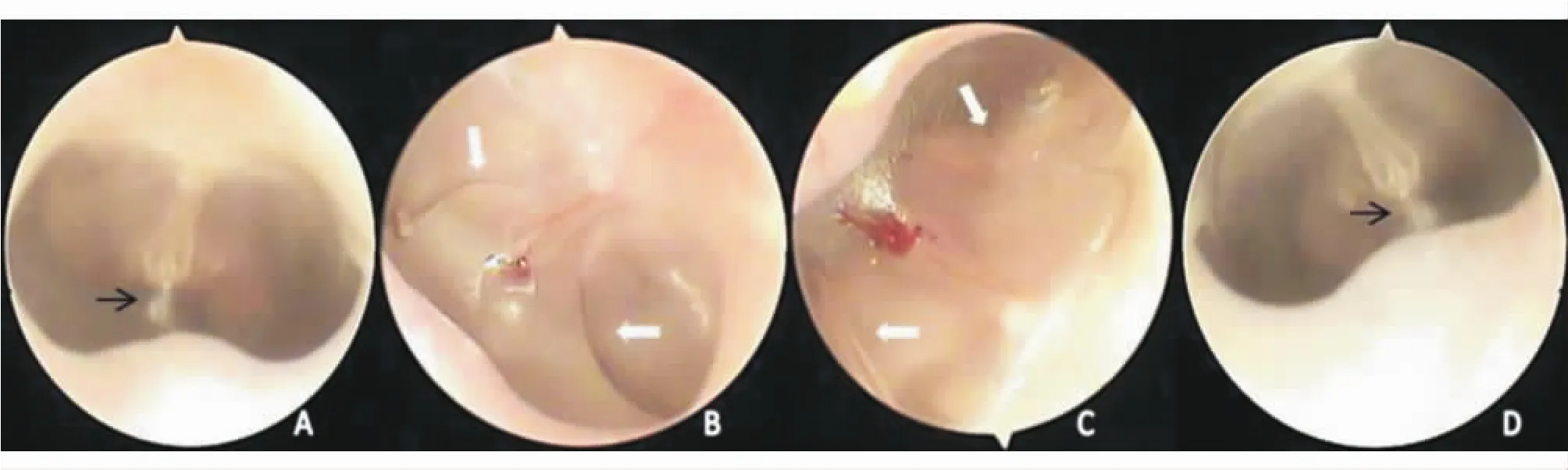
图1.A:鼓膜透亮,光锥存在(黑色箭头);B:鼓膜充血,鼓膜充血减退,穿刺孔愈合,鼓膜内陷,光锥变形,鼓室积液,见液平(白色箭头);C:鼓膜充血减退,鼓膜内陷,光锥变形,鼓室积液,见液平(白色箭头);D:鼓膜稍浑浊,光锥存在(黑色箭头),鼓室积液消失

表1 各组鼓室压(da Pa)

表2 各组鼓室压多重比较LSD
2.3 ABR阈值 A组反应阈值为(14.1±4.8)dB HL,B 组为(51.2 ±6.3)dB HL,与 A 比较,差异有统计学意义(P<0.001)。C组反应阈值为(52.8±7.1)dB HL,与 B组比较,差异无统计学意义(P=0.320)。D 组反应阈值为(27.4 ±8.8)dB HL,比 B 组和C组的反应阈降低了23~25 dB HL,差异有统计学意义(P <0.001)(表3~4)。

表3 ABR阈值(dB)

表4 各组反应阈值多重比较LSD
3 讨论
OME的病因虽未完全明了,但目前认为咽鼓管功能障碍、中耳局部感染和变态反应等是其主要病理基础,鼓室缺氧[6],负压形成,渗出增多形成积液。咽鼓管功能障碍是OME的主要病因。咽鼓管是平衡鼓室内外气压的唯一通道,平时关闭,吞咽时开放。它的开放不但与管壁的弹性回缩力有关,而且受管内液体表面张力的影响,要使咽鼓管开放所需压力必须克服管壁的弹性阻力和液体的表面张力。咽鼓管表面活性物质相关蛋白和磷脂协同作用形成了降低表面张力的活性特性[7]。咽鼓管表面活性物质具有维持咽鼓管通气、清除和保护功能[8]。
咽鼓管内表面活性物质缺乏是咽鼓管功能障碍的重要原因之一。1963年Flisberg[9]等提出了一种物质存在于咽鼓管的黏液层,能降低相对应的黏膜表面张力,有利于咽鼓管开放,其成分和PS类似。Hills[10]应用薄层色谱法对犬和兔咽鼓管冲洗液中的表面活性物质进行测定,发现有一定量的磷脂存在,主要成分为磷脂酰胆碱。Rapport等[11]研究了生理盐水冲洗前后豚鼠咽鼓管开放压的变化,发现咽鼓管用生理盐水冲洗后开放压提高,提示咽鼓管黏液层有能降低表面张力的活性物质。生理盐水冲洗除去了这些表面活性物质后,咽鼓管开放压升高,证明表面活性物质在维持咽鼓管正常功能中起着重要作用。Fornadley等[12]注射肺炎链球菌于沙土鼠的中耳腔内,建立OME模型,用一种表面活性物质注入具有OME沙土鼠的咽鼓管内,并以盐溶液和气体为对照观察表面活性物质对咽鼓管开放压的影响。结果表明表面活性物质能降低咽鼓管开放压,明显改善咽鼓管的通气功能,与对照组有显著差异。邱丽华等[13]随机选择OME患者做鼻咽部灌洗液中卵磷脂含量测定,结果显示OME患者卵磷脂含量比正常对照组明显减少,提示局部表面活性物质减少可能是OME发病机制之一。
Van Heerbeek等[14]研究牛PS在豚鼠咽鼓管的作用:外源性表面活性物质能减少咽鼓管的闭合力,降低开放压。Chandrasekhar等[3]通过动物实验证明:压力定量气雾剂表面活性物质鼻内单独或与类固醇激素合并给药,在正常或OME动物可降低咽鼓管开放压。
由于外源性咽鼓管表面活性物质难以制备,人工合成磷脂的活性远较咽鼓管表面活性物质差,因此探寻咽鼓管表面活性物质的替代品是解决问题的关键。从胚胎发生学角度看,咽鼓管也可以看作呼吸道的一部分,咽鼓管的黏膜为纤毛柱状上皮,是呼吸道黏膜衍化来的改良型呼吸道黏膜,咽鼓管鼓室黏膜在正常状态下的纤毛活动类似于呼吸道黏膜。Tsuruhara等[15]利用电子显微镜观察,证实在兔及豚鼠咽鼓管黏膜上有类似PS磷脂层状小体存在,嗜锇电子致密层小体是一种磷脂表面活化剂。Coticchia等[16]也用薄层色谱分析法分别测定了豚鼠咽鼓管冲洗液及肺冲洗液中的表面活性物质,并进行比较,在咽鼓管冲洗液中磷脂酰胆碱和磷脂酰乙醇胺为5∶1,而在肺内为8∶1;在咽鼓管冲洗液中磷脂酰胆碱和鞘磷脂的比为2∶1,而在肺内为67∶1。这些表明,咽鼓管表面活性物质和PS是相似的,其含量不同可能与咽鼓管和肺组织样本悬殊所致,但均以磷脂成分为主。
Ghadiali等[17]研究了黏膜表面的影响因素和PS作用于咽鼓管的机制,去除正常的咽鼓管黏液毯,即除去自身的表面活性物质,不能明显改变咽鼓管开放压,但能显著减少咽鼓管的顺应性并出现滞后现象。PS能显著降低咽鼓管开放压,包括减少气液界面张力,以致显著增加咽鼓管的顺应性。Duplessis[18]应用表面活性物质鼻喷治疗潜水人员的中耳气压伤,并认为咽鼓管的功能(被动开放压)变异较大。
相对于经鼓室给药,PS经鼻给药是一个有意义的尝试。前期研究鼓室给药取得了较好的疗效[19-20],鼓室给药属有创治疗,临床应用困难。本研究的主要目的是治疗小儿OME,因此研究鼻腔给药更具有临床治疗意义。声导抗鼓室图检查较耳内镜敏感性高,有动物研究表明,声导抗检查需要治疗更长时间才能完全恢复正常[21]。治疗1周后,D组大多数豚鼠耳内镜检查基本恢复正常;鼓室图检查仍然为B型(平坦型)。本实验A组鼓室压(34±63)da Pa。B组豚鼠声导抗鼓室压降低到(-135±107)da Pa。PS治疗1周后,声导抗鼓室压为(1±103)da Pa(D组)。C组鼓室压(-118±93)da Pa,和B组比较,差异无统计学意义。PS可以改善通气,显著降低OME豚鼠中耳负压,对OME有治疗作用。近期有学者应用多普勒振动仪观测,经鼻雾化吸入给药后,PS可以提高豚鼠鼓膜振动速度[22]。同样,鼓室图声导纳的分析中发现,PS可以显著改善OME豚鼠中耳顺应性,提高声顺峰值,可以减少传导性听力损失。
本试验A组豚鼠反应阈值为(14.1±4.8)dB HL。B组反应阈值上升到(51.2±6.3)dB HL。C组反应阈值为(52.8±7.1)dB HL,和 B 组比较,差异无统计学意义。PS治疗后,D组反应阈值降至(27.4±8.8)dB HL,与B组、C组比较,差异有统计学意义。表明PS滴鼻给药,可以改善降低OME豚鼠反应阈值,对于OME有治疗作用。
[1]程贤宁,袁友云,李杏,等.句容市幼儿耳部疾病现况调查[J].中国眼耳鼻喉科杂志,2011,11(5):315-317.
[2]Zhang Q,Wei J,Xu M,et al.Prevalence of otitis media with effusion among children in Xi'an,China:a randomized survey in China's mainland[J].Ann Otol Rhinol Laryngol,2011,120(9):617-621.
[3]Chandrasekhar SS,Mautone AJ.Otitis media:treatment with intranasal aerosolized surfactant[J].Laryngoscope,2004,114(3):472-485.
[4]Khanna R,Lakhanpaul M,Bull PD.Surgical management of otitis media with effusion in children:summary of NICE guidance[J].Clin Otolaryngol,2008,33(6):600-605.
[5]马兆鑫,杨绍风,陈旭辉,等.豚鼠分泌性中耳炎模型的建立[J].中华耳科学杂志,2003,1(1):52-54.
[6]黄秋红,郑亿庆.缺氧与缺氧诱导因子-1在分泌性中耳炎发病机制中的作用[J].中国眼耳鼻喉科杂志,2008,8(3):192-193.
[7]冯立宁,丛锐,姜斌,等.咽鼓管表面活性物质中相关蛋白的活性作用[J].第四军医大学学报,2003,24(1):23-25.
[8]van Heerbeek N,Tonnaer EL,Ingels KJ,et al.Effect of exogenous surfactant on ventilatory and clearance function of the rat's eustachian tube[J].Otol Neurotol,2003,24(1):6-10.
[9]Flisberg K,Ingelstedt S,Ortegren U.The valve and"locking"mechanisms of the eustachian tube[J].Acta Otolaryngol Suppl,1963,182(1):57-68.
[10]Hills BA.Analysis of eustachian surfactant and its function as a release agent[J].Arch Otolaryngol,1984,110(1):3-9.
[11]Rapport P,Lim D,Weiss H.Surface-active agent in Eustachian Tube Function[J].Arch Otolaryngol,1975,101(5):305-311.
[12]Fornadley JA,Burns JK.The effect of surfactant on eustachian tube function in a gerbil model of otitis media with effusion[J].Otolaryngol Head Neck Surg,1994,110(1):110-114.
[13]邱丽华,秦学玲,李芳碧.分泌性中耳炎患者鼻咽部表面活性物质的检测[J].中华耳鼻咽喉科杂志,1999,34(5):296.
[14]van Heerbeek N,Tonnaer EL,Ingels KJ,et al.Effect of exogenous surfactant on ventilatory and clearance function of the rat's eustachian tube[J].Otol Neurotol,2003,24(1):6-10.
[15]Tsuruhara K,Morii S,Kumazawa T.Ultracytochemical demonstration of phospholipids in the surface layer of the guinea pig eustachian tube[J].Acta Otolaryngol,1989,108(5-6):434-441.
[16]Coticchia JM,Heiselman FA,Gharbo R,et al.Surface active substances in the chinchilla tubotympanum.A biochemical study[J].Acta Otolaryngol,1991,111(6):1097-1104.
[17]Ghadiali SN,Banks J,Swarts JD.Effect of surface tension and sur-factant administration on Eustachian tube mechanics[J].J Appl Physiol,2002,93(3):1007-1014.
[18]Duplessis C,Fothergill D,Gertner J,et al.A pilot study evaluating surfactant on eustachian tube function in divers[J].Mil Med,2008,173(12):1225-1232.
[19]黄平,马兆鑫,陈旭辉,等.肺表面活性物质对豚鼠分泌性中耳炎的治疗作用[J].临床耳鼻咽喉科杂志,2005,19(13):605-606,610.
[20]马兆鑫,陈旭辉,李明,等.肺表面活性物质治疗豚鼠分泌性中耳炎前后咽鼓管的组织形态学变化[J].中华耳鼻咽喉科杂志,2003,38(6):445-447.
[21]Johnson D,Chandrasekhar SS,Mautone AJ.Intranasal phenylephrine-surfactant treatment is not beneficial in otitis media with effusion[J].Int J Pediatr Otorhinolaryngol,2008,72(7):1085-1089.
[22]Jang CH,Park H,Choi CH,et al.Efficacy of transnasal nebulized surfactant on experimental otitis media with effusion in guinea pig[J].Int J Pediatr Otorhinolaryngol,2010,74(1):71-74.
