枳实软化和切制的工艺研究
2012-11-01尹丽波赵启苗林桂梅贾天柱
尹丽波,赵启苗,林桂梅,侯 影,贾天柱
(1.辽宁中医药大学 药学院国家中医药管理局中药炮制重点研究室/辽宁省中药炮制工程技术研究中心,辽宁 大连 116600;2.辽宁中医药大学 杏林学院,辽宁 沈阳 110167)
枳实为芸香科植物酸橙Citrus aurantiumL.及其栽培变种或甜橙Citrus sinensis Osbeck的干燥幼果,味苦、辛、酸,性微寒,归脾胃经,具有破气消积、化痰散痞的功能,常用于积滞内停、痞满胀痛等症[1]。枳实主要有效成分有生物碱,如辛弗林、N-甲基酪胺等;黄酮类成分,如橙皮苷、柚皮苷和新橙皮苷等[2]。枳实历代有多种炮制方法,但均需先切制成枳实片,再根据需要按不同方法炮制。此外,清代吴仪洛在《本草从新》中也曾提出“药肆中俱切为饮片”,中药必须切成饮片才能用于临床[3]。目前,切制枳实饮片工艺控制主要凭经验,缺乏具体的工艺参数。本试验以辛弗林含量和柚皮苷、橙皮苷、新橙皮苷的含量及出膏率为指标对切制枳实工艺进行优选,为规范切制枳实的炮制工艺提供技术参数,为切制枳实饮片的质量控制提供一定的科学依据。
1 仪器与试药
FA1004B电子天平(上海精密科学仪器有限公司);METTLER AE240型十万分之一分析天平(瑞士METTLER);KQ-250DB型数控超声波清洗器(超声电功率250W,频率40kHz);DG101-2A烘箱;日本岛津LC-20AT液相色谱仪(SPD-M20A检测器,LC-20AB泵,CTO-20A柱温箱,SIL-20A自动进样器,CBM-20A数据转换模器);岛津LC-Solution色谱数据工作站。
枳实生品购自江西新干县,经鉴定为芸香科植物酸橙Citrus aurantiumL.的干燥幼果;辛弗林对照品(中国药品生物制品检定所,批号110727-200306);柚皮苷对照品(中国药品生物制品检定所,批号110722-200309),橙皮苷对照品(中国药品生物制品检定所,批号11072-200613);新橙皮苷(上海源叶生物科技有限公司,纯度>98%),娃哈哈纯净水;甲醇、乙腈为色谱纯;其他试剂均为分析纯。
2 方法与结果
2.1 辛弗林含量的测定
2.1.1 测定条件
色谱柱为Diamonsil C18(5μm,200mm×4.6mm);流动相:甲醇-磷酸水溶液(0.18%磷酸,0.22%十二烷基硫酸钠)58∶42;流速:1mL·min-1;柱温:40℃;检测波长:275nm;进样量:10μL。色谱见图1。
2.1.2 对照品溶液的制备
精密称取辛弗林对照品,置100mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀即得0.1852mg·mL-1的辛弗林对照品溶液。
2.1.3 供试品溶液的制备
取切制枳实样品适量,粉碎,取中粉1g,精密称定,置锥形瓶中,精密加入甲醇100mL,称定重量,超声提取30min后放冷,再称重,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液50mL至蒸发皿中,蒸干,称干膏重。干膏加甲醇溶解,移至10mL量瓶中,用甲醇稀释至刻度,摇匀,用微孔滤膜(0.45μm)滤过,备用。
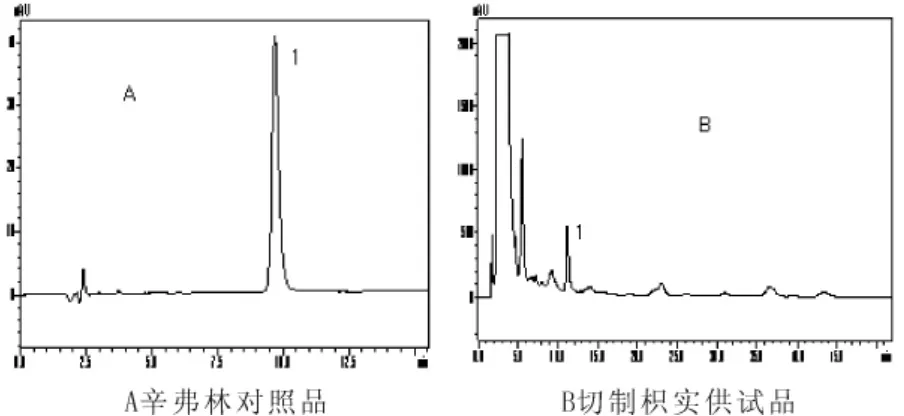
图1 辛弗林对照品及供试品色谱
2.1.4 方法学考察
(1)线性范围考察。精密吸取辛弗林对照品溶液1、2、5、10、15、20μL,按“2.1.1”项下操作,并测定峰面积积分值,以进样量(μg)为横坐标,峰面积为纵坐标进行线性回归,得辛弗林线性回归方程为Y=6E+06X-711551,相关系数r=0.9996。线性范围为0.1852~3.704μg/mL。
(2)精密度试验。精密吸取供试品溶液10μL,按“2.1.1”项下色谱条件连续进样6次,记录色谱图,测定峰面积积分值,结果RSD为1.8%,表明仪器精密度良好。
(3)稳定性试验。精密吸取供试品溶液10μL,分别于0、1、2、4、8、24h进样分析,按“2.1.1”项下操作,测定供试品中辛弗林含量,结果RSD为1.8%,表明供试品溶液在24h内稳定。
(4)重复性试验。取同一样品6份,按“2.1.3”项下制备供试品溶液,“2.1.1”项下色谱条件操作,分别进样10μL,测定各样品中辛弗林的平均含量为0.3312%,RSD为1.7%。
(5)加样回收率试验。精密称定6份已知含量枳实样品0.5g,分别加入0.8924mg·mL-1的辛弗林对照品溶液2mL,按照“2.1.3”项下操作,配制成供试品溶液,按“2.1.3”项下色谱条件进样操作,计算加样回收率,结果辛弗林的加样回收率为98.75%,RSD为1.6%。结果见表1。

表1 辛弗林加样回收率
2.2 柚皮苷、橙皮苷、新橙皮苷的含量测定
2.2.1 测定条件
色谱柱:Diamonsil C18(5μm,200mm×4.6mm);流动相:乙腈-0.1%磷酸水溶液(20.5∶79.5);流速:0.6mL·min-1;柱温:35℃;进样量:10μL;检测波长:283nm。色谱见图2。
2.2.2 对照品溶液的制备
精密称取柚皮苷对照品1.570mg,置50mL量瓶中,加甲醇溶解并稀释至刻度,得0.03140mg·mL-1的柚皮苷对照品溶液;精密称取橙皮苷对照品2.835mg,置50mL量瓶中,加甲醇溶解并稀释至刻度,得0.0567mg·mL-1的橙皮苷对照品溶液;精密称取新橙皮苷对照品2.355mg,置50mL量瓶中,加甲醇溶解并稀释至刻度,得0.0471 mg·mL-1的新橙皮苷对照品溶液。
2.2.3 供试品溶液的制备
按“2.1.3”项下方法操作制得的溶液,精密吸取2mL于100mL量瓶中,加甲醇溶解并稀释至刻度,用0.45μm的微孔滤膜滤膜滤过,备用。
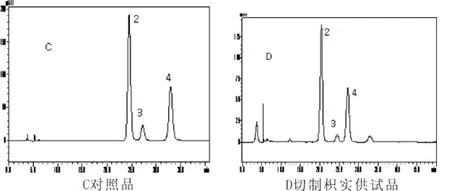
图2 黄酮类对照品及供试品色谱
2.2.4 方法学考察
(1)线性范围。精密吸取柚皮苷对照品溶液1、5、10、20、50、100μL,按“2.1.1”项下操作,测定峰面积积分值,以进样量(μg)为横坐标,峰面积为纵坐标进行线性回归,得出柚皮苷线性回归方程为Y=1E+07X-288165,相关系数r=0.9999。表明柚皮苷的进样量在0.0314~3.14μg/mL范围内线性关系良好。精密吸取橙皮苷对照品溶液1、2、5、10、15、20μL,按“2.1.1”项下色谱条件操作,测定峰面积积分值,以进样量(μg)为横坐标,峰面积为纵坐标进行线性回归,得出橙皮苷线性回归方程为Y=4E+06X+17543,相关系数r=0.9998。表明橙皮苷的进样量在0.0567~1.134 μg/mL范围内线性关系良好。精密吸取新橙皮苷对照品溶液1、5、10、20、50、100μL,按“2.1.1”项下色谱条件操作,测定峰面积积分值,以进样量(μg)为横坐标,峰面积为纵坐标绘制标准曲线,进行线性回归,得新橙皮柑线性回归方程为Y=8E+06X+129867,相关系数r=0.9999。表明新橙皮苷的进样量在0.0471~4.710μg/mL范围内范围内线性关系良好。
(2)精密度试验。精密吸取“2.2.2”项下供试品溶液,按“2.2.1”项下色谱条件操作,连续进样6次,结果测定供试品溶液中柚皮苷峰面积RSD为2.1%,橙皮苷峰面积RSD为1.5%,新橙皮柑峰面积RSD为2.4%,表明精密度良好。
(3)稳定性试验。精密吸取“2.2.3”项下供试品溶液10μL,分别于0、1、2、4、8、24h进样分析,按“2.1.1”项下色谱条件操作,结果测定柚皮苷峰面积RSD为1.4%,橙皮苷峰面积的RSD为1.9%,新橙皮苷的峰面积RSD为1.1%,表明供试品溶液在24h内稳定。
(4)重复性试验。取同批样品6份,按“2.2.3”项下制作供试品溶液,“2.2.1”项下色谱条件操作,进样10μL,测定各样品中柚皮苷的RSD为2.4%;橙皮苷的RSD为1.8%,RSD为1.7%。
(5)加样回收率试验。精密称定6份已知含量的枳实样品0.04g,分别加入1.8998mg·mL-1的柚皮苷对照品溶液2mL,按照“2.2.3”项下操作配制成6份加样供试品溶液,按照“2.2.1”项下色谱条件进样分析,柚皮苷的加样回收率为99.11%,RSD为1.2%。结果见表2。
精密称定6份已知含量的枳实样品0.35g,分别加入1.5047mg·mL-1的橙皮苷对照品溶液2mL,按照“2.2.3”项下操作配制成6份加样供试品溶液,按照“2.2.1”项下色谱条件进样分析,计算加样回收率,橙皮苷的加样回收率为98.05%,RSD为2.1%,结果见表3。
精密称定6份已知含量的枳实样品0.02g,分别加入1.2672mg·mL-1的新橙皮苷对照品溶液2mL,按照“2.2.3”项下操作配制成6份加样供试品溶液,按照“2.2.1”项下色谱条件进样分析,计算加样回收率,结果新橙皮苷的加样回收率为99.52%,RSD为1.3%,结果见表4。
3 枳实软化方法的正交试验
3.1 实验设计
根据预实验,选取浸泡法为枳实的软化方法。在软化过程中,考虑到软化时间(A)、软化温度(B)、软化加水量(C)三个因素为主要影响因素,故将这三个因素作为正交试验的考察因素,选用L9(3)4正交表安排实验,每个因素设计3个水平,因素水平安排见表5,按“2.1”和“2.2”项下色谱条件和制备方法分别测定枳实中辛弗林含量和黄酮(柚皮苷、橙皮苷、新橙皮苷)含量以及出膏率,用加权平均法计算综合评分,其中辛弗林的含量,黄酮总含量以及出膏率的权重分别为0.4,0.4和0.2。

表2 柚皮苷加样回收率

表3 橙皮苷加样回收率

表4 新橙皮苷加样回收率

表5 因素水平
3.2 试验方法
按正交试验表进行试验,取枳实药材100g,加入一定量水,在不同软化温度下软化。取样测定,根据测定结果计算综合评分。测定数据和计算结果分别见表6、表8,方差分析结果见表9。

表6 L9(3)4 正交试验结果

表7 正交试验结果分解

表8 枳实软化正交试验因素水平分析
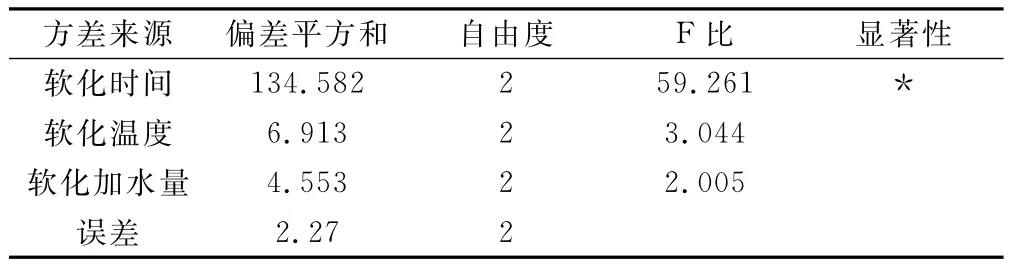
表9 方差分析
3.3 试验结果及分析
表7和表8结果显示:因素A对综合评分的结果有显著影响,因素B、C对结果无显著影响。极差分析认为各因素的主次顺序是A>B>C。最佳工艺条件为A3B3C2,即每100g药材使用100mL水,在温度为10℃下,软化12h。
4 枳实的切制研究
枳实的切制研究,先将枳实按以下方法进行切制:①横切,使药材的厚度为0.5mm;②横切,使药材的厚度为1~2mm;③横切,使药材的厚度为2~4mm;④纵切,使药材的厚度为0.5mm;⑤纵切,使药材的厚度为1~2mm;⑥纵切,使药材的厚度为2~4mm。分别取上述枳实切片按“2.1.2”和“2.2.2”项下方法制备成样品,分别测得上述6种样品中的指标,进行综合评分,分别为85.44,95.21,90.12,88.32,96.89,90.78。其中切制厚度为1~2mm枳实样品综合评分要明显高于切制成其他厚度的。切制方法的考察,横切与纵切对枳实样品的综合评分影响不大,且枳实药材切制过程中横切较纵切容易,故选用横切作为枳实的切制方法。
5 验证实验
为验证上述最佳工艺的科学性、稳定性和可重复性,进行了3次验证实验,结果表明正交实验结果准确、可靠。结果见表9。

表9 验证试验
6 讨论与结论
本实验在正交试验之前做过软化方法筛选的预实验,分别选取浸泡法、淋法和蒸法对枳实进行软化。结果表明,蒸法软化枳实药材时其指标性成分含量下降幅度较大,可能由于其高温的缘故,使枳实中的有效成分破坏。淋法与浸泡法软化的枳实药材则无明显差别,且浸泡法比淋法操作简单,容易掌握,结合实验结果并考虑到生产实际确定选择浸泡法为枳实药材的软化方法。枳实药材质地坚硬,需长时间浸润才能润透,但时间不宜过长,加水量不宜过多,以免伤水,软化药材时要以“药透水尽”为标准。枳实中有效成分辛弗林及黄酮类化合物若长时间高温加热,可导致其结构破坏,有效成分降低,故本实验枳实的软化温度因素考查范围规定为10~30℃[4,5]。
本实验还对枳实切片以后的烘干温度进行了初步试验,发现样品在恒温60℃的烘箱中烘干其有效成分损失不大,但烘干温度超过60℃,其有效成分损失很大,其主要原因可能是有效成分发生变化,故枳实切制后烘干温度不宜超过60℃。本试验认为枳实的软化方法为浸泡法,具体为每100g药材使用100mL水,在10℃下,软化12h。切制方法为横切,切制厚度为1~2mm,使得枳实的有效成分损失最小,综合评分最高。此种软化和切制工艺合理可行。本实验选择多指标进行综合评价枳实的软化和切制工艺条件,为中药切制工艺优选提供了较为科学、全面的思路,也符合中医药治疗疾病多成分综合作用的特点。
[1]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010:230.
[2]王文凯,刘红娜,雷丹.不同炮制方法对枳实中柚皮苷和新橙皮苷含量的影响[J].江西中医学院学报,2007,19(6):50.
[3]贾天柱.中药炮制学[M].上海:上海科学技术出版社,2008:66-67.
[4]王佳,周家雨,郭军伟,等.枳实中辛弗林和橙皮苷的联合提取工艺研究[J].天然产物研究与开发,2009,21(6):1058-1060.
[5]李荣,李俊.黄酮类化合物药理活性及其构效关系研究进展[J].安徽医药,2005,9(7):481-483.
