新疆葡萄酒产区优良酒类酒球菌的分离、鉴定
2012-10-27李翠霞杜立业
李翠霞,李 华,金 刚,杜立业,王 华,*
(1.西北农林科技大学生命科学学院,陕西 杨凌 712100;2.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;3.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100)
新疆葡萄酒产区优良酒类酒球菌的分离、鉴定
李翠霞1,2,3,李 华2,3,金 刚2,3,杜立业2,3,王 华2,3,*
(1.西北农林科技大学生命科学学院,陕西 杨凌 712100;2.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;3.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100)
为了分离筛选出适合葡萄酒酿造的优良酒类酒球菌(Oenococcus oeni)菌株,从我国新疆葡萄酒产区分离纯化出30株酒类酒球菌,依据形态特征、生理生化特性,它们均被鉴定为酒类酒球菌。分别对其进行单因子(pH值、酒精、SO2)耐受性实验,选出单因子抗性较好的9株菌进行复合因子(pH值×酒精×SO2)耐受性实验,结果表明,有3株酒类酒球菌具有较好的发酵适应性。最后通过Species-specific PCR以及16S rRNA序列同源性分析对其进行验证,并构建相应的系统发育树,系统发育分析表明所筛菌株与酒类酒球菌的同源性均达到了99%以上,说明本实验所筛选的9株性能较好的菌株均为酒类酒球菌。
酒类酒球菌;分离;鉴定;种属特异性;16S rRNA
酒类酒球菌(Oenococcus oeni)是葡萄酒进行苹果酸-乳酸发酵(malolactic fermentation,MLF)过程中的优势菌种,随着生物降酸技术的不断发展及应用,优良酒类酒球菌的筛选及鉴定越来越受到人们的关注,但是由于葡萄酒复杂的生态环境使得自然的MLF难以控制和预测,开发使用优良的酒类酒球菌发酵剂,不但可以实现葡萄酒的规模化生产,而且可以有效地控制葡萄酒的质量。我国独特、复杂的生态地理环境也决定了我国葡萄酒产区必定存在着优良的酒类酒球菌自然变异菌株,对其进行开发和利用对于改变我国葡萄酒的生产工艺具有非常重要的意义。
本研究采用梯度稀释涂平板的方法从酒精发酵结束的单品种葡萄酒中分离酒类酒球菌,通过生理生化实验、Species-specific PCR以及16S rRNA序列同源性分析相结合的方法对筛选的优良酒类酒球菌进行鉴定,并分别对其进行单因子(pH值、酒精、SO2)和复合因子(pH值×酒精×SO2)耐受性实验,以筛选出优良的酒类酒球菌,为我国优质葡萄酒的生产奠定基础。
1 材料与方法
1.1 样品、菌株与试剂
样品为新疆产区2010年酒精发酵结束后的单品种葡萄酒,葡萄品种分别为:赤霞珠、梅尔诺、佳美。
酒类酒球菌SD-2a由山东烟台地区自然苹果酸-乳酸发酵(M L F)的葡萄酒中分离鉴定得到,专利号为02123444.2,由西北农林科技大学葡萄酒学院提供;嗜酸乳杆菌(编号6005)由中国工业微生物菌种保藏中心提供。
放线菌酮(Actidione) 上海汉博生物科技有限公司;万古霉素(Vancocin) 美国Eli Lilly公司;溶菌酶、十六烷基三甲基溴化铵 (CTAB) 美国Amresco公司;蛋白酶K 德国Merck公司;RNA酶(Rnase) 天根生化科技(北京)有限公司;Tris-饱和酚、脱氧核糖核苷三磷酸(dNTP)、TaqDNA 聚合酶 日本TaKaRa公司。
1.2 培养基
ATB基础培养基[1]:蛋白胨1%、酵母浸出物0.5%、葡萄糖1%、MgSO4·7H2O 0.02%、MnSO4·4H2O 0.005%、盐酸半胱氨酸0.5g/L、番茄汁25%、液体培养基调节pH值至4.8,固体培养基调节pH值至5.0,并向其中加2.0%的琼脂,115℃灭菌20min。ATB分离培养基[1]:ATB基础培养基中分别加入放线菌酮50mg/L、万古霉素50mg/L。改良的MRS培养基[2]:蛋白胨1%、酵母提取物0.5%、牛肉膏1%、葡萄糖2%、无水醋酸钠0.3%、柠檬酸二铵0.2%、吐温-80 0.1%、磷酸氢二钾0.2%、MgSO4·7H2O 0.02%、MnSO4·4H2O 0.005%、盐酸半胱氨酸0.05%、调节培养基pH6.8,固体培养基中加2.0%的琼脂粉,121℃灭菌20min。
1.3 仪器与设备
Centrifuge 5804高速冷冻离心机 德国Eppendorf公司;PHS-3B型精密pH计 上海雷磁场仪器厂;752分光光度计 上海第三分析仪器厂;Veriti梯度基因扩增仪 美国ABI公司;凝胶成像分析系统 英国Sysgene公司。
1.4 方法
1.4.1 菌株的培养
1.4.1.1 酒类酒球菌分离纯化
采用梯度稀释涂平板的分离方法[3],将酒精发酵结束的葡萄酒梯度稀释为:10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8后,吸取0.1mL涂于ATB分离培养基上对菌株进行分离,27℃厌氧箱中充氮气培养5~7d,挑取ATB分离培养基上菌落形态[4]为乳白色、光滑、菌落直径小于1mm的单菌落反复进行划线分离直至纯化。
1.4.1.2 嗜酸乳杆菌培养
参照文献[5]进行,将5%嗜酸乳杆菌接入改良的液体MRS培养基,静置37℃培养48h,然后置于37℃固体划线密封培养30h,挑取单菌落进行液体扩大培养48h。
1.4.2 菌株抗性筛选
1.4.2.1 单因子抗性实验[6]
(1) 酒类酒球菌对pH值的抗性
将ATB基础培养基沸水浴30min,10000r/min 离心15min至澄清,用KOH或HCl调节pH值分别为3.4、3.2、3.0,115℃灭菌20min后,以5×107CFU/mL的接种量分别接入处于对数生长期(pH4.8,ATB基础培养基)的供试菌株,27℃静置培养,用比浊法对菌密度(OD600nm)进行测定,10d后菌密度仍小于5×107CFU/mL为不生长。
(2) 酒类酒球菌对SO2的抗性
将ATB基础培养基沸水浴30min,10000r/min 离心15min至澄清,115℃灭菌20min后,分别调节总SO2质量浓度为20、30、50mg/L,以5×107CFU/mL的接种量分别接入处于对数生长期(pH4.8,ATB基础培养基)的供试菌株,27℃静置培养,用比浊法对菌密度(OD600nm)进行测定,10d后菌密度仍小于5×107CFU/mL为不生长。(3) 酒类酒球菌对酒精的抗性
将ATB基础培养基沸水浴30min,10000r/min 离心15min至澄清,115℃灭菌20min后,分别调节酒精体积分数为10%、12%、14%,以5×107CFU/mL的接种量分别接入处于对数生长期(pH4.8,ATB基础培养基)的供试菌株,27℃静置培养,用比浊法对菌密度(OD600nm)进行测定,10d后菌密度仍小于5×107CFU/mL为不生长。
1.4.2.2 复合因子筛选实验
参照Britz等[7]的方法,将能在所有单因子抗性条件下生长的菌株设定为单因子抗性较好的菌株,用单因子抗性较好的菌株进行复合因子(酒精×pH值×SO2)筛选实验,采用不完全正交试验设计,3个因素,共15个处理,如表1所示。

表1 菌株3因子(pH值×酒精×SO2)筛选实验设计Table 1 Experimental design for strain screening
1.4.3 菌株鉴定
1.4.3.1 形态学鉴定
对菌株纯化后ATB分离培养基平板上菌落形态为乳白色、光滑、单菌菌落直径小于1mm的初筛菌株进行革兰氏染色实验[2]、过氧化氢酶实验[8],然后再参照文献[9]对其进行镜检。
1.4.3.2 苹果酸分解实验
将初筛菌株按107CFU/mL的接种量接入含有3g/L的L-苹果酸、pH4.8的ATB培养基中,每隔12h进行一次纸层析监测,并观察苹果酸斑点的变化,苹果酸斑点消失即为苹果酸分解完毕[10]。
1.4.3.3 生理生化特性鉴定
根据张春晖等[4]、Holt等[11]、Dicks等[12]对酒类酒球菌生理生化特征的描述标准,并结合其酿酒适应性对初筛菌株进行鉴定。
1.4.3.4 分子生物学鉴定
(1) 菌株总DNA的提取
取5mL处于对数生长期的菌液进行离心收集,加入1mL TE缓冲液洗涤两遍,离心后加入0.55mL TE缓冲液重悬并加入20μL 50mg/mL溶菌酶,振荡混匀后37℃温浴1h,然后加入30μL 10% SDS和10μL 20mg/mL蛋白酶K于37℃温浴3h,接着加入100μL 5mol/L NaCl和80μ L CTAB-NaCl于65℃温浴30min,5 μ L 10mg/mL RNA酶37℃温浴3h,然后用等体积的酚、氯仿、异戊醇(25:24:1,V/V)抽提2~3次至无蛋白膜出现,再用氯仿、异戊醇(24:1,V/V)抽提1~2次至无蛋白膜出现,收集上清液并用50μL、3mol/L NaAc和500μL冷的异丙醇使其沉淀,12000r/min 离心10min后弃去上清液,沉淀用75%乙醇洗涤两次,加入 60μL TE缓冲液溶解,最后在100V电压条件下用1%琼脂糖电泳约40min检测所提取的DNA,并作为PCR扩增模板。
(2) 种属特异性PCR(species-specific PCR)
参照文献[13],引物序列为On1:TAATGTGGTT CTTGAGGAGAAAAT;On2:ATCATCGTCAAAC AAGAGGCCTT,由上海生工生物工程技术服务有限公司合成。
PCR反应体系(20μL):以基因组DNA为模板,2.0μL 10×PCR buffer,1.6μL 2.5mmol/L dNTPs,1.6μL 25mmol/L Mg2+,10μmol/L上下游引物各0.8μL,0.5UTaq酶,2.0μ L模板DNA,用灭菌ddH2O补至2μL。
PCR扩增条件:94℃预变性5min;94℃变性45s,64℃退火2min,72℃延伸2min,共35个循环;72℃末端延伸10min。然后将5 μL PCR产物与1.5 μL 6×Loading buffer混合后在100V电压条件下用1%琼脂糖电泳40min进行检测。
(3) 16S rRNA的PCR扩增
参照文献[14-16],用上述制备的DNA为模板进行16S rRNA序列扩增,引物序列为On1(41~60bp):5′-GCGGCGTGCCTAATACATGC- 3′和 On2(686~705bp):5′-ATCTACGCATTTCACCGCTA- 3′,由上海生工生物工程技术服务有限公司合成。
PCR反应体系(50μL):5μL 10×PCR缓冲液,Mg2+2.5mmol/L,dNTP 0.2mmol/L,上下游引物各0.5μmol/L,1.5UTaq酶,2μL DNA模板,用灭菌ddH2O补至50μL。
PCR扩增条件:94℃预变性5min;94℃变性1min,50℃退火1min,72℃延伸2min,共35个循环;72℃末端延伸10min。然后将3μL PCR产物与1μL 6×Loading buffer混合后在100V电压条件下用1%琼脂糖电泳40min进行检测,PCR扩增片段约为705bp,对合格的样品送往华大基因科技股份有限公司进行纯化、回收和测序。将所测菌株的16S rRNA 序列与GenBank中已知的乳酸菌序列进行Blast相似性分析,鉴定菌种的归属,并用ClustalX 1.83序列分析软件和MEGA 3.1遗传分析软件对其进行系统发育树构建。
2 结果与分析
2.1 酒类酒球菌的分离纯化结果
图1 初筛菌株菌落形态Fig.1 Morphology of preliminarily screened O. oeni

图2 初筛酒类酒球菌革兰氏染色(a)、电镜图(b)Fig. 2 Gram stain and electron microscope photographs of O. oeni
筛选出30株菌,菌落形态均为乳白色、光滑、菌落直径小于1mm(图1),革兰氏染色均为阳性(图2a);过氧化酶阴性;并均能将L-苹果酸分解成乳酸,同时按照文献[9]镜检发现,菌株的细胞均呈椭圆或球形,成对或是成链排列,不运动,不形成芽孢(图2b);符合《乳酸细菌分类鉴定及实验方法》[8]中对酒类酒球菌属细菌形态学的描述标准,可初步推断为酒球菌属细菌。
2.2 酿酒适应性实验
pH值、酒精、SO2是构成葡萄酒理化性质的重要组成成分,直接影响着酒类酒球菌在葡萄酒中的生存和生长,不同菌株对pH值、酒精、SO2的抗性不同,因此,综合考虑酒类酒球菌对这3个因子的耐受性对于筛选优良的酒类酒球菌非常必要。
2.2.1 单因子抗性筛选
通过研究筛选出的30株菌对pH值、酒精、SO2的单因子抗性,选出9株单因子抗性较好的菌株,分别编号为:XJ-1a、XJ-1b、XJ-2a、XJ-2b、XJ-2c、XJ-3a、XJ-3b、XJ-4a、XJ-5a。
2.2.1.1 菌株对pH值的抗性

图3 不同pH值对酒类酒球菌生长的影响包Fig.3 Effect of pH on the growth of O. oeni
葡萄酒中的pH值是影响酒类酒球菌生长的重要因素,直接决定着MLF的正常启动,由图3可以看出,随着pH值的不断降低,对菌株的抑制作用不断增强,当pH值为3.4时,XJ-1a的OD值最大,pH值为3.2、3.0时,对照菌株SD-2a和菌株XJ-1a、XJ-1b、XJ-2c、XJ-2a、XJ-3a均表现出了良好的抗性。
2.2.1.2 菌株对SO2的抗性
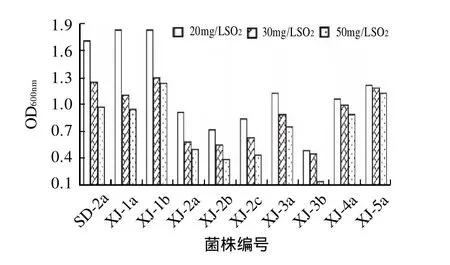
图4 不同质量浓度SO2对酒类酒球菌生长的影响Fig.4 Effect of SO2 on the growth of O. oeni
SO2作为葡萄酒酿造过程中广泛使用的抗氧化剂,对细菌的生长具有明显的抑制作用,由图4可以看出,随着SO2添加量的不断增加,对菌株生长的抑制作用不断增强,而且不同菌株对SO2的抗性也不同,在这9株单因子抗性较好的菌株中,除了XJ-3b对SO2抗性能力比较弱以外,其他菌株在SO2质量浓度为50mg/L时,OD值均在0.4以上。
2.2.1.3 菌株对酒精的抗性
酒精也是酒类酒球菌在葡萄酒中生长的重要抑制因子,随着酒精含量的不断增加,菌株的生长量也在明显减少,不同菌株对酒精的抗性也有很大的差异,如图5所示,在这9株单因子抗性较好的菌株中,与对照菌株SD-2a相比,XJ-2a具有较强的耐酒精生长能力,而且其他菌株对14%的酒精也具有明显的抗性。
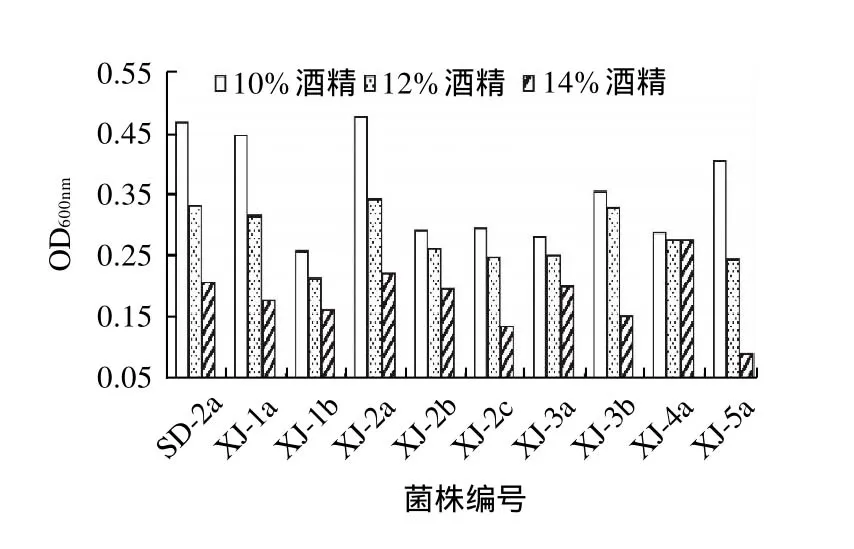
图5 不同体积分数酒精对酒类酒球菌生长的影响Fig.5 Effect of ethanol on the growth of O. oeni
2.2.2 3因子抗性筛选结果

图6 酒精×pH值×SO2对酒类酒球菌生长的影响Fig.6 Combinatorial effect of ethanol, pH and SO2 on the growth of O. oeni
葡萄酒是一个复杂的生长环境,因此,考察菌株对pH值、酒精、SO2复合因子的耐受性对研究菌株的酿酒适应性非常重要。图6结果表明,随着选择压的不断增大,对单因子具有较强抗性的9株菌的生长量均明显减小,但不同菌株生长量减小的幅度不同,其中XJ-1b、XJ-5a生长量减小幅度较大,XJ-2a、XJ-2b、XJ-3a生长量减少幅度较小。通过对菌株在不同抗性条件下的生长量进行方差分析(表2)表明,XJ-2a生活能力最强,XJ-2b、XJ-3a次之,均与对照菌株SD-2a无明显差异,其他菌株生长较弱,因此,XJ-2a、XJ-2b、XJ-3a为酿酒适应性较强的酒类酒球菌。

表2 不同胁迫条件下菌株生长量方差分析Table 2 Variance analysis for bacterial biomass under different stress conditions
2.3 菌株的鉴定
2.3.1 生理生化实验鉴定结果
通过对分离菌株进行苹果酸分解实验、石蕊牛奶实验,以及碳源产酸情况等鉴定指标的考察,结果表明,所筛菌株均符合文献[14]中对酒类酒球菌的描述标准,因此初筛菌株可鉴定为酒类酒球菌。
2.3.2 分子生物学鉴定结果
2.3.2.1 种属特异性PCR
对所筛选的单因子抗性较好的9株菌、阳性对照O.oeni-SD-2a、阴性对照嗜酸乳杆菌(Lactobacillus acidophilus)进行种Species-specific PCR实验。结果表明,本实验所筛选的9株菌以及阳性对照菌株SD-2a均能扩增出苹果酸-乳酸酶基因1025bp的唯一条带,且条带清晰,而嗜酸乳杆菌则未扩增出来(图7),可推断本实验所筛选的9株菌均为酒类酒球菌。

图7 我国新疆葡萄酒产区筛选的9株酒类酒球菌的Species-specific PCR鉴定Fig.7 Species-specific PCR of O. oeni strains isolated from Xinjiang wines
2.3.2.2 16S rRNA的PCR扩增结果
分别以各菌株的总DNA为模板进行16S rRNA 的PCR扩增,9株实验菌株和对照菌株O.oeni-SD-2a均得到了约705bp的扩增产物(图8)。
将PCR产物送华大基因科技股份有限公司进行测序,并将结果提交到NCBI/GenBank,用Blast程序与GenBank数据库中已知乳酸菌的16S rRNA基因序列进行相似性比较分析,结果发现,这9株菌的测序结果与数据库中酒类酒球菌的同源性均达到了99%以上,说明本实验所筛选的9株菌均为酒类酒球菌。将这9株菌和链球菌科7个属各自模式菌株的16S rRNA核苷酸序列比对后,以核苷酸序列为分子标记,用MEGA3.1软件包中的邻接法构建了16个菌种的系统发育树(图9),从系统发育树中可以看出,本实验所筛的9株菌与模式菌株O.oeni-PSU-1(NC_008528)处于相同的位置,通过对实验菌株与链球菌科中7个属模式菌16S rRNA基因序列建立的相似性矩阵(图10)可以看出:9株实验菌株的基因序列与O.oeni-PSU-1、O.oeni-SD-2a的相似性均为100%,再次验证了本实验所筛选的9株菌为酒类酒球菌,且Leuconostoc mesenteroides与O.oeni亲源关系相对较近,相似性达到了84%,其次是魏斯氏菌属。通过16S rRNA序列分析验证了所分离的9株菌为酒类酒球菌。
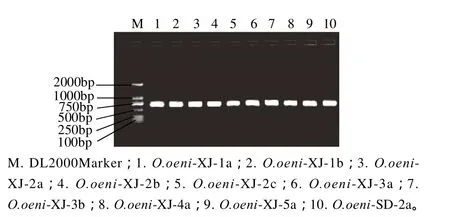
图8 酒类酒球菌16S rRNA基因PCR产物的琼脂糖凝胶电泳图Fig.8 Agarose gel electrophoresis of 16S rRNA PCR products
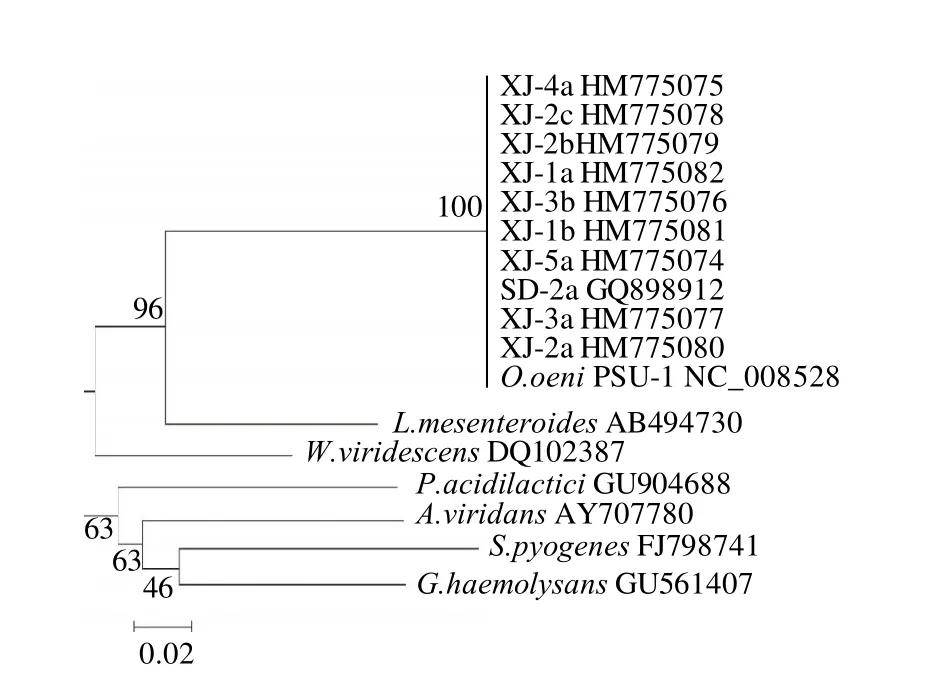
图 9 酒类酒球菌与链球菌科7个属的模式菌的16S rRNA构建的系统进化树Fig.9 Phylogenetic tree based on 16S rRNA sequences of O. oeni and model strains of 7 genera from Streptococcaceae

图10 酒类酒球菌与链球菌科中7个属的模式菌的16S rRNA基因序列的相似性矩阵Fig.10 Similarity matrix of 16S rRNA gene sequences of 7 genera from Streptococcaceae and O. oeni
3 讨 论
由于传统的生理生化鉴定不能满足菌种精确鉴定的需要,16S rRNA序列同源性分析不仅费时而且测序成本较高,在初筛菌株归属不明确且量较大的情况下采用16S rRNA序列同源性分析对菌种进行鉴定十分浪费,且种属特异性 PCR也可能出现假阳性的现象,因此可以先用属特异性 PCR对初筛菌株进行鉴定,然后再通过16S rRNA序列同源性分析对其进行验证,便可更加可靠的实现菌种的鉴定。
本实验从新疆产区自然MLF发酵的葡萄酒中,通过对菌株个体和菌落形态的观察,结合生理生化实验、初步分离纯化出30株酒类酒球菌。通过对其生长特性以及单因子酿酒适应性的研究表明,有9株酒类酒球菌具有较好的酿酒适应性,并用种属特异性PCR及16S rRNA的序列同源性分析对其进行了进一步的验证。然后用单因子抗性较好的9株酒类酒球菌进行复合因子耐受性实验,结果表明:XJ-2a、XJ-2b和XJ-3a具有良好的酿酒适应性,可以将其作为葡萄酒MLF的优良发酵菌种来使用。这也说明通过对自然MLF葡萄酒中酒类酒球菌的筛选可获得具有良好酿酒适应性的菌株。在本研究的基础上,本课题组还将对具有优良酿酒适应性的菌株进行苹果酸-乳酸发酵活力和酿酒特性进行测定,筛选出具有良好的酿酒适应性以及优良的发酵特性的菌株供商业生产使用。
[1]张春晖. 中国优良酒类酒球菌的分离筛选及MLF研究[D]. 杨凌: 西北农林科技大学, 2001.
[2]钱存柔, 黄仪秀. 微生物学实验教程[M]. 北京: 北京大学出版社, 1999.
[3]FUGELSANG K C. Wine microbiology[M]. New York: Chapman&Hall, 1997.
[4]张春晖, 李华. 葡萄酒微生物学[M]. 西安: 陕西人民出版社, 2003: 136-137.
[5]张帆, 王建华, 刘立恒, 等. 嗜酸乳杆菌的培养条件及其生物学特性[J]. 食品与发酵工业, 2005, 31(3): 43-46.
[6]VAILLANT H, FORMISYN P, GERBAUX V. Malolactic fermentation of wine: study of the influence of some physico-chemical factors by experimental design assays[J]. Appl Bacteriol, 1995, 79: 640-650.
[7]BRITZ T J, TRACEY R P. The combination effect of pH, SO2, ethanol and temperature on the growth ofLeuconostoc oenos[J]. Appl Bacteriol, 1990, 68: 23-31.
[8]凌代文. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999: 57-58.
[9]程丽娟, 薛泉宏. 微生物学实验技术[M]. 西安: 世界图书出版西安公司, 2000: 21.
[10]HENICK-KLING T, SANDINE W E, HEATHERBELL D A. Evaluation of malolactic bacteria isolated from oregon wine[J]. Appl Environ Microbiol, 1989, 8: 2010-2016.
[11]HOLT J G, KRIEG N R, SNATH P H A, et al. Bergey,s manual of determinative bacteriology[M]. 9th ed. Batimore: Williams and Wilkins, 1993.
[12]DICKS L M T, DELLAGLIO F, COLLINS M D. Proposal to rechssifyLeuconostoc oenosasOenococcus oeni[J]. Bacteriol, 1995, 45(2): 395-397.
[13]ZAPPAROLI G, TORRIANI S, PESENTE P, et al. Design and evaluation of malolactic enzyme gene targeted primers for rapid identification and detection ofOenococcus oeniin wine [J]. Appl Microbiol, 1998, 27: 243-246.
[14]KUWAHARA T, NORIMATSU I, NAKAYAMA H, et al. Genetic variation in 16S-23S rDNA internal transcribed spacer regions and the possible use of this genetic variation for molecular diagnosis ofBacteroidesspecies[J]. Microbiology and Immunology, 2001, 45(3): 191-199.
[15]杨士章, 张焕新, 施帅, 等. 板鸭中优势乳酸菌的分离、筛选及鉴定[J]. 食品科学, 2010, 31(7): 242-246.
[16]金刚. 中国葡萄酒主产区酒酒球菌的鉴定及SE-AFLP分析[D]. 杨凌:西北农林科技大学, 2010.
Isolation and Identification of ExcellentOenococcus oenifrom Xinjiang Wines
LI Cui-xia1,2,3,LI Hua2,3,JIN Gang2,3,DU Li-ye2,3,WANG Hua2,3,*
(1. College of Life Science, Northwest A&F University, Yangling 712100, China; 2. College of Enology, Northwest A&F University, Yangling 712100, China;3. Shaanxi Engineering Research Center for Viti-Viniculture, Yangling 712100, China)
In order to screenOenococcusoeniwith good performance for malolactic fermentation (MLF), 3 strains ofO. oeniwere isolated and purified from Xinjiang wines, and identified preliminarily asO. oenibased on morphological, physiological and biochemical analyses. Their resistance to individual stress conditions such as pH, ethanol or SO2 was determined. In addition, the growth of 9 screened strains under the combinatorial external stress of ethanol, pH and SO2 was also evaluated. The results indicated that 3 strains had better adaptation capability to adverse conditions. The species-specific PCR and homology analysis of 16S rRNA sequence also supported our results. Moreover, a phylogenetic tree was established based on the 16S rRNA sequence ofO. oeni. The results of 16S rRNA sequencing showed that this strain was 99% homologous toO. oeni, so indicated that 9 screened strains with better performace wasO. oenispecies.
Oenococcus oeni;isolation;identification;species-specific PCR;16S rRNA
Q93.331
A
1002-6630(2012)01-0141-06
2011-01-23
农业部“948”项目(2009-Z29)
李翠霞(1985—),女,硕士,主要从事葡萄酒微生物学研究。E-mail:licuixiapujiu@163.com
*通信作者:王华(1959—),女,教授,博士,主要从事葡萄与葡萄酒学研究。E-mail:wanghua@nwsuaf.edu.cn
