高去酰胺蛋白酶产生菌的诱变选育及产酶条件优化
2012-10-27那治国马永强韩春然石彦国
那治国,马永强*,韩春然,石彦国
(1.黑龙江东方学院食品与环境工程学部,黑龙江 哈尔滨 150086;
2.哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150076)
高去酰胺蛋白酶产生菌的诱变选育及产酶条件优化
那治国1,马永强2,*,韩春然2,石彦国2
(1.黑龙江东方学院食品与环境工程学部,黑龙江 哈尔滨 150086;
2.哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150076)
以地衣芽孢杆菌2709为出发菌株,采用氮离子注入技术,在最佳注入剂量为1.5×1015ions/cm2的条件下进行诱变处理,筛选得到一株去酰胺度高达48.99%的突变株SDL-9,去酰胺度提高了85.57%,而肽键水解度相对较弱。并对SDL-9的产酶条件进行优化,结果表明:最佳碳源为质量浓度为2.0g/100mL的玉米粉,最佳氮源为质量浓度3.0g/100mL的大豆蛋白,质量浓度为0.04g/100mL Fe3+对产酶具有明显的促进作用,质量浓度为0.9g/100mL谷氨酰胺对产酶有明显的诱导作用,最佳起始pH值为7.0,最佳发酵温度35℃,在此条件下进行发酵产酶,测得去酰胺度为57.1%,肽键水解度为13.2%。
氮离子注入;去酰胺;碱性蛋白酶
离子注入技术是20世纪80年代兴起的一种材料表面处理技术。1986年中国科学院等离子体物理所余增亮发现N+离子注入水稻种子的诱变作用,证实了质量(粒子)沉积生物效应的存在,开辟了低能离子与物质相互作用这一新的研究方向[1-2],是育种方法学的重要创新并从国内走向世界。它与传统的诱变源如X射线、γ射线、UV射线以及化学诱变剂相比,离子注入除有能量沉积外,还有动量传递、质量沉积及电荷交换等效应[3-4],所以离子束注入技术是一种集理化诱变因子于一体的综合技术方法,具有高效、高定向性、损伤轻、突变谱广的特点[5-6]。经过多年努力,该技术在植物、动物和微生物品种改良上取得了良好效果[7-9],为生物的遗传改良开辟了一条新的途径,引起了国内外学者的广泛关注。
去酰胺是近年来在蛋白改性研究中备受关注的研究课题之一,由于蛋白肽链上的酰胺基对蛋白质的高级结构形成的贡献率较高,所以对蛋白质的溶解性、乳化性性等具有重要影响。由此,研究者希望能通过部分脱除蛋白肽链上的酰胺基,达到改善蛋白质某些功能特性的目的。常用的去酰胺改性方法包括物理方法、化学方法和生物酶法。由于物理方法和化学方法在去酰胺改性上存在一定的不足[10-13],而随着酶工业、固定化酶技术和膜反应器的不断发展,酶解过程更趋于自动化、简单化,酶法去酰胺改性已成为一种趋势。在酶法去酰胺改性中,常用的酶有木瓜蛋白酶、胰凝乳蛋白酶、转谷氨酰胺酶以及微生物碱性蛋白酶等,由于动物蛋白酶、植物蛋白酶存在提取生产复杂,价格昂贵等缺点,而微生物碱性蛋白酶虽然具有原料来源低廉、安全性高等优点,但现有的碱性蛋白酶去酰胺能力普遍不高,所以去酰胺改性的应用受到了限制[14-15]。因此,随着我国大豆蛋白产业的发展,应用诱变技术筛选高去酰胺活性碱性蛋白酶产生菌显得尤为重要。本研究采用氮离子注入技术对地衣芽孢杆菌进行诱变处理,筛选高去酰胺活性碱性蛋白酶产生菌,并优化其产酶条件,以期为高去酰胺活性碱性蛋白酶的发酵生产及应用提供理论参考。
1 材料与方法
1.1 菌种与培养基
地衣芽孢杆菌2709(Bacillus licheniformis2709) 中国工业微生物菌种保藏管理中心(编号10266)。
平板培养基:牛肉膏0.5g、蛋白胨1.0g、NaCl 0.5g、琼脂1.5g、蒸馏水100mL,pH7.2。种子培养基:牛肉膏1.0g、蛋白胨1.0g、NaCl 0.5g、蒸馏水100mL,pH7.0~7.2。基础发酵培养基:可溶性淀粉1.0g、麸皮1.0g、黄豆饼粉2.0g、酵母膏2.0g、Na2HPO40.2g、KH2PO40.1g、CaCO31.0g、蒸馏水100mL,pH7.0~7.2。
1.2 试剂与仪器
大豆分离蛋白(A型) 哈高科大豆食品有限责任公司;茚三酮(分析纯) 北京亚太龙兴化工有限公司;甘氨酸 天津市大陆化学试剂厂;谷氨酰胺 中国惠世生化试剂有限公司。
多功能等离子体浸没离子注入装置 哈工大材料科学与工程学院研制;UDK152型全制动凯氏定氮仪 意大利威尔普公司;KYC-100型恒温摇床 北京晨曦勇创科技有限公司;LRH-250型生化培养箱 上海一恒科学仪器有限公司;CL-32L自动高压灭菌器 日本ALP公司;TGL-16型台式高速冷冻离心机 湘仪离心机仪器有限公司。
1.3 方法
1.3.1 菌株的发酵产酶
将供试菌株在种子培养基中培养到对数生长期后作为种子液,以体积分数2%的接种量接种于装有30mL基础发酵培养基的100mL三角瓶中,于30℃、140r/min摇床发酵48h后,10000r/min离心10min,取上清液,即得粗酶液。
1.3.2 氮离子注入诱变处理
菌膜的制备:将活化后的地衣芽孢杆菌2709,在30℃、140r/min条件液体种子培养到对数增殖期中期后,制成细胞浓度约为108个/mL的菌悬液。取0.4mL菌悬液采用无菌操作,涂布于灭菌的小铝盒(直径2cm)内,无菌室下自然风干后立即进行氮离子注入诱变处理。
氮离子注入诱变处理:将菌膜放入氮离子注入机中,在真空度为6.0×10-1Pa,注入能量为25keV,注入剂量为0.5×1015~2.5×1015ions/cm2的条件下进行氮离子注入处理,同时做真空对照。诱变后用无菌脱脂棉,蘸无菌生理盐水,仔细擦带菌株的小铝盒,将脱脂棉放入5mL含玻璃珠无菌生理盐水中,振荡器振荡3min,得到诱变后的菌悬液。最后按平板菌落计数法,进行梯度稀释、涂布培养,菌落计数。计算不同注入剂量的致死率,绘制致死率曲线,从中选取最佳注入剂量。
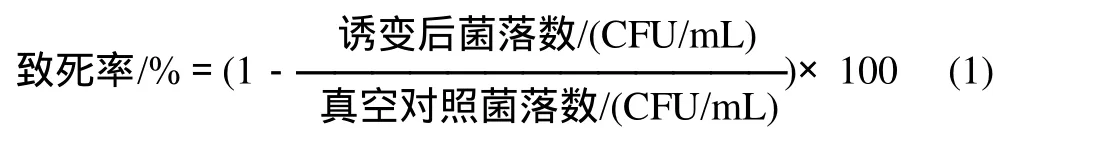
1.3.3 筛选方法
将诱变后的菌悬液涂布在平板培养基上,30℃培养48~60h,挑选形态好的单菌落,分别接种于装有30mL种子培养基的100mL三角瓶中,30℃、140r/min条件下富集培养18h后,按1.3.1节方法发酵产酶,制得粗酶液,以去酰胺度和肽键水解度为指标,挑选去酰胺能力强而肽键水解能力弱的菌株。
筛选标准:以出发菌株为对照,去酰胺度(DD)提高率≥0%,而肽键水解度(DH)相对较低的为正突变株;去酰胺度(DD)提高率≤10%为负突变株;去酰胺度(DD)提高率在0%~10%的为非突变株。
1.3.4 遗传稳定性考察
为了确保筛选到的高去酰胺菌株具有遗传稳定性,对氮离子注入诱变后得到的突变株SDL-9进行遗传稳定性考察。每代实验过程:突变菌株→平板分离→单菌落→斜面→种瓶→摇瓶发酵产酶,制得粗酶液,测定去酰胺度和肽键水解度,并与各自初代进行比较。共传5代,每代均做3个平行。
1.3.5 突变菌株SDL-9产酶条件的优化
将突变菌株SDL-9进行种子培养后,按1.3.1节方法发酵产酶,制得粗酶液。以去酰胺度和肽键水解度为指标,研究不同培养基对产酶的影响,并以玉米粉添加量(A)、大豆蛋白添加量(B)、Fe3+添加量(C)、谷氨酰胺添加量(D)为因素,分别选取3个水平,以去酰胺度为指标,采用L9(34)正交试验确定最优产酶培养基,同时,采用单因素试验研究起始pH值及发酵温度对产酶的影响,确定最优产酶条件。
1.3.6 肽键水解度(DH)的测定
参照文献[16]方法进行测定。
1.3.7 去酰胺度(DD)的测定
采用微量弥散皿法,具体操作参照文献[17]方法。

1.3.8 蛋白质含量的测定
采用半微量凯氏定氮法[18]。
2 结果与分析
2.1 种子生长曲线
将活化后的出发菌株接种到种子培养基中,在30℃、140r/min条件下,摇床振荡培养30h,每2h取样测定发酵液在600nm波长处的光密度值,绘制种子生长曲线。由图1可见,地衣芽孢杆菌2709的对数生长期为14~22h。

图1 地衣芽孢杆菌2709生长曲线Fig.1 Growth curve of Bacillus licheniformis 2709
2.2 氮离子注入诱变选育高去酰胺活性碱性蛋白酶产生菌
2.2.1 不同注入剂量对菌株的影响

图2 氮离子注入剂量的致死率曲线Fig.2 Lethal rate curve of Bacillus licheniformis 2709 under different doses of nitrogen ion implantation
采用不同注入剂量0.5×1015~2.5×1015ions/cm2,进行氮离子注入诱变,平板培养后菌落计数,同时做真空对照,计算不同剂量下的致死率,结果见图2。
如图2所示,实验菌株在经过离子注入后呈现致死率随注入剂量先上升后下降,最后再上升的趋势,这种现象是符合离子注入诱变“马鞍型”剂量-效应曲线的。由于最佳的注入剂量应该在致死率曲线波谷区域,故地衣芽孢杆菌2709的最佳注入剂量为1.5×1015ions/cm2。
2.2.2 氮离子注入诱变的筛选结果
在真空度为6.0×10-1Pa,注入能量为25keV,注入剂量为1.5×1015ions/cm2的条件下进行氮离子注入诱变。经平板培养、发酵产酶,以去酰胺度和肽键水解度为指标,对突变株进行筛选,部分结果如表1所示。

表1 氮离子注入诱变筛选结果Table 1 Screening results of mutant strains resulting from nitrogen ion implantation
由表1可见,经氮离子注入诱变后,有28株突变株的去酰胺度提高10%以上,但其中突变株SDL-17、SDL-49、SDL-101和SDL-104的肽键水解度相对较高,根据筛选标准,这4株菌不属于正突变株,所以共有24株菌为正突变株。并且正突变中有4株(SDL-1、SDL-7、SDL-8、SDL-9)的去酰胺度提高了60%以上,其中突变株SDL-9的去酰胺度高达48.99%,比出发菌株的去酰胺度提高了85.57%。可见,氮离子注入的诱变方法在诱变地衣芽孢杆菌产高去酰胺活性碱性蛋白酶上是一种较高效率的诱变手段。
2.2.3 遗传稳定性考察
为了确定突变株SDL-9是否具有产高去酰胺活性碱性蛋白酶的遗传稳定性,做了斜面培养基的传代稳定性实验,结果见表2。

表2 遗传稳定性比较Table 2 Genetic stability of SDL-9
从表2可以看出,在实验传5代范围内,突变株SDL-9具有良好的遗传稳定性,去酰胺度变化范围在99%~104%之间,肽键水解度变化范围在100%~126%之间。
2.3 突变菌株SDL-9产酶条件优化
2.3.1 不同碳源对产酶的影响
分别以质量浓度为1.0g/100mL的葡萄糖、麦芽糖、蔗糖、糊精、可溶性淀粉和玉米粉作为碳源,发酵产酶,测定粗酶液的去酰胺度和肽键水解度,结果见图3。

图3 不同碳源对产去酰胺蛋白酶的影响Fig.3 Effect of carbon source type on the production of protease
由图3可知,以玉米粉作为碳源时产酶的去酰胺度最高,其次为可溶性淀粉,且前者的肽键水解度略低于后者。同时还可以看出,易利用碳源如葡萄糖、麦芽糖等作为碳源时对产酶有一定的抑制作用,产酶的去酰胺度和肽键水解度都较低,这可能是由于代谢产物的阻遏作用。考虑到要选择的是去酰胺能力强,而肽键水解能力弱的产酶条件,所以选择玉米粉为发酵产酶碳源。
2.3.2 不同氮源对产酶的影响

图4 不同氮源对产去酰胺蛋白酶的影响Fig.4 Effect of nitrogen source type on the production of protease
分别以质量浓度为2.0g/100mL的硫酸铵、牛肉膏、大豆蛋白、酪素、黄豆饼粉及蛋白胨为氮源,发酵产酶,测定粗酶液的去酰胺度和肽键水解度,结果见图4。
由图4可知,不同氮源对碱性蛋白酶的去酰胺能力和肽键水解能力的贡献不同。以牛肉膏作为氮源的去酰胺度最高为50.58%,其次是大豆蛋白为50.24%,而以大豆蛋白为氮源的肽键水解度要低于以牛肉膏为氮源的,而又考虑到大豆蛋白的生产规模大、价格低等因素,所以选择大豆蛋白作为发酵产酶氮源。
2.3.3 不同金属离子对产酶的影响
在发酵培养基中添加质量浓度为0.02g/100mL的不同金属离子,发酵产酶,测定粗酶液的去酰胺度和肽键水解度,结果见图5。
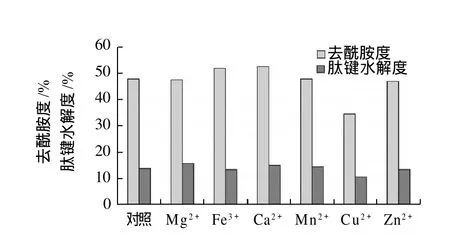
图5 金属离子对产去酰胺蛋白酶的影响Fig.5 Effect of metal ions on the production of protease
由图5可知,Ca2+、Fe3+对菌种产酶的去酰胺能力有明显的促进作用,其中Fe3+对菌种产酶的肽键水解能力有一定的抑制作用;而Cu2+对菌种产酶的去酰胺能力有明显的抑制作用;另外,Mg2+、Mn2+、Zn2+对菌种产酶的去酰胺能力和肽键水解能力无明显影响,故选择金属离子Fe3+考察其对产酶的影响。
2.3.4 诱导物谷氨酰胺对产酶的影响
在发酵培养基中加入质量浓度为0.9g/100mL的谷氨酰胺最为诱导物,发酵产酶,以未加诱导物为对照,测定粗酶液的去酰胺度和肽键水解度,结果见图6。
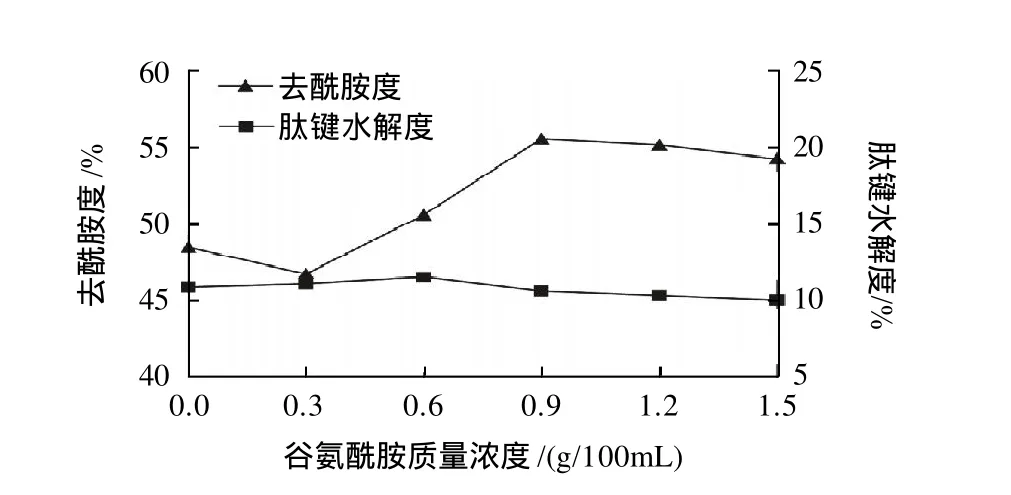
图6 谷氨酰胺对产去酰胺蛋白酶的影响Fig.6 Effect of glutamine on the production of protease
由图 6 可知,谷氨酰胺对菌株产酶的去酰胺能力有明显促进作用,并随着添加量的增加而增大,到0.9g/100mL时去酰胺度达到最高为55.61%,以后变化不明显;但谷氨酰胺诱导物对其肽键水解度的影响不显著。
2.3.5 正交试验优化产酶培养基配方

表3 L9(34)正交试验结果Table 3 Orthogonal array design and results
从表3极差(R)的结果可以看出,各因素对发酵产酶去酰胺度的影响程度为A>D>B>C,即玉米粉添加量>谷氨酰胺添加量>大豆蛋白添加量>Fe3+添加量,最优水平组合为A2B3C2D3,此组合在上述9个试验组中未出现,故需在此条件下进行发酵产酶的验证实验,测得A2B3C2D3组合条件下酶液的去酰胺度为56.9%,比试验组4号的去酰胺度56.2%略高,故确定高去酰胺蛋白酶的最优发酵条件为A2B3C2D3,即玉米粉(碳源)添加量为2g/100mL,大豆蛋白(氮源)添加量为3g/100mL,Fe3+添加量为0.04g/100mL,谷氨酰胺(诱导物)添加量为0.9g/100mL。
2.3.6 起始pH值对产酶的影响
将发酵培养基的pH值分别调节为4~10,发酵产酶,测定粗酶液的去酰胺度和肽键水解度,结果见图7。

图7 起始pH值对产去酰胺蛋白酶的影响Fig.7 Effect of initial fermentation pH on the production of protease
由图7可知,培养基起始pH值对发酵产酶的去酰胺度和肽键水解度影响较大,pH值为7时去酰胺度最高,pH值为6~8时肽键水解度较高,且相差不大。考虑到要选择的是去酰胺能力强而肽键水解能力弱的发酵条件,所以培养基起始pH值为7.0时产酶效果最好,为最适pH值。
2.3.7 发酵温度对产酶的影响
按照以上得到的结果,配制发酵培养基,分别于25~55℃条件下发酵产酶,测定其去酰胺度和肽键水解度,结果见图8。
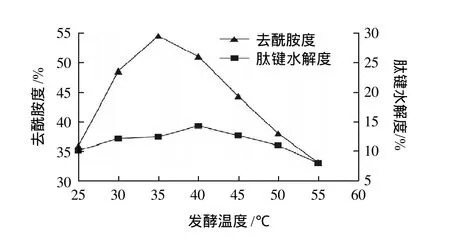
图8 发酵温度对产去酰胺蛋白酶的影响Fig.8 Effect of fermentation temperature on the production of protease
发酵温度能够显著影响微生物的生长速率和代谢途径,过高或过低的培养温度都会影响生物体内的活性,从而影响产物的合成。由图8可见,发酵温度为35℃时去酰胺度最高,而肽键水解度相对较低,故为最适发酵温度。
3 结 论
采用氮离子注入技术,以地衣芽孢杆菌2709为出发菌株,在试验确定的最佳注入剂量(1.5×1015ions/cm2)的条件下进行诱变处理,筛选获得了一株所产碱性蛋白酶的去酰胺能力有显著提高的菌株SDL-9,去酰胺度高达48.99%,比诱变前提高了85.57%,而肽键水解度相对较弱,并且具有良好的遗传稳定性。
以去酰胺度和肽键水解度为指标,采用单因素试验和正交试验对突变菌株SDL-9发酵产酶条件进行了优化,结果表明:最佳碳源为2.0g/100mL玉米粉,最佳氮源为3.0g/100mL大豆蛋白,0.04g/100mL的Fe3+对产酶具有明显的促进作用,在培养基中添加0.9g/100mL的谷氨酰胺对产高去酰胺碱性蛋白酶具有明显的诱导作用,最佳起始pH7.0,最佳发酵温度35℃,在此条件下进行发酵产酶,测得去酰胺度为57.1%,肽键水解度为13.2%。
[1]余增亮, 王学栋, 吴跃进, 等. 离子注入水稻诱变育种机理初探[J].安徽农业科学, 1989(1): 12-16.
[2]余增亮, 霍裕平. 离子注入生物学研究述评[J]. 安徽农业大学学报, 1994, 21(3): 221-225.
[3]余增亮. 离子束生物技术引论[M]. 合肥: 安徽科学技术出版社, 1998: 36-50.
[4]YU Zengliang. Ion beam applicationin genentic modification[J]. IEEE Transactions on Plasma Science, 2000, 28(1): 128-132.
[5]施巧琴, 吴松刚. 工业微生物育种学[M]. 2版. 北京: 科学出版社, 2003: 1-4; 76-78.
[6]PAREKH S, VINCI V A, STROBEL R J. Improvement of microbial strains and fermentation processes[J]. Appl Microbiol Biotechnol, 2000, 54(3): 287-301.
[7]刘世强, 贾景明, 曹萍, 等. 氮离子束对玉米体细胞培养影响的初步研究[J]. 核技术, 1995, 18(7): 410-413.
[8]程备久, 李展, 周立人, 等. 三种离子注入棉花种子的细胞学效应[J].安徽农业大学学报, 1995, 22(3): 189-193.
[9]罗大珍, 王宇钢, 朱文, 等. 离子注入右旋糖酐生产菌的诱变效应研究[J]. 微生物学报, 1997, 34(4): 312-316.
[10]郑建冰, 王立. 大米蛋白酸法脱酰胺改性及对蛋白性质的影响[J]. 食品工业科技, 2007, 28(2): 102-108.
[11]MINE Y. Effect of dry heat and mild alkaline treatment on functional properties of white proteins[J]. J Agric Food Chem, 1997, 45(8): 2924-2928.
[12]莫文敏, 曾庆孝. 蛋白质改性研究进展[J]. 食品科学, 2000, 21(6): 6-10.
[13]van BOEKEL M A J S. Heat-induced deamidation,dephosphorylation and breakdown of caseinate[J]. International Dairy Journal, 1999, 9(3/6): 237-241.
[14]WU C H, NAKAI S, POWRIE W D. Preparation and properties of acidsolubilized gluten[J]. J Agric Food Chem, 1976, 24(3): 504-510.
[15]HAMADA J S, MARSHALL W E. Enhancement of peptide glutaminase deamidation of soyprote in by heat treatwent and/or proteolysis[J]. J Food Sci, 1988, 53(4): 1132-1134.
[16]赵新淮, 冯志彪. 大豆蛋白水解物水解度测定的研究[J]. 东北农业大学学报, 1995, 26(2): 178-181.
[17]马永强, 那治国, 张娜, 等. 地衣芽孢杆菌2709高去酰胺活性碱性蛋白酶发酵条件及酶学性质的研究[J]. 食品工业科技, 2008, 29(10): 81-85.
[18]李桂华. 油料油脂检验与分析[M]. 北京: 化学工业出版社, 2006: 40-44.
Breeding of Strain Producing Protease with High Deamidation and the Optimization of Fermentation Conditions
NA Zhi-guo1,MA Yong-qiang2,*,HAN Chun-ran2,SHI Yan-guo2
(1. Department of Food and Environmental Engineering, East University of Heilongjiang, Harbin 150086, China;
2. College of Food Engineering, Harbin University of Commerce, Harbin 150076, China)
The original strainBacillus licheniformis2709 was mutagenized by means of nitrogen ion implantation at the optimal implantation dose of 1.5 × 1015ions/cm2. As a result, a mutant strain with a deamidation capacity of 48.99% (increased by 85.57% compared with the original strain) but a relatively weak ability to cleave peptide bonds named as SDL-9 was obtained. The orthogonal array design method was used for the optimization of fermentation conditions for production of alkaline protease with high deamidation capacity by SDL-9. The optimal fermentation conditions were 2 g/100 mL corn meal as the carbon source, 3 g/100 mL soybean protein as the nitrogen source, 0.04 g/100 mL Fe3+with distinct promoting effect on enzyme production, 0.9 g/100 mL glutamine that could notably induce enzyme production, initial pH 7.0, and temperature 35 ℃. Under these conditions, the deamidation capacity and hydrolysis degree of peptide bonds were 57.1% and 13.2%, respectively.
nitrogen ion implantation;deamidation;alkaline protease
Q939.97
A
1002-6630(2012)01-0174-06
2011-09-30
国家“863”计划项目(2006AA10Z329)
那治国(1980—),男,讲师,硕士,研究方向为食品生物技术。E-mail:nazhiguo1980@126.com
*通信作者:马永强(1963—),男,教授,硕士,研究方向为食品化学。E-mail:mayq@hrbcu.edu.cn
