一种新型补充矿物元素的载体
——脱铁铁蛋白的研究进展
2012-10-27冷小京
王 震,冷小京*
(中国农业大学食品科学与营养工程学院,北京 100083)
一种新型补充矿物元素的载体
——脱铁铁蛋白的研究进展
王 震,冷小京*
(中国农业大学食品科学与营养工程学院,北京 100083)
铁蛋白(ferritin)经脱铁处理后,内部空腔可装载多种矿物元素。鉴于这种蛋白可经胞饮作用,完整地被小肠上皮细胞吸收,因此有望作为新型矿物元素载体而发展。脱铁铁蛋白(apoferritin)的脱铁及矿物元素的装载过程可利用透射电镜(TEM)、能谱分析(EDS)、X射线粉末衍射(X-Ray)、质谱(MS)、核磁共振(NMR)、动态光散射(DLS)、紫外分光光度法(UV)等技术研究分析。本文综述了目前国内外利用铁蛋白装载矿物元素的成果及其在营养方面的应用。
铁蛋白;脱铁铁蛋白;矿物元素;载体
矿物元素与人的生命和健康息息相关,如作为酶的组分起催化作用,参与激素作用调节生物功能,影响核酸的代谢,影响生物物理效应等[1];其摄入过量或不足都会不同程度地引发人体生理代谢异常或导致疾病。人体所需的矿物元素涉及多种过渡族元素,如F e、Cu、Zn、Co、Mn、Ni等,这些元素极易发生中和、沉淀、或络合等反应,而C a、Z n、C u、M g、F e等金属离子也易与磷酸根、蛋白质形成低溶解度的络合物,从而影响矿物质元素的人体吸收利用率[2]。解决上述问题的传统方法是通过化学手段,促使矿物元素与特定有机成分反应形成配合物来增加溶解度,提高可利用性。利用脱铁铁蛋白(apoferritin)的空腔制备新型生物纳米运载体系,通过胞吞作用被人体吸收,是一种全新的生物技术,因此引起国内外相关领域极大关注。
铁蛋白最初发现于脊椎动物的肝脏、脾脏等器官中,后确认这是种广泛存在于动物及植物等几乎所有生命体中的一类铁储藏蛋白,它的功能主要是储藏和隔离铁,调节铁离子的代谢。铁蛋白可以结合许多金属离子[3],而且是第一个被用作模板合成金属颗粒的蛋白质[4]。天然铁蛋白是一种良好的补铁试剂,在补铁实验中发现其对人体无毒害作用[5]。铁蛋白结合到肠细胞表面受体后,通过胞吞作用可完整的转运到细胞内部利用。将铁蛋白内部的铁核在无氧环境下通过还原反应除去得到Apoferritin,之后使用化学方法将其他矿物质离子加入Apoferritin体系,可形成新型生物纳米颗粒。矿物质进入脱铁铁蛋白的过程可使用电镜、能谱分析、粉末衍射、质谱、核磁共振、动态光散射、紫外分光光度法等方法研究。
1 铁蛋白的结构与功能
1.1 铁蛋白的结构特点
铁蛋白是由24个亚基组成的类球状蛋白分子,内径约为8nm,外径约12nm。铁蛋白的亚基主要包括两种类型:重链(H)和轻链(L),每个亚基包括 5个α螺旋,即从N端起形成4个α螺旋(A、B、C、D),C末端由第5个较短α螺旋(E)构成[6-7];24个亚基构成一个呈432点对称的菱形十二面体蛋白质外壳。在该十二面体上沿二、三、四重旋转轴分别可得由亚基组成的12个2倍轴通道,8个3倍轴通道和6个4倍轴通道(图1),负责铁蛋白内外物质的交换[8]。在植物铁蛋白中,3倍轴和4倍轴通道都是亲水性的,而在动物铁蛋白中,3倍轴通道由亲水性残基组成,4倍轴通道由疏水性残基组成[9]。
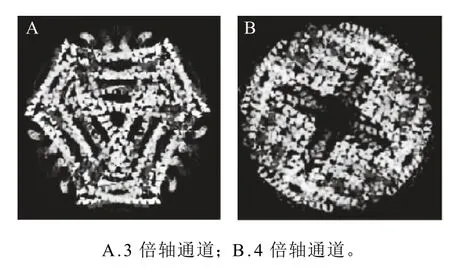
图1 铁蛋白的结构Fig.1 Microstructure of ferritin
1.2 铁蛋白的功能特性
当细胞内Fe2+浓度高时,铁蛋白催化Fe2+被氧气分子氧化,并把生成的Fe3+储藏于其内部空腔,1分子铁蛋白最多可储存4500个Fe3+。当细胞需要铁时,即Fe2+浓度低时,铁蛋白在还原剂的帮助下将Fe3+还原为Fe2+,将铁从其内部释放出来供其他代谢所利用。因此,铁蛋白在细胞内具有去除Fe2+的毒性以及调节铁代谢平衡的双重作用[8]。
1.3 铁蛋白的金属离子结合位点
铁蛋白通道及空腔内部有许多带负电的氨基酸残基都可结合金属离子,如人体铁蛋白H链上组成通道中亲水区域的Glu 27、Glu61、Glu 62、Glu 107和Gln 141和马脾铁蛋白的L链中指向内部空腔的Glu 60、Glu 61[10]等;其他带负电的氨基酸残基如Asp也可通过静电作用结合金属离子。铁蛋白通道中负电氨基酸残基可构成电势梯度,金属离子可顺着电势转运到铁蛋白内部[11]。
2 铁蛋白装载的矿物元素
2.1 矿物离子的种类
铁蛋白内部可结合多种金属离子如Fe2+、Cu2+、Ni2+、Zn2+、Mn2+、Co2+、Cd2+、Pt2+等[3]。铁蛋白的铁核可利用Apoferritin在体外合成[12],且大小分布均一,为(7.3±1.4)nm,与天然铁核相似。目前已合成的金属纳米颗粒有:ZnSe[13]、Mn(O)OH和Mn3O4[14]、Co(O)OH和Co3O4[15]、Cr(OH)3、Ni(OH)3[16]、Eu(O)OH、In2O3、TiO2[17]、FeS、CdS[18]、CdSe[19]等。铁蛋白的矿化成核作用不具有专一性,说明导致金属阳离子进入空腔内部的主要起因是静电作用。在ZnSe的合成中,Zn2+需先于Se2-加入与Apoferritin反应,也可通过蛋白质的静电导向作用来描述。Apoferritin内表面负电残基首先结合带正电的Zn2+,然后阴离子Se2-进入铁蛋白内部再与Zn2+结合。借助Apoferritin内部金属离子还原的方法,还可进一步合成金属单质颗粒[13]等。
2.2 矿物核心的形成
铁蛋白的3倍轴、4倍轴通道直径为0.3~0.4nm,金属离子通过扩散作用可进入Apoferritin内部,结合到带负电的氨基酸残基位点,然后通过一定作用成晶核,逐渐长大至粒径大小约为8nm——即铁蛋白内径。金属纳米颗粒的形成可分两种类型(图2)。

图2 Apoferritin 内合成的金属纳米颗粒Fig.2 Synthesis of metal nanoparticles in apoferritin
类型一:金属离子在铁蛋白内部沉淀成核,如Wong等[18]合成CdS的方法 (图2A):在氮气环境中,向1mg/mL Apoferritin加入Cd2+(Cd2+与Apoferritin物质的量比为55),1h后加入HS-(HS-与Cd2+物质的量比为2.5)反应45min,再加入HS-(HS-与Cd2+物质的量比为2.5)反应45~60min,最后在缓冲液中(pH 7.5的TES/ NaCl)透析除去游离的Cd2+或HS-。重复此过程,使CdS 颗粒在Apoferritin 空腔内长大。
类型二:金属离子在铁蛋白内部通过氧化还原反应成核,如Galvez 等[20]合成Cu的方法 (图2B):向0.1mL CuSO4(0.1mol/L)溶液中加入4mL Apoferritin(40μmol/L) ,使Cu与Apoferritin 的物质的量比达到2000。Apoferritin与Cu2+复合物通过分子筛层析色谱柱(G-25 Sephadex)分离纯化,然后向溶液中加入还原剂NaBH4,将Apoferritin内的Cu2+还原为铜单质。体系在4℃条件下反应24h,pH值稳定在8左右。
使用脱铁铁蛋白合成金属纳米颗粒的过程需要控制pH值、温度等条件。与Apoferritin结合的金属离子数量受pH值的影响。如Pead等[3]研究发现,在pH7.5时,每个Apoferritin分子可结合Cd2+、Cu2+、Zn2+、Ni2+的数量分别为54、33、30、16,而在pH5.5时结合的数量分别为3、29、1.5、1。由此可见,pH值的升高可增加Apoferritin所带负电荷量,增强静电吸引作用,结合更多的金属离子。铁蛋白的结构变化,如亚基的解离,也会受pH值的影响,因此为保证铁蛋白的稳定性,研究中需要将pH值控制在适当范围内。这一特性也可用于矿物元素的装载。利用pH2.0时铁蛋白亚基解离,pH7.5时亚基可重新聚集的特性来装载铂金属[21-22]。金属离子与铁蛋白的结合在低温下反应平衡时间增长,高温时变短。温度的提高有助于小分子进入铁蛋白的扩散以及聚集效果。在20~40℃之间,硝基氧分子进入马脾铁蛋白的速率每升高10℃可增加一倍。
2.3 矿物离子及纳米颗粒的研究方法
分子筛层析色谱法分离纯化、紫外分光及原子吸收法的联用,经常用于判断蛋白质与金属离子的结合。在含Ag的Apoferritin的洗脱曲线中存在两个原子吸收峰[18,20],Galvez 等[20]认为,第一个峰与蛋白质在280nm处的吸收峰同时出现,表明Apoferritin与Ag的结合,而第二个峰表示未与蛋白质结合的游离Ag。而通过纯Apoferritin与载有金属的Apoferritin天然聚丙烯酰胺凝胶电泳条带的比较,可验证装载金属离子后的Apoferritin的分子是否依旧完整[21],两者条带相同表示装载金属离子的铁蛋白结构没有改变。
透射电镜(TEM)是研究铁蛋白合成纳米颗粒的直观手段,将浓度0.1μmol/L的铁蛋白溶液滴于镀有碳膜的铜网或金网上,用醋酸铀酰或硫金代葡糖糖染色,在室温下干燥后即可观测[20]。Yamashita等[23]利用它观测矿化核及负染色后的铁蛋白壳,从而证明矿化核是在铁蛋白内部形成的。如图3(比例尺为30nm),黑色圆点是金属矿化核,环绕周围的是铁蛋白壳。染色剂硫金代葡萄糖分子质量较大,无法通过铁蛋白壳上的通道进入内部,因此可用来研究蛋白壳内核的形成。对于粒径分布均匀的类球形铁蛋白,使用TEM可直接测量颗粒的真实粒径[20]。Kim等[24]使用电镜研究Co3O4、CoOOH纳米颗粒的形成,观测到Co首先形成有空腔的矿化核,然后矿化核变为实心的球体。需要注意的是,当Apoferritin内的金属离子浓度过低,导致样品电子密度过低时,图像分辨率会受到很大影响。在Wong等[18]合成CdS过程中,若Cd2+与Apoferritin物质的量比低于110时,颗粒为灰白色,观测不到矿物质内核。

图3 铁蛋白内Fe、Co、Ni氧化物的透射电镜照片Fig.3 Transmission electron micrographs of iron oxide, cobalt oxide and nickel oxide in ferritin
Galvez 等[25]将EDS能谱分析技术与TEM联用,检测纳米颗粒的成分及含量,如通过检测蛋白壳内外Co的含量,可证明合成的金属Co核存在于蛋白壳内部。Tosha 等[26]利用X射线粉末衍射(X-Ray)技术,可分辨纳米颗粒的晶体构造。Wong等[18]利用核磁共振法(NMR)监测了Fe2+与Apoferritin的结合,以及铁氧化物在蛋白空腔内部形成的过程。他们发现,1个Apoferritin首先结合12个Fe2+,然后才在其内部形成Fe2O3沉淀,进而形成Fe2O3核。Li Chaorui等[27]利用动态光散射技术(DLS)在水环境下测定纳米颗粒的水合粒径,以及反应装载金属离子后铁蛋白大小的变化及聚集等特征。
3 载有矿物元素的铁蛋白的应用
4 展 望
人体需要多种矿物元素,以保持正常的生命活动,但它们的吸收利用受诸多因素影响,如沉淀、螯合等。铁蛋白作为一种新型生物纳米载体可装载许多矿物营养因子,并保持它们的功能活性。铁蛋白可溶,易吸收,其能够保护矿物元素免受外界不良影响,完整地转运到小肠上皮细胞内等特性,可有效增加矿物元素的生物利用率。不过,有关使用改性技术制备的铁蛋白载体毒理方面的研究尚不充分,有待继续探讨。目前,有关铁蛋白装载金属离子的研究越来越广泛,随着对铁蛋白装载金属离子机制以及被人体利用途径研究的深入,铁蛋白运载将成为一种具有独特功效的补充矿物元素的技术。
[1]王林, 章敏, 胡秋. 刺槐花营养功能成分及其开发利用[J]. 食品科学, 2006, 27(2): 274-276.
[2]黄汉军, 贾振军, 穆晓梅, 等. 影响饲料中矿物元素吸收利用的因素[J]. 畜牧兽医杂志, 2002, 21(5):16-20.
[3]PEAD S, DURRANT E, WEBB B, et al. Metal ion binding to apo, holo, and reconstituted horse spleen ferritin[J]. Journal of Inorganic Biochemistry, 1995, 59(1): 15-27.
[4]UCHIDA M, KLEM M T, ALLEN M, et al. Biological containers: protein cages as multifunctional nanoplatforms[J]. Advanced Materials, 2007, 19(8): 1025-1042.
[5]ZHAO Guanghua. Phytoferritin and its implications for human health and nutrition[J]. Biochimica et Biophysica Acta-General Subjects, 2010, 1800(8): 815-823.
[6]MASUDA T, GOTO F, YOSHIHARA T A. Novel plant ferritin subunit from soybean that is related to a mechanism in iron release[J]. Journal of Biological Chemistry, 2001, 276(22): 19575-19579.
[7]HARRISON P M, AROSIO P. The ferritins: molecular properties, iron storage function and cellular regulation[J]. Biochimica et Biophysica Acta-Bioenergetics, 1996, 1275(3): 161-203.
[8]CHASTEEN N D, HARRISON P M. Mineralization in ferritin: an efficient means of iron storage[J]. Journal of Structural Biology, 1999, 126(3): 182-194.
[9]BRIAT J F, RAVET K, ARNAUD N, et al. New insights into ferritin synthesis and function highlight a link between iron homeostasis and oxidative stress in plants[J]. Annals of Botany, 2010, 105(5): 811-822.
[10]LAWSON D M, ARTYMIUK P J, YEWDALL S J, et al. Solving the structure of human H ferritin by genetically engineering intermolecular crystal contacts[J]. Nature, 1991, 349: 541-544.
[11]WATT G D, JACOBS D, FRANKEL R B. Redox reactivity of bacterial and mammalian ferritin: is reductant entry into the ferritin interior a necessary step for iron release[J]. Proceedings of the National Academy of Sciences of the United States of America, 1988, 85(20): 7457-7461.
[12]UCHIDA M, KANG S, REICHHARDT C, et al. The ferritin superfamily: supramolecular templates for materials synthesis[J]. Biochimica et Biophysica Acta-General Subjects, 2010, 1800(8): 834-845.
[13]MANN S, MELDRUM F C. Controlled synthesis of inorganic materials using supramolecular assemblies[J]. Advanced Materials, 1991, 3(6): 316-318.
[14]MELDRUM F C, DOUGLAS T, LEVI S, et al. Reconstitution of manganese oxide cores in horse spleen and recombinant ferritins[J]. Journal of Inorganic Biochemistry, 1995, 58(1): 59-68.
[15]DOUGLAS T, STARK V T. Nanophase cobalt oxyhydroxide mineral synthesized within the protein cage of ferritin[J]. Inorganic Chemistry, 2000, 39(8): 1828-1830.
[16]OKUDA M, IWAHORI K, YAMASHITA I, et al. Fabrication of nickel and chromium nanoparticles using the protein cage of apoferritin[J]. Biotechnology and Bioengineering, 2003, 84(2): 187-194.
[17]KLEM M T, MOSOLF J, YOUNG M, et al. Photochemical mineralization of europium, titanium, and iron oxyhydroxide nanoparticles in the ferritin protein cage[J]. Inorganic Chemistry, 2008, 47(7): 2237-2239.
[18]WONG K K W, MANN S. Biomimetic synthesis of sulfide-ferritin nanocomposites[J]. Advanced Materials, 1996, 8(11): 928-932.
[19]YAMASHITA I, HAYASHI J, HARA M. Bio-template synthesis of uniform CdSe nanoparticles using cage-shaped protein, apoferritin[J]. Chemistry Letters, 2004, 33(9): 1158-1159.
[20]GALVEZ N, SANCHEZ P, DOMINGUEZ-VERA J M, et al. Apoferritin as a nanoreactor for preparing metallic nanoparticles[J]. Comptes Rendus Chimie, 2008, 11(10): 1207-1212.
[21]YANG X, AROSIO P, CHASTEEN N D. Molecular diffusion into ferritin: pathways, temperature dependence, incubation time, and concentration effects[J]. Biophysical Journal, 2000, 78(4): 2049-2059.
[22]YANG Zhen, WANG Xiaoyong, DIAO Huajia, et al. Encapsulation of platinum anticancer drugs by apoferritin[J]. Chemical Communications, 2007, 33: 3453-3455.
[23]YAMASHITA I, IWAHORI K, KUMAGAI S. Ferritin in the field of nanodevices[J]. Biochimica et Biophysica Acta - General Subjects, 2010, 1800(8): 846-857.
[24]KIM J W, CHOI S H, LILLEHEI P T, et al. Cobalt oxide hollow nanoparticles derived by bio-templating[J]. Chemical Communications, 2005, 32: 4101-4103.
[25]GALVEZ N, SANCHEZ P, DOMINGUEZ-VERA J M, et al. Apoferritin-encapsulated Ni and Co superparamagnetic nanoparticles[J]. Journal of Materials Chemistry, 2006, 16(26): 2757-2761.
[26]TOSHA T, NG H L, BHATTASALI O, et al. Moving metal ions through ferritin-protein nanocages from three-fold pores to catalytic sites[J]. Journal of the American Chemical Society, 2010, 132(41): 14562-14569.
[27]LI Chaorui, FU Xiaoping, QI Xin, et al. Protein association and dissociation regulated by ferric ion: a novel pathway for oxidative deposition of iron in pea seed ferritin[J]. Journal of Biological Chemistry, 2009, 284 (25): 16743-16751.
[29]PRICE D, JOSHI J G. Ferritin: a zinc detoxicant and a zinc ion donor[J]. Proceedings of the National Academy of Sciences of the United States of America, 1982, 79(10): 3116-3119.
[30]XING Ruimin, WANG Xiaoyong, ZHANG Changli, et al. Characterization and cellular uptake of platinum anticancer drugs encapsulated in apoferritin [J]. Journal of Inorganic Biochemistry, 2009, 103(7): 1039-1044.
[31]ZHANG Lianbing, LAUG L, MU..NCHGESANG W, et al. Reducing stress on cells with apoferritin-encapsulated platinum nanoparticles[J]. Nano Letters, 2010, 10(1): 219-223.
[32]UCHIDA M, FLENNIKEN M L, ALLEN M, et al. Targeting of cancer cells with ferrimagnetic ferritin cage nanoparticles[J]. Journal of the American Chemical Society, 2006, 128(51): 16626-16633.
Ferritin: A New Mineral Carrier for Supplement
WANG Zhen,LENG Xiao-jing* (College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
The cavity of apoferritin can be used to transport various minerals. Since this protein can be absorbed by intestinal epithelial cells via entocytosis pathways, it becomes a new promising type of mineral nanocarrier. The process of deferrization for ferritin and mineral loading has been studied by transmission electron microscope (TEM), energy dispersive X-ray spectroscopy (EDS), X-ray powder diffraction (X-Ray), mass spectroscopy (MS), nuclear magnetic resonance (NMR), dynamic light scattering (DLS) and ultraviolet spectroscopy (UV), respectively. Recents applications of apoferritin carriers in the field of nutrition are summarized in this paper.
ferritin;apoferritin;mineral;carrier
R151.3
A
1002-6630(2012)01-0290-04
2011-01-16
“十二五”国家科技支撑计划项目(2011BAD23B04)
王震(1987—),男,硕士研究生,研究方向为铁蛋白功能特性。E-mail:wangzhen022078@163.com
*通信作者:冷小京(1966—),男,副教授,博士,研究方向为可食用膜及微胶囊科学。E-mail:xiaojing.leng@gmail.com
