薏米中酚类提取物测定及抗氧化能力指数分析
2012-10-27王立峰鞠兴荣
王立峰,何 荣,袁 建,鞠兴荣
(1.江南大学食品学院,江苏 无锡 214122;2.南京财经大学食品科学与工程学院,江苏 南京 210046)
薏米中酚类提取物测定及抗氧化能力指数分析
王立峰1,2,何 荣1,袁 建2,鞠兴荣2
(1.江南大学食品学院,江苏 无锡 214122;2.南京财经大学食品科学与工程学院,江苏 南京 210046)
选取3种薏米样品,经提取获得游离型和结合型多酚类化合物,采用改进的Folin-Ciocalteu比色法及硼氢化钠/氯醌(SBC)比色法,用酶标仪测定其多酚和黄酮含量;采用抗氧化能力指数(ORAC)方法,于荧光酶标仪中测定提取物中的总抗氧化活性。研究表明,游离型多酚含量中龙薏1号薏米显著性高于贵州黑谷薏米和辽宁5号薏米,结合型多酚含量中龙薏1号薏米显著性高于贵州黑米薏米和辽宁5号薏米,所有样品中其平均结合型多酚含量占总多酚含量的45.28%;游离型黄酮含量中辽宁5号薏米显著高于贵州黑谷薏米和辽宁5号薏米,结合型黄酮含量中龙薏1号薏米高于辽宁5号薏米和贵州黑谷薏米,总黄酮含量最高的是辽宁5号薏米。总抗氧化能力指数(ORAC)最高的是龙薏1号薏米,其值是(668.0 ± 32.7)mg Trolox /100g样品(以干质量计),其次是贵州黑谷薏米和辽宁5号薏米,所有样品中平均结合型ORAC值占总ORAC值的48.08%;3个品种的薏米其总多酚含量与总抗氧化能力指数之间相关系数为0.933,有显著相关性(P<0.05)。
薏米;多酚;黄酮;抗氧化能力指数
全谷物可以减少患一些慢性病的风险,例如心血管疾病[1],Ⅱ型糖尿病[2],肥胖症[3]和一些癌症[4]。氧化应激是许多慢性退行性疾病发生发展的主要机制[5]。近年来,由于天然植物化学物抗氧化能力及潜在的健康作用,探寻和研究具有抗氧化活性的天然植物化学物质用于防治氧化应激诱导的多种疾病,成为医药、植物化学等多个学术领域共同关注的课题。然而,由于很多研究低估了全谷物中的植物化学物质,其研究远没有果蔬中植物化学物得到足够的重视[6-8]。薏米(Coix lachrymajobiL.),又称薏仁,是传统的药食兼用谷物资源,在中国、日本和越南广泛种植,被誉为“世界禾本科植物之王”[9]。虽然薏米具有很好的生物活性和营养性,但其植物化学物的研究未见报道。因此深入了解薏米植物化学物的含量及体外抗氧化能力,对进一步研究薏米体内生物活性,挖掘提高薏米的营养价值,发挥其保健作用具有重要意义。目前对薏米的研究报道不多,多集中于薏米的多重生理功能[10-12]。Chang Huichiu等[13]研究证明薏米可抑制老鼠中肉瘤-180肿瘤,具有抗癌效果。Kuo等[14]指出薏米壳的甲醇提取物对U937白血病细胞具有抗增殖效果。Chang Huichiu等[13]报道了薏米的甲醇提取物对A549肺癌细胞具有抗增殖效果。有研究报道薏米麸皮中总多酚含量在,但未区分游离型和结合型多酚含量比例[10,15]。目前对于薏米植物化学物及其体外抗氧化能力的研究国内外尚未见报道。因此,为较清楚地了解薏米中多酚含量及其生理活性,挖掘提高薏米的营养价值,有必要对其进行多酚及抗氧化活性的分析。本实验对薏米中游离型和结合型植物化学物质进行分析,同时测定分析各品种薏米抗氧化能力指数(oxygen radical absorbance capacity,ORAC),旨在了解薏米中多酚及抗氧化能力,尤其是结合型多酚及其抗氧化能力,挖掘薏米的营养价值,并可为后续研究薏米抗癌作用提供一定的依据。
1 材料与方法
1.1 材料
薏米样品包括贵州黑谷薏米、辽宁5号薏米、龙薏1号薏米,均由南京财经大学江苏省粮油品控及深加工技术重点实验室提供。样品脱壳后经旋风磨粉碎过筛,石油醚索式抽提去脂,-20℃避光保存备用。所有样品采用AOAC方法于105℃干燥16h后称得其质量,结果以干质量表示。
1.2 试剂与仪器
甲醇、乙醇、丙酮、正己烷、乙酸乙酯、盐酸、氢氧化钾、磷酸氢二钾和磷酸二氢钾 美国Mallinckrodt化学试剂公司;2,2'-Azobis(2-amidinopropane) dihydrochloride (ABAP) 美国Wako化学试剂公司;没食子酸 美国ICN生化试剂公司;抗坏血酸、2',7'-Dichlorofluorescin diaacetate (DCFH-DA) 美国Sigma公司;96孔黑色和白色底部透明微孔板 美国Corning公司。
锤式旋风磨 上海嘉定粮油仪器有限公司;试验砻谷机 日本佐竹公司;酶标仪 加拿大Dynex公司;多功能荧光分析仪 美国Thermo Electron 公司。1.3 游离型多酚类化合物的提取
薏米样品中游离型多酚类化合物的提取采用改进的本实验室前期报道的方法[16-18]。称取4g样品,加入80%预冷的丙酮30mL进行搅拌。充分混合后2500 ×g离心10min,收集上清提取液。滤渣用80%预冷的丙酮再次提取,重复3次。收集全部上清提取液后在45℃旋转蒸发至干。用70%甲醇定容至10mL。提取液储存于-40℃备用。所有提取重复操作3次。
1.4 结合型多酚类化合物的提取
薏米样品中结合型多酚类化合物的提取采用改进的本实验室前期报道的方法[16,18-19]。简单的说,结合型多酚类化合物的提取是在前述游离型多酚类化合物提取后剩余残渣的基础上进行深度提取。首先将残渣氮吹2min,然后室温下向残渣中加入2mol/L NaOH 20mL,振荡1h进行消化处理。混合物用浓盐酸中和,并调整pH2。然后加入乙酸乙酯,静置10min后2500×g离心10min,收集乙酸乙酯部分,重复此操作5次。将收集到的溶液在45℃旋转蒸发至干,用70%甲醇定容至10mL。提取液储存于-40℃备用。所有提取重复操作3次。
1.5 多酚含量的测定
每个品种的薏米多酚含量的测定采用Singleton 等[20]和本实验室改进的Folin-Ciocalteu比色法[17,21]。所有提取液(游离型、结合型多酚类化合物提取液)按照1:20稀释,使得其可读取范围在标准曲线0.0~600.0μg 没食子酸/mL范围之内。提取液用Folin-Ciocalteu试剂反应,然后加入碳酸钠终止反应。室温下避光放置90min后,于波长760nm处用酶标仪测定吸光度。没食子酸作为标准曲线,多酚含量以每100g干质量等同于没食子酸的毫克数表示。总多酚含量为分别测定的结合型多酚与游离型多酚含量之和。
1.6 黄酮含量的测定
每个品种的薏米黄酮含量测定采用本实验室建立的硼氢化钠/氯醌(SBC)比色法[22]。分别取1mL的样品(游离型、结合型多酚类化合物提取液)提取物(氮气吹干)和儿茶素标准品,现配使用(0.1~10.0mmol/L),加入0.2mL的四氢呋喃-乙醇混合物(1:1,V/V),然后加入0.1mL、50mmol/L的硼氢化钠和0.1mL、74.6mmol/L的三氯化铝。然后室温振荡30min,在提取物和标准品中分别再次加入0.1mL、5050mmol/L硼氢化钠,室温振荡30min。加入0.4mL预冷的0.8mol/L的冰醋酸,避光振荡15min。然后加入0.2mL、20mmol/L的氯醌,在95℃油浴振荡加热60min,冷却后甲醇定容至1mL,然后加入0.2mL、1052mmol/L的香草醛,混合后加入0.4mL、12mol/L的盐酸,避光振荡反应15min,于96孔板上每孔加入200μL,在波长490nm处用酶标仪测定吸光度。黄酮含量以每100g干质量等同于儿茶素的毫克数表示。总黄酮含量为分别测定的结合型黄酮与游离型黄酮之和。
1.7 总抗氧化能力指数(ORAC)的测定
每个品种薏米总抗氧化能力的测定采用抗氧化能力指数(ORAC)以及本实验室修正的方法[23-25]。薏米样品首先用75mmol/L的磷酸缓冲液进行稀释(pH7.4),测定使用荧光96孔板进行,每个孔含有20μL样品提取物(游离型、结合型多酚类化合物提取液)或者20μL Trolox 标准品(6.25~50 μmol/L),以及200μL的Fluorescein(荧光指示剂,0.96μmol/L),每个孔在荧光酶标仪中于37℃温育20min,然后每个孔再加入20μL,119mmol/L的偶氮类化合物ABAP,利用荧光酶标仪在波长485nm处激发,每5min在波长520nm处释放测定。ORAC值以每100g干质量等同于Trolox的毫克数表示。
1.8 数据统计
2 结果与分析
2.1 总多酚含量
薏米品种的游离型多酚、结合型多酚和总多酚含量见表1。游离型多酚含量最高的是龙薏1号(P<0.05),其含量为(45.19 ± 0.91)mg 没食子酸/100g样品;结合型多酚含量最高的是龙薏1号(P<0.05),其含量为(30.86 ± 1.18)mg没食子酸/100g样品;总多酚含量最高的是龙薏1号(P<0.05),其含量为(76.04 ± 1.99)mg没食子酸/100g样品。3个品种薏米样品间总多酚含量有显著性差异(P<0.05)。
表1 不同品种薏米多酚含量( -±s,n = 5)Table 1 Contents of total phenols in 3 adlay varieties( -±s,n = 5)
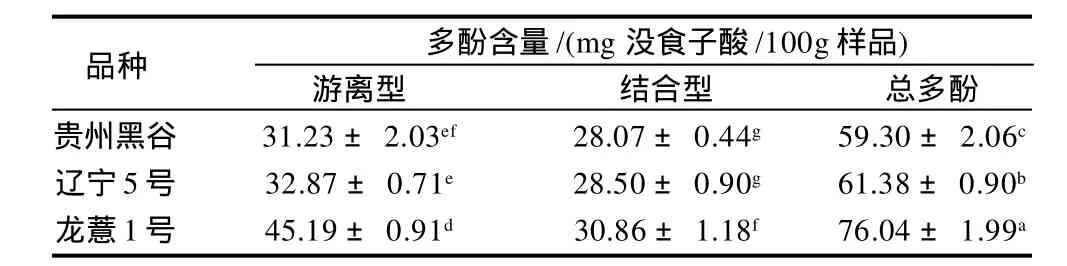
表1 不同品种薏米多酚含量( -±s,n = 5)Table 1 Contents of total phenols in 3 adlay varieties( -±s,n = 5)
注:肩标字母完全不同时,表示差异达显著性水平(P<0.05)。
品种 多酚含量/(mg 没食子酸/100g样品)游离型 结合型 总多酚贵州黑谷 31.23 ± 2.03ef 28.07 ± 0.44g 59.30 ± 2.06c辽宁5号 32.87 ± 0.71e 28.50 ± 0.90g 61.38 ± 0.90b龙薏1号 45.19 ± 0.91d 30.86 ± 1.18f 76.04 ± 1.99a
2.2 总黄酮含量
3个品种薏米样品的游离型黄酮、结合型黄酮和总黄酮含量见图1。游离型黄酮含量最高的是辽宁5号,其含量是(18.24±0.55)mg儿茶素/100g样品,其次是龙薏1号薏米,其含量是(11.57±1.21)mg儿茶素/100g样品和贵州黑谷薏米,其含量是(6.21±0.55)mg 儿茶素/100g样品;结合型黄酮含量最高的是龙薏1号薏米,其含量是(35.27±3.66)mg 儿茶素/100g样品,其次是辽宁5号薏米,其含量是(34.63±1.89)mg儿茶素/100g样品和贵州黑谷薏米,其含量是(18.68±1.77)mg儿茶素/100g样品;总黄酮含量最高的是辽宁5号薏米,其含量是(52.86± 1.85)mg 儿茶素/100g样品,其次是龙薏1号薏米,其含量是(46.85±4.48 )mg儿茶素/100g样品和贵州黑谷薏米,其含量是(24.88±2.06)mg 儿茶素/100g样品。3个品种薏米样品间总黄酮含量有显著性差异(P<0.05),游离型黄酮含量中辽宁5号薏米显著高于贵州黑谷薏米和龙薏1号薏米(P<0.05),此外,龙薏1号游离型黄酮含量显著高于贵州黑谷薏米(P<0.05)。在贵州黑谷薏米和龙薏1号薏米结合型黄酮含量之间没有显著性差异,但它们的结合型黄酮含量显著高于贵州黑谷薏米(P<0.05)。

图1 不同品种薏米黄酮含量(n = 5)Fig.1 Contents of total flavonoids in 3 adlay varieties (n = 5)
2.3 总多酚中黄酮的贡献率

图2 不同品种薏米多酚中黄酮的贡献率 (n = 5)Fig.2 Ratios between total flavonoids and total phenols in 3 adlay varieties (n = 5)
薏米样品中总黄酮对总多酚含量的贡献率见图2。游离型黄酮含量占游离型多酚含量比例最大的是辽宁5号薏米,其比例为32.5%,其次为龙薏1号薏米,其比例为15.0%,贵州黑谷薏米,其比例为11.6%;结合型黄酮含量占结合型多酚含量比例最大的是辽宁5号薏米,其比例为71.2%,其次为龙薏1号薏米,其比例为66.8%,贵州黑谷薏米中其比例为39.0%。总黄酮含量占总多酚含量比例最大的是辽宁5号薏米,其比例为50.5%,其次是龙薏1号薏米,其比例为36.0%,贵州黑谷薏米,其比例为24.6%。
2.4 总抗氧化能力指数(ORAC)分析
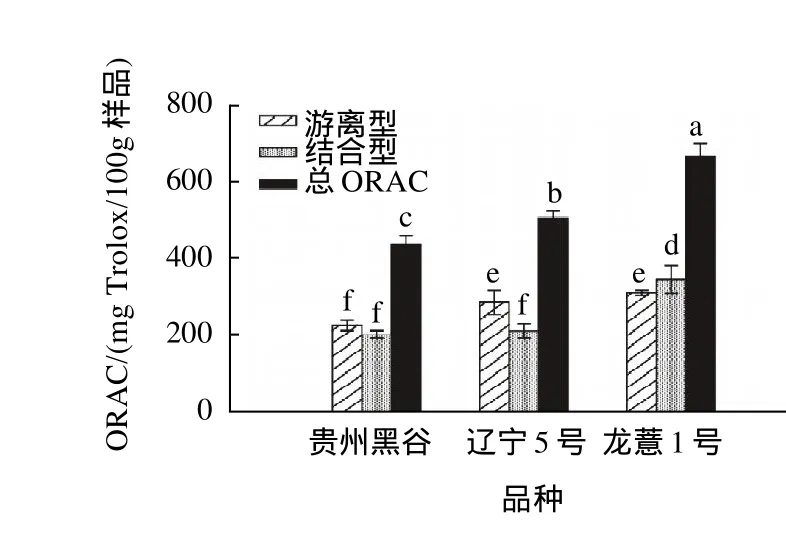
图3 不同品种薏米总抗氧化能力指数 (n = 5)Fig.3 ORAC values of 3 adlay varieties (n = 5)
3个品种薏米样品的游离型、结合型和总抗氧化能力指数(ORAC)见图3。龙薏1号薏米和辽宁5号薏米游离型ORAC值(分别为(316.6±6.4)mg Trolox/100g 样品和(291.1±31.5)mg Trolox/100g样品)高于贵州黑谷薏米((231.9±13.3)mg Trolox/100g样品);结合型ORAC值最高的是龙薏1号薏米(P<0.05),其值为(351.4±36.3)mg Trolox/100g样品,其次是辽宁5号薏米,其值为(217.3± 18.6)mg Trolox /100g样品和贵州黑谷薏米,其值为(209.0± 10.1)mg Trolox /100g样品;总ORAC值最高的是龙薏1号薏米(P<0.05),其值为(668.0±32.7)mg Trolox /100g样品,其次是辽宁5号薏米,其值为(508.4±19.3)mg Trolox /100g样品,3个测试品种中贵州黑谷薏米ORAC值最低,为(440.9 ± 22.2)mg Trolox /100g样品。薏米品种的总ORAC值数据与它们的总多酚含量保持一致性。在3个品种的薏米中,其总ORAC值有显著性差异(P<0.05)。龙薏1号和辽宁5号薏米的游离型ORAC值显著高于贵州黑谷薏米的游离型ORAC值(P<0.05),龙薏1号薏米的结合型ORAC值显著高于辽宁5号和贵州黑谷薏米(P<0.05)。
2.5 相关性分析和均值比较

图4 总多酚、总黄酮和ORAC值的相关性Fig.4 Correlations between total phenol and total flavonoid contents, between total phenol content and ORAC value, and between total flavonoid content and ORAC value
总多酚含量、总黄酮含量和总ORAC值的相关性见图4。在测试品种薏米样品中,其总多酚含量与总ORAC值显著相关(R2=0.933)。总黄酮含量与总ORAC值的相关系数是R2=0.935,总多酚含量与总黄酮含量相关系数为R2=0.425,它们之间不存在显著性相关。不同薏米品种中游离型和结合型的植物化学物质含量及抗氧化能力指数见表2。测试薏米品种中游离型多酚含量显著高于结合型多酚含量(P<0.05),结合型黄酮含量显著高于游离型黄酮含量(P<0.05),游离型和结合型ORAC值无显著性差异。

表2 游离型、结合型的多酚和黄酮含量与ORAC值的均值比较Table 2 Average values of free, bound and total phenol, flavonoid and ORAC of 3 adlay varieties
3 结 论
全谷物食品及其产品的消费与降低一些慢性病(心血管疾病、糖尿病、某些癌症等)的风险具有较大的联系。这些益处部分的由于全谷物中含有的一些唯一的植物化学物质所引起。薏米及其产品主要在亚洲地区食用,本实验主要报道了3个不同品种薏米的植物化学物质相关研究和抗氧化能力指数的评价。通过研究表明,薏米中含有较为丰富的植物化学物质和具有较强的抗氧化能力。样品中结合型多酚贡献了总多酚含量的45%,结合型黄酮贡献了总黄酮含量的71%。薏米中的结合型植物化学物质对于结肠细菌发酵后导致的结肠具有特殊的健康益处,可为后续研究薏米抗癌作用提供一定的依据。
[1]ANDERSON J W. Whole grains and coronary heart disease: the whole kernel of truth[J]. American Journal of Clinical Nutrition, 2004, 80(6): 1459-1460.
[2]MONTONEN J, KNEKT P, JA..RVINEN R, et al. Whole-grain and fiber intake and the incidence of type 2 diabetes[J]. American Journal of Clinical Nutrition, 2003, 77(3): 622-629.
[3]LIU Simin, WILLETT W C, MANSON J E, et al. Relation between changes in intakes of dietary fiber and grain products and changes in weight and development of obesity among middle-aged women[J]. American Journal of Clinical Nutrition, 2003, 78(5): 920-927.
[4]SCHATZKIN A. Dietary fiber and whole-grain consumption in relation to colorectal cancer in the NIH-AARP diet and health study[J]. American Journal of Clinical Nutrition, 2007, 85(5): 1353-1360.
[5]American Association of Cereal Chemists(AACC). AACC members agree on definition of whole grain[R]. St. Paul, MN: AACC, 1999. http://www.aaccnet.org/news/pdfs/wgPR.pdf.
[6]DECKER E, BEECHER G, SLAVIN J, et al. Whole grains as a source of antioxidants[J]. Cereal Foods World, 2002, 47(8): 370-373.
[7]SERPEN A, GOKMEN V, KARAGOZ A, et al. Phytochemical quantification and total antioxidant capacities of emmer (Triticum dicocconSchrank) and einkorn (Triticum monococcumL.) wheat landraces[J]. Journal of Agricultural and Food Chemistry, 2008, 56(16): 7285-7292.
[8]SHAO Yafang, ZHANG Gan, BAO Jinsong. Total phenolic content and antioxidant capacity of rice grains with extremely small size[J]. African Journal of Agricultural Research, 2011, 6(10): 2289-2293.
[9]OTTOBONI L M M, LEITE A, TARGON M L N, et al. Characterization of the storage protein in seed ofCoix lacrymajobivar adlay[J]. Journal of Agricultural and Food Chemistry, 1990, 38(3): 631-635.
[10]CHEN H J, CHUNG C P, CHIANG W C, et al. Anti-inflammatory effects and chemical study of a flavonoid-enriched fraction from adlay bran [J]. Food Chemistry, 2011, 126(4): 1741-1748.
[11]CHUNG C P, HSU H Y, HUANG D W, et al. Ethyl acetate fraction of adlay bran ethanolic extract inhibits oncogene expression and suppresses dmh-induced preneoplastic lesions of the colon in f344 rats through an anti-inflammatory pathway[J]. Journal of Agricultural and Food Chemistry, 2010, 58(13): 7616-7623.
[12]LI Singchung, CHEN Chiaoming, LIN Shuhui, et al. Effects of adlay bran and its ethanolic extract and residue on preneoplastic lesions of the colon in rats[J]. Journal of the Science of Food and Agriculture, 2011, 91 (3): 547-552.
[13]CHANG Huichiu, HUANG Yuchun, HUNG Wenchun, et al. Antiproliferative and chemopreventive effects of adlay seed on lung cancerin vitroandin vitro[J]. Journal of Agricultural and Food Chemistry, 2003, 51(12): 3656-3660.
[14]KUO C C, SHIH C C, KUO Y H, et al. Antagonism of free-radicalinduced damage of adlay seed and its antiproliferative effect in human histolytic lymphoma U937 monocytic cells[J]. Journal of Agricultural and Food Chemistry, 2001, 49(3): 1564-1570.
[15]LIANG C H, SYU J L, MAU J L. Antioxidant properties of solid-state fermented adlay and rice byPhellinus linteus[J]. Food Chemistry, 2009, 116(4): 841-845.
[16]ADOM K K, LIU Ruihai. Antioxidant activity of grains[J]. Journal of Agricultural and Food Chemistry, 2002, 50(21): 6182-6187.
[17]ADOM K K, SORRELLS M E, LIU Ruihai. Phytochemicals and antioxidant activity of milled fractions of different wheat varieties[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6): 2297-2306.
[18]de la PARRA C, SALDIVAR S O S, LIU Ruihai. Effect of processing on the phytochemical profiles and antioxidant activity of corn for production of masa, tortillas, and tortilla chips[J]. Journal of Agricultural and Food Chemistry, 2007, 55(10): 4177-4183.
[19]ADOM K K, SORRELLS M E, LIU Ruihai. Phytochemical profiles and antioxidant activity of wheat varieties[J]. Journal of Agricultural and Food Chemistry, 2003, 51(26): 7825-7834.
[20]SINGLETON V L, ORTHOFER R, LAMUELA-RAVENTOS R M. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent[J]. Methods in Enzymology, 1999, 299: 152-178.
[21]DEWANTO V, WU X Z, LIU Ruihai. Processed sweet corn has higher antioxidant activity[J]. Journal of Agricultural and Food Chemistry, 2002, 50(17): 4959-4964.
[22]HE Xiangjiu, LIU Dong, LIU Ruihai. Sodium borohydride/chloranilbased assay for quantifying total flavonoids[J]. Journal of Agricultural and Food Chemistry, 2008, 56(20): 9337-9344.
[23]HUANG Dejian, OU Baoxin, HAMPSCH-WOODILL M, et al. Highthroughput assay of oxygen radical absorbance capacity (ORAC) using a multichannel liquid handling system coupled with a microplate flourescence reader in 96-well format[J]. Journal of Agricultural and Food Chemistry, 2002, 50(16): 4437-4444.
[24]WOLFE K L, KANG Xinmei, HE Xiangjiu, et al. Cellular antioxidant activity of common fruits[J]. Journal of Agricultural and Food Chemistry, 2008, 56(18): 8418-8426.
[25]ZHANG Mingwei, ZHANG Ruifeng, ZHANG Fangxuan, et al. Phenolic profiles and antioxidant activity of black rice bran of different commercially available varieties[J]. Journal of Agricultural and Food Chemistry, 2010, 58(13): 7580-7587.
Analysis of Phenols, Flavonoids and Oxygen Radical Absorbance Capacity (ORAC) of Three Varieties of Adlay
WANG Li-feng1,2,HE Rong1,YUAN Jian2,JU Xing-rong2
(1. School of Food Science and Technology, Jiangnan University, Wuxi 214122, China;
2. School of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210046, China)
s :In order to explore the phytochemical profile of three adlay varieties, the levels of total, free and bound phenols and flavonoids were determined using a microplate reader. Meanwhile, the oxygen radical absorbance capacity (ORAC) was measured as an indicator for total antioxidant capacity using a multifunctional fluorescence microplate reader. The contents of free ((45.19 ± 0.91) mg of gallic acid equivalent/100 g of dried samples) and bound ((30.86 ± 1.18) mg of gallic acid equivalent/100 g samples) phenols in Longyi I were significantly higher than those in Liaoning V and Guizhou Heigu (P< 0.05). For all these adlay varieties, bound phenols averagely accounted for 45.28% of total phenols. The content of free flavonoids in Liaoning V showed a significant increase as compared with Longyi I and Guizhou Heigu, and the content of bound flavonoids in Longyi I was higher than that of Liaoning V and Guizhou Heigu. The highest content of total flavonoids was found in Liaoning V. The adlay varieties were ranked in decreasing order of ORAC as follows: Longyi I ((668.0 ± 32.7) mg of Trolox equivalent/100 g of dried samples), Liaoning V and Guizhou Heigu. The average percentage of bound ORAC in total ORAC was 48.08%. A correlation coefficient (R2) of 0.933 was observed for the significant correlation (P< 0.05) between the total phenol content and total antioxidant capacity of each adlay variety.
adlay;phenols;flavonoids;oxygen radical absorbance capacity(ORAC)
TS201.1
A
1002-6630(2012)01-0072-05
2011-11-24
江苏省“青蓝工程”青年骨干教师项目;江苏省政府留学奖学金项目
王立峰(1977—),男,副教授,硕士,研究方向为食品安全与营养。E-mail:wanglifeng_8@163.com
