脂肪氧化对蛋白质结构的影响
2012-10-27章银良安巧云
章银良,安巧云,杨 慧
(郑州轻工业学院食品与生物工程学院, 河南 郑州 450002)
脂肪氧化对蛋白质结构的影响
章银良,安巧云,杨 慧
(郑州轻工业学院食品与生物工程学院, 河南 郑州 450002)
为了探索脂肪氧化对蛋白质结构的影响,利用不同条件下制备的氧化脂肪,加入蛋白后在同样条件下作用一定时间,测定蛋白质的各项指标。结果表明:加入蛋白后硫代巴比妥酸值(TBA)值下降,蛋白氧化值升高(羰基含量),表面疏水性增加且最大发射波长(λmax)发生红移,二级结构变化明显。说明脂肪氧化对蛋白质结构产生了影响。
氧化脂肪;蛋白质;TBA值;蛋白氧化值;表面疏水性;二级结构
脂肪氧化分为脂肪氧化酶引起的酶催化氧化和非酶氧化[1]。引起非酶氧化的原因很多,包括自动氧化和光敏氧化。影响脂类非酶氧化的主要因素包括氧浓度、温度、脂类浓度以及助氧化剂、辐射能等。
在食品中,一般都包括糖类、脂肪和蛋白质三大类营养物质。而目前已发现脂肪存在时发生氧化会对蛋白质产生影响。例如Saeed 等[2]利用电子自旋共振(ESR)发现从大西洋鲭鱼中提炼出来的油脂氧化后会使蛋白质包括卵溶菌酶、鸡蛋卵清蛋白、鱼类肌球蛋白和氨基酸(精氨酸、赖氨酸和组氨酸)受到破坏。脂肪氧化大大缩短了冷冻鱼许多品种的货架保质期,特别是多脂肪的鱼类易产生恶臭不利于消费[3]。研究表明冷冻储存的脂肪氧化产品会使鱼的组织蛋白变硬、聚集。此外,还损失了一些氨基酸,如半胱氨酸、赖氨酸、组氨酸和蛋氨酸,以及损害其他色素蛋白质,如细胞色素C和血红蛋白[4]。
脂类的过氧化产物与蛋白质的共价结合和脂类诱导的蛋白质聚合反应可能包括两种机理:自由基反应和羰氨反应[5]。目前脂肪氧化的程度以及氧化产物的种类如何引起蛋白质变性和具体的变性程度却还没有得到深入研究。本实验拟采用不同氧化条件对亚油酸进行氧化,加入牛血清蛋白初步探究氧化产物种类与蛋白质变性聚集程度之间的关系,以期为肉类加工的品质提高提供参考。
1 材料与方法
1.1 材料与试剂
牛血清蛋白(BSA,生物试剂) 北京Solarbio试剂公司;亚油酸(LA,含量≥99%) 北京百灵威公司;吐温-20(化学纯) 中国医药(集团)上海化学试剂公司;2-硫代巴比妥酸(TBA)、冰乙酸、乙酸乙酯、无水乙醇、NaH2PO4·2H2O、Na2HPO4·2H2O、2,4-二硝基苯肼(DNPH)、三氯乙酸(TCA)、盐酸胍、8-苯氨基-1-萘磺酸(ANS);以上均为分析纯。
1.2 仪器与设备
T6型紫外-可见分光光度计 北京普析通用仪器有限责任公司;F-7000型荧光分光光度计 日本Hitachi公司;Nicolet 5700型FT-IR傅里叶红外光谱仪 美国Thermo公司;CoolSafe 55-4型真空冷冻干燥机 丹麦Labogene公司 ;GL-22M型高速冷冻离心机 赛特湘仪离心机仪器有限公司;HH-W420型数显三用恒温水箱金坛市医疗仪器厂。
1.3 方法
在不同条件下制得的脂肪氧化产物种类和脂肪氧化程度可能各不相同,在此氧化物基础上再加入蛋白原样,固定反应时间和条件,以此鉴定不同的脂肪氧化产物对蛋白的不同影响。即实验只改变脂肪的氧化条件而固定加入蛋白后的反应条件。以下反应体系均用40mL蒸馏水做溶液,20μL吐温-20做表面活性剂。
1.3.1 氧化脂肪的制备
1.3.1.1 不同氧浓度条件下的氧化脂肪的制备
选用实验组A和对照组a共2组平行体系,其中每组中设4个体系都加入20μL LA,间歇振荡摇匀,使LA及吐温-20均充分溶于水中,之后分别置于转速为0、50、100、150r/min的25℃恒温摇床中,氧化时间均为4h。4个体系按转速由低到高分别记为1~4组。一般转速越高,氧浓度也相应升高。
1.3.1.2 不同温度条件下的氧化脂肪的制备
选用实验组B和对照组b共2组平行体系,其中每组中设4个体系都加入20μL的LA,间歇振荡摇匀,使LA及吐温-20均充分溶于水中,之后分别置于温度为-18、0、25、40℃条件下,氧化时间均为4h。4个体系按温度由低到高分别记为1~4组。
1.3.1.3 不同时间条件下的氧化脂肪的制备
选用实验组C和对照组c共2组平行体系,其中每组中设4个体系都加入20μL的LA,间歇振荡摇匀,使LA及吐温-20均充分溶于水中,置于25℃的水浴锅中,反应时间分别为2、4、6、8h。4个体系按时间由长到短分别记为1~4组。
1.3.1.4 不同脂肪含量条件下的氧化脂肪的制备
选用实验组D和对照组d 共2组平行体系,其中每组中设4个体系分别添加LA的量为10、20、30、40μL。间歇振荡摇匀,使LA及吐温-20均充分溶于水中,温度均为25℃,氧化时间均为4h。4个体系按LA含量由低到高分别记为1~4组。
1.3.2 氧化脂肪与蛋白模拟体系的配制
上述各组体系反应后A、B、C、D组分别加入80mg的BSA,振荡混匀,25℃条件下反应4h,测定脂肪TBA值的变化。
平行组(a、b、c、d)组不加BSA,同样25℃条件下反应4h。作为对照组比较脂肪TBA值的变化。
1.3.3 油脂硫代巴比妥酸值(TBA值,即丙二醛含量)的测定
参照Witte等[6]的方法略做修改:精密量取20mL的液体样品,将其转入到常量凯氏蒸馏瓶中,加入2mL 6mol/L盐酸溶液(使pH值为1.5左右),以蒸馏水蒸气,准确收集50.0mL蒸馏液。之后移取5.0mL蒸馏液于20mL比色管中,以蒸馏水作空白对照,加入浓度为0.02mol/L的TBA醋酸溶液5.0mL,加盖密封,充分混合均匀,95℃水浴40min,再快速用冷水冲洗冷却(约10min)至室温。用分光光度计测量其在波长532nm处的吸光度。

式中:A为吸光度;155为吸光系数/(L/(mmol·cm));L为光径/cm;m为样品质量/g。
1.3.4 蛋白质氧化值的测定
参考Levine等[7]的方法略作修改,将样液稀释3倍配成0.9~1.2mg/mL的蛋白溶液。取1mL蛋白溶液与1mL 10mmol/L的DNPH(用2mol/L的HCl溶解)混匀,并用不含DNPH的2mol/L HCl溶液作空白对照;将各个反应体系置于黑暗中放置1h,每隔10min漩涡1次;反应完毕后,加入1mL 20%的TCA溶液沉淀蛋白质腙衍生物,4℃条件下,以12000×g离心15min,弃上清;得到的沉淀用1mL乙醇和乙酸乙脂混合物(体积比1:1) 洗涤3次除去未结合的DNPH,最后的沉淀用3mL 6mol/L 的盐酸胍溶解(37℃,水浴15min);12000 ×g离心15min除去不溶物质,取上清,在波长370nm处测吸光度。1.3.5 表面疏水性的荧光强度测定
采用荧光探针ANS。将0.5mL样液与1.5mL含0.6mol/L KCl的磷酸盐缓冲溶液(pH7.0)混匀,使其蛋白质量浓度在0~1mg/mL范围内,取2mL上述溶液,加入10μL 8mmol/L ANS,混合均匀在暗处放置10min,测定条件为激发波长374nm(狭缝2.5nm),扫描速度为1200nm/min,扫描范围为400~600nm,测定其荧光强度[8]。
1.3.6 蛋白质二级结构的测定
取各体系样品1和4做FI-IR分析。将样液首先放入-70℃冰箱中冷冻约8h,再放入真空冷冻干燥机中干燥10h可得干燥粉末。利用傅里叶红外光谱仪,将干燥后的样品粉末均匀地铺满ATR采样器附件的Ge晶片上,进行扫描收集样品光谱,扫描范围650~4000cm-1,扫描次数256次,分辨率4cm-1。
2 结果与分析
2.1 TBA值对蛋白质影响
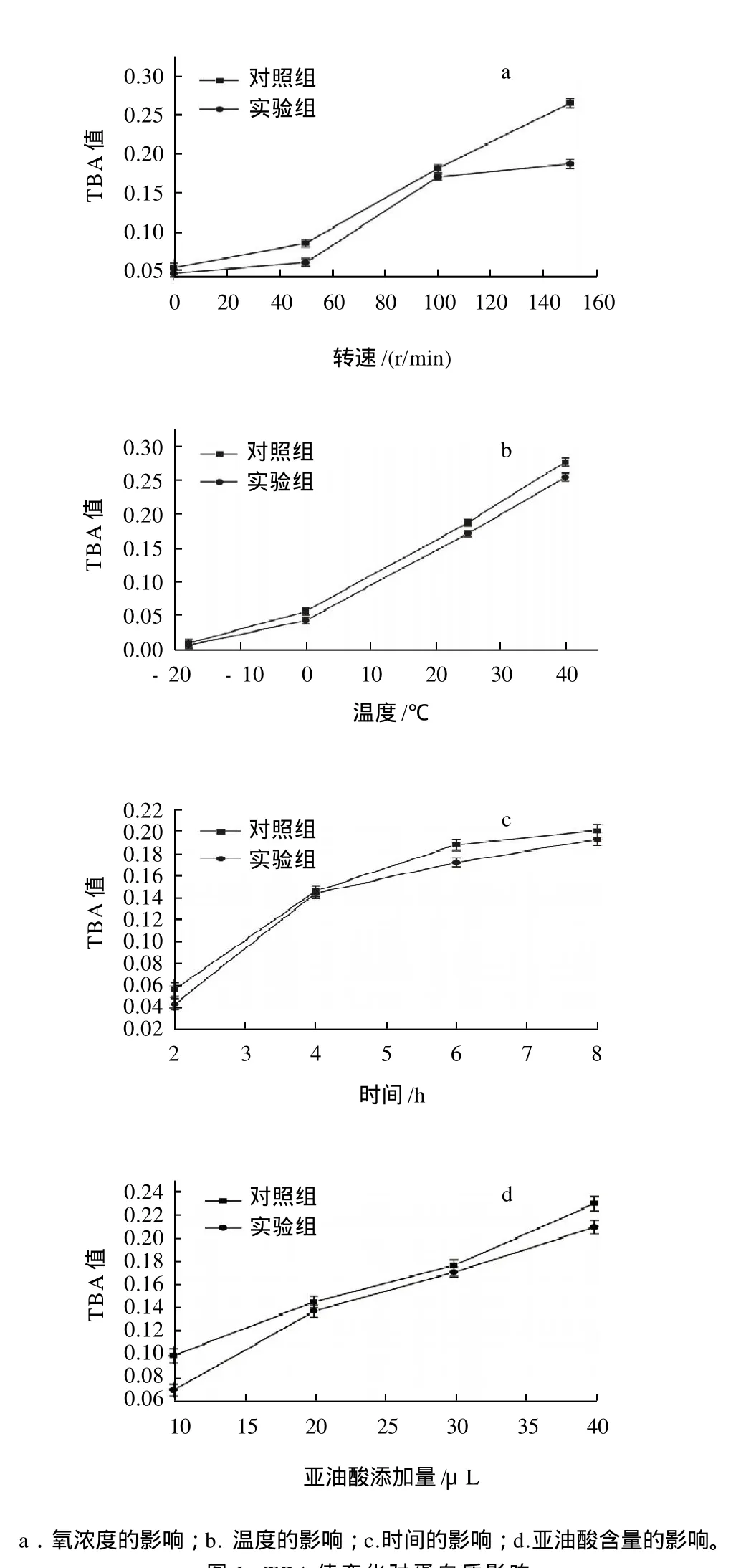
图1 TBA值变化对蛋白质影响Fig.1 Effect of TBA value change on protein structure
从图1可见,无论是实验组还是对照组中TBA值均逐渐增大。图1a中转速达到50r/min后得到的氧化脂肪TBA值迅速上升;图1b中温度超过0℃后得到的氧化脂肪TBA值也上升较快;图1c中不同反应时间中4h内得到的氧化脂肪TBA值变化较大,之后趋于缓慢;图1d中随着LA含量的增大得到的氧化脂肪TBA值一直呈增大趋势,表明脂肪氧化产物丙二醛量都有不同程度的增加。
最重要的是添加蛋白质的反应组TBA值均比对照组减小了,统计学得出图1a中转速为0的实验组与对照组差异不显著(P=0.053>0.05),其他转速均有显著性差异;图1b中-18℃条件下的P=0.226,实验组与对照组无显著差异,其他温度条件下都有显著性差异;图1c的氧化时间4h时的P=0.07,实验组与对照组无显著差异,其他氧化时间条件下都有显著性差异;图1d中的LA含量条件为30μL时P=0.081,实验组与对照组无显著差异,其他含量下都有显著性差异。说明丙二醛一部分与蛋白质发生了反应,导致蛋白质交联[9]。脂类氧化产物与蛋白质的作用机理其一即是羰氨反应:脂质氧化的次生产物(醛类或者酮类化合物)的羰基可与蛋白质分子的氨基等侧链基团发生反应,导致多肽链的链内交联和链间交联[10]。脂肪TBA值的变化侧面反映了脂肪氧化产物对蛋白质变性的影响。
2.2 蛋白质氧化值(羰基含量)的测定结果
比色法是测定蛋白质羰基含量的经典方法。DNPH法工作原理是蛋白质被氧化后羰基含量会增多,羰基可与DNPH结合,反应生成2,4-二硝基苯腙,腙类物质为红棕色的沉淀,用盐酸胍溶解后在波长370nm处有一定的吸光度,从而可以测得蛋白质的羰基含量[11]。

表1 各组中蛋白质的氧化值Table 1 Oxidation value of BSA in each group
由表1可见,不同氧浓度条件下引起的蛋白质氧化值变化差异较显著;-18℃和0℃对结果的影响不够明显;随着时间增加到6h与8h没有显著差异,LA含量同样为30μL和40μL没有显著差异。各组体系中的羰基含量都增加,原因是脂质过氧化反应中产生的自由基可使蛋白质变性[12]:几乎组成蛋白质的所有氨基酸对羟自由基(·OH)及超氧阴离子自由基(O2-·)的攻击都很敏感,尤其是在侧链上带有NH或NH2的氨基酸对羟自由基更为敏感。在反应过程中,这些敏感基团被自由基攻击转化成羰基基团[13-14],从而导致羰基含量的增加。之后还会进一步引起蛋白质分子的肽键的断裂、聚合等变化,并使蛋白质与脂类结合,生成聚合物。表1中氧浓度组测得的羰基含量最高,也说明含氧量多的脂肪更易产生自由基促进蛋白质变性。此方面结论和蛋白质与脂类作用机理中的自由基作用相一致。
2.3 蛋白质表面疏水性的测定结果
蛋白质分子中的酪氨酸、色氨酸和苯丙氨酸残基能受到激发而产生荧光,激发后可在304、348nm(激发波长280nm)和282nm(激发波长260nm)测定其荧光强度,而其他氨基酸则不产生内源荧光。利用蛋白质的外源荧光性质研究获得更多关于蛋白质分子的信息[9]。因为蛋白质的表面疏水性与蛋白质的空间结构、蛋白质所呈现的表面性质和脂肪结合能力等有关,更能反映出它同水、其他化学物质产生作用时的实际情况。测定外源荧光最常用的荧光探针是ANS[15]。

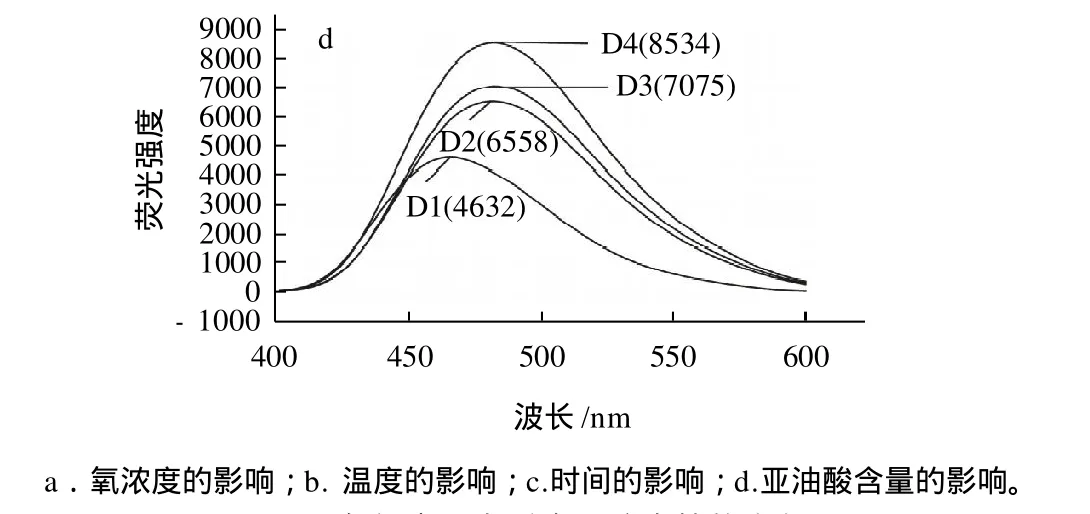
图2 各组中蛋白质表面疏水性的变化Fig.2 Change in surface hydrophobicity of BSA in each group
由图2可见,各组中荧光强度都逐渐升高,也就是表面疏水性升高。原因可能是蛋白质分子解折叠,使肽链断裂或结构伸展,分子的内部疏水基团暴露(包括疏水性的芳香族和芳香性氨基酸侧链基团暴露)导致表面疏水性的增加。从图2还可以看出,最大发射波长都随着荧光强度的增加不同程度的向长波方向(红移)移动,表明蛋白质分子解折叠造成色氨酸残基暴露于表面,而荧光强度的增加说明此时暴露的色氨酸残基还没有被氧化[16]。
2.4 蛋白质二级结构分析
蛋白质和多肽的二级结构在红外区的9个特征吸收带中,酰胺Ⅰ带(1600~1700cm-1) 对于研究二级结构最有价值。通常认为1600~1640cm-1为β-折叠(β-sheet);1640~1650cm-1为无规卷曲(random);1650~1658cm-1为α-螺旋(α-helix);1660~1695cm-1为β-转角(β-turn)[17]。
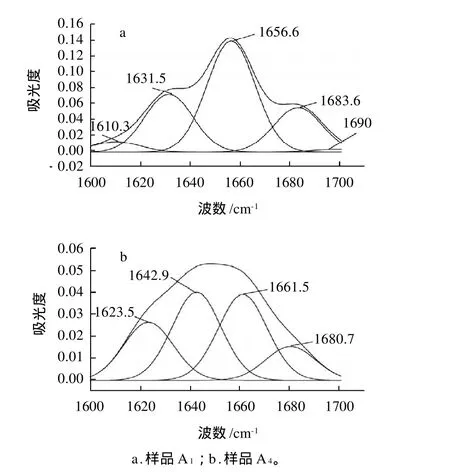
图3 样品A1和A4红外图谱经过自动去卷积后的酰胺I带分布图Fig.3 Distribution of amide I band in infra-red fourier selfdeconvolved spectra of samples A1 and A4
通过对蛋白质酰胺吸收带的去卷积、二阶导数和拟合分析,在变性条件下观察到蛋白质新构象的产生、部分或全部去折叠引起的二级结构的破坏、二级结构相对含量的变化。对4个体系的样品1和4蛋白质的FT-IR图谱选择在波数1600~1700cm-1范围用Peakfit 4.12软件分析,得到红外图谱经过自动去卷积后的酰胺I带分布及二级结构各成分面积比例的变化。
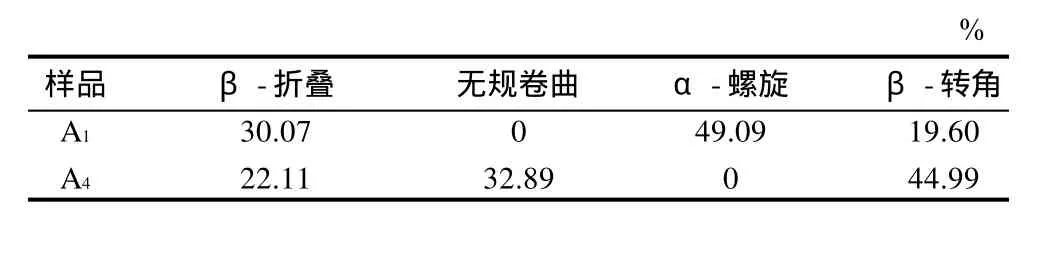
表2 样品A1和A4不同体系中蛋白质酰胺I带的分析Table 2 Analysis of amide I band in FT-IR spectra of samples A1 and A4
由图3和表2可见,氧浓度组(A组),从样品A1到A4结构稳定的α-螺旋减少为0,大部分转向了不稳定的β-转角,而且还出现了32.89%的无规卷曲,可以看出氧浓度不同引起的氧化脂肪对蛋白质二级结构引起了较大的变化。
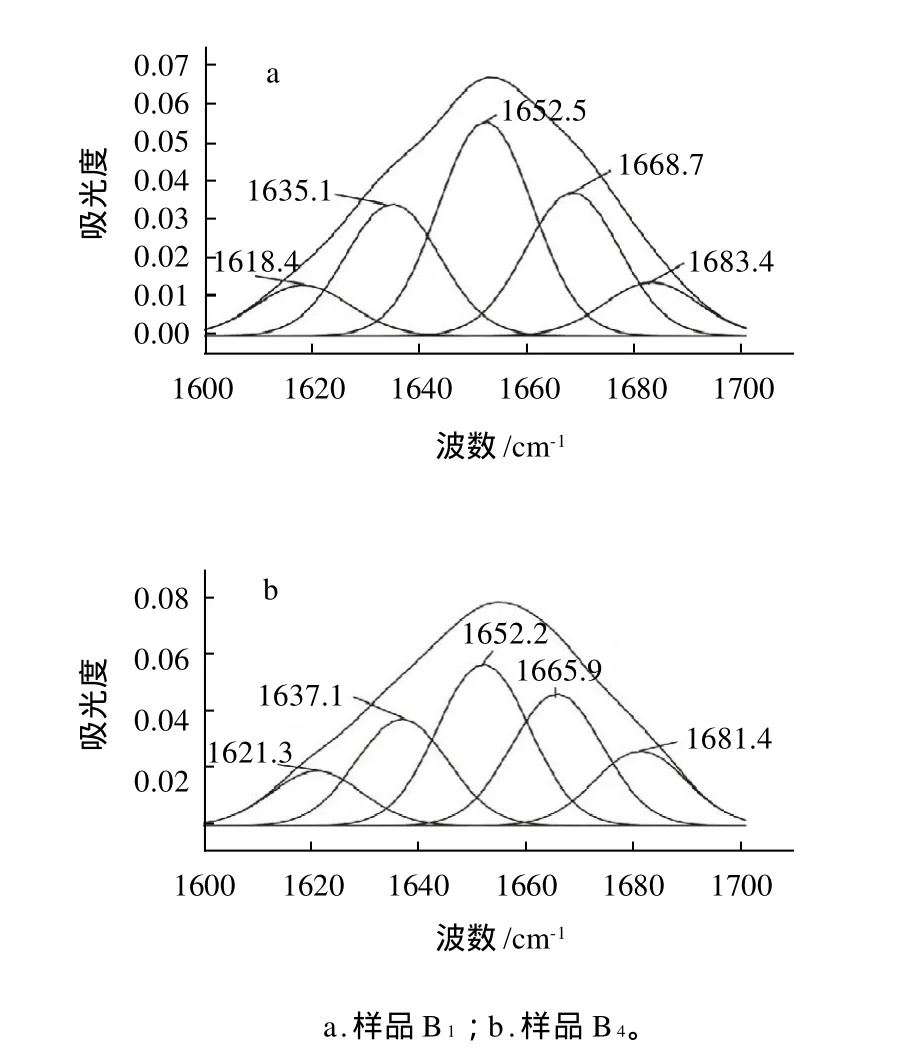
图4 样品B1和B4红外图谱经过自动去卷积后的酰胺I带分布图Fig.4 Distribution of amide I band in infra-red fourier selfdeconvolved spectra of samples B1 and B4

表3 样品B1和B4不同体系中蛋白质酰胺I带的分析Table 3 Analysis of amide I band in FT-IR spectra of samples B1 and B4
由图4和表3可见,温度组(B组),从样品B1到B4,β-折叠稍有减少,α-螺旋从65.89%减少到36.13%,β-转角也相对增加,说明蛋白质由稳定的结构逐渐变得不稳定,这与2.3节提到的表面疏水性结果相一致,蛋白质分子发生了解折叠,导致肽链断裂或结构伸展等。

图5 样品C1和C4红外图谱经过自动去卷积后的酰胺I带分布图Fig.5 Distribution of amide I band in infra-red fourier selfdeconvolved spectra of samples C1 and C4

表4 样品C1和C4不同体系中蛋白质酰胺I带的分析Table 4 Analysis of amide I band in FT-IR spectra of samples C1 and C4
由图5和表4可见,时间组(C组),从样品C1到C4,规则的α-螺旋减少了大约一半,主要转化成了不规则的β-转角,说明蛋白的二级结构随着时间的变化也发生了变化。


图6 样品D1和D4红外图谱经过自动去卷积后的酰胺I带分布图Fig.6 Distribution of amide I band in infra-red fourier selfdeconvolved spectra of samples D1 and D4

表5 样品D1和D4不同体系中蛋白质酰胺I带的分析Table 5 Analysis of amide I band in FT-IR spectra of samples D1 and D4
由图6和表5可见,样品D1和D4蛋白质的二级结构变化程度也不同。表明不同氧化程度和不同氧化产物对蛋白的变性程度也有所影响。
3 结 论
利用不同条件下制备的氧化脂肪,加入蛋白后在相同条件下作用一定时间,测定蛋白质的各项指标。结果表明,加入蛋白后TBA值下降,蛋白氧化值升高(羰基含量),表面疏水性增加且最大发射波长(λmax)发生红移,蛋白质二级结构变化明显。由此推论脂肪氧化对蛋白质结构产生了影响,脂肪氧化产物和蛋白质作用的两种可能机理:羰氨反应和自由基反应。
[1]谢笔钧. 食品化学[M]. 2版. 北京: 科学出版社, 2004: 92.
[2]SAEED S, HOWELL N K. Effect of lipid oxidation and frozen storage on muscle proteins of Atlantic mackerel[J]. Journal of the Science of Food and Agriculture, 2002, 82: 579-586.
[3]KILINC B, CAKLI S. Chemical, microbiological and sensory changes in thawed frozen fillets of sardine(Sardina pilchardus)during marination [J]. Food Chemistry, 2004, 88: 275-280.
[4]LAURITZSEN K, AKSE L, JOHANSEN A, et al. Physical and quality attributes of salted cod as affected by the state of rigor and freezing prior to salting[J]. Food Research International, 2004, 37: 677-688.
[5]FENNEMA O R, POWRIE W D, MARTH E H. Low temperature preservation of foods and living matter[M]. New York: Marcel Dekker Inc, 1973: 1-77.
[6]WITTE V C, KRAUSE G F, BAILEY M E. A new extraction method for determining 2-thiobarbituric acid values of pork and beef during storage[J]. Journal of Food Science, 1970, 35: 582-585.
[7]LEVINE R L, GARLAND D, OLIR C N, et al. Determination of carbonyl content in oxidatively modified proteins[J]. Methods Enzymol, 1990, 186: 464-478.
[8]章银良. 海鳗腌制加工技术的研究[D]. 无锡: 江南大学, 2007.
[9]阚建全. 食品化学[M]. 2版. 北京: 中国农业大学出版社, 2008: 95.
[10]HUANG Youru, HUA Yufei, QIU Aiyong. Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J]. Food Research International, 2006, 39(2): 240-249.
[11]段丽菊, 朱燕, 胡青莲, 等. 甲醛吸入致小鼠蛋白质氧化损伤作用的研究[J]. 环境科学学报, 2005, 25(6): 851-854.
[12]崔旭海, 孔保华. 抗氧化剂对羟自由基引起的乳清分离蛋白氧化抑制效果的研究[J]. 食品科学, 2010, 31(3): 5-10.
[13]STADTMAN E R. Oxidation of free amino acids and amino acid residues in proteins by radiolysis and by metal-catalyzed reactions[J]. Annual Review of Biochemistry, 1993, 62: 797-821.
[14]SANTE-LHOUTELLIER V, AUBRY L, GATELLIER P. Effect of oxidation onin vitrodigestibility of skeletal muscle myofibrillar proteins [J]. Journal of Agricultural and Food Chemistry, 2007, 55(13): 5343-5348.
[15]ERKAN N, OZDEN O, ALAKAVUK D U, et al. Spoilage and shelf life of sardines(Sardina pilchardus) packed in modified atmosphere[J]. European Food Research Technology, 2006, 222: 667-673.
[16]黄友如. 脂肪氧合酶催化LA诱导大豆蛋白聚集机理[D]. 无锡: 江南大学, 2006.
[17]BYLER D M, BROUILLETTE J N, SUSI H. Quantitative studies of protein structure by FT-IR spectral deconvolution and curve fitting[J]. Spectroscopy,1986, 1(3): 29-32.
Effect of Lipid Oxidation on Protein Structure
ZHANG Yin-liang,AN Qiao-yun,YANG Hui
(School of Food and Bioengineering, Zhengzhou University of Light Industry, Zhengzhou 450002, China)
This paper deals with the effect of lipid oxidation on protein structure. Oxidized lipid products were prepared by oxidizing linoleic acid under different conditions and allowed to react with bovine serum albumin (BSA) under the same conditions (25 ℃, 4 h). Changes in various properties of BSA were determined during the reaction with oxidized lipid products. The results showed that oxidized lipid products revealed a decrease in thiobarbituric acid value (TBA) after reaction with BSA, while the oxidation value (carbonyl group content) and surface hydrophobicity of BSA increased. Meanwhile, the maximum emission wavelength of the protein showed a red shift and the secondary structure varied obviously. Therefore, lipid oxidation has a significant impact on protein structure.
lipid oxidation;protein;TBA value;protein oxidation value;surface hydrophobicity;secondary structure
TS201.2
A
1002-6630(2012)01-0025-06
2011-02-13
郑州轻工业学院博士基金项目(2007BSJJ007)
章银良(1963—),男,教授,博士,研究方向为食品化学与食品质量安全。E-mail:zhyinliang@163.com
