大豆蛋白的酶水解及类蛋白反应对其抗氧化活性的影响
2012-10-27宋佳天赵新淮
宋佳天,赵新淮*
(乳品科学教育部重点实验室,东北农业大学,黑龙江 哈尔滨 150030)
大豆蛋白的酶水解及类蛋白反应对其抗氧化活性的影响
宋佳天,赵新淮*
(乳品科学教育部重点实验室,东北农业大学,黑龙江 哈尔滨 150030)
采用Alcalase 2.4L FG蛋白酶水解大豆蛋白,筛选并制备出ABTS+·清除率最高的水解物,其水解度为14.0%,对ABTS+·清除率为43.6%。以此水解物为底物,以修饰产物的游离氨基减少量为指标,应用响应面分析得到类蛋白反应的优化条件为:酶添加量1037U/g pro、底物质量浓度30g/100mL、温度20℃。在此条件下反应6h,水解物的修饰反应程度和抗氧化活性均为最大。制备反应程度不等的3个修饰产物,进一步抗氧化活性分析表明:大豆蛋白水解物及其修饰产物的抗氧化活性好于大豆蛋白;修饰产物与水解物的DPPH自由基清除能力、还原力、超氧阴离子自由基(O2-·)清除率差别不显著,但是对羟自由基(·OH)清除率差别显著。
大豆蛋白水解物;类蛋白反应;抗氧化活性;响应面
已经证实,自由基引发的生物体氧化会导致细胞的死亡和组织损伤[1],也是导致人体衰老的重要原因。抗氧化剂,如酚类化合物和抗氧化肽能够保护机体免受自由基的伤害,并延缓某些慢性疾病的过程[2-3]。由酶水解蛋白质产生的生物活性肽,具有潜在的生理调节作用,其活性取决于氨基酸组成和序列[4]。基于这些结构,它们就很可能表现出某种活性,如抗氧化性[5-6]。
类蛋白(plastein)反应是酶催化的蛋白质水解的逆过程,由较低分子质量的肽形成类似于蛋白质的混合物[7]。在反应过程中由于同时存在水解作用、缩合作用、转肽作用和物理聚集[8],极有可能生成新结构组成的肽,从而影响其生物学活性。已有研究证实,酪蛋白水解物的类蛋白反应可以提高其抗氧化性[9]。为此,本实验通过对大豆蛋白水解物的类蛋白反应修饰及其条件优化,研究Alcalase 2.4L FG蛋白酶催化的水解反应以及随后的类蛋白反应对大豆蛋白水解物的抗氧化活性的影响。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白 哈尔滨高科技蛋白有限公司。
Alcalase 2.4L FG蛋白酶(酶活力1×105U/mL) 诺维信生物技术有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-连氮-双-(3-乙基苯并噻唑啉-6-磺酸)(ABTS)美国Sigma公司;铁氰化钾 天津市博迪化工有限公司;邻二氮菲 天津市科密欧化学试剂开发中心;邻苯三酚 浙江省温州市瓯海精细化工公司;其他试剂均为分析纯,水为蒸馏水或超纯水。
1.2 仪器与设备
UV-2401PC型紫外-可见分光光度计 日本岛津公司;Kjeltec TM2300型自动凯氏定氮仪 瑞士Foss公司;LG-21M高速冷冻离心机 上海市离心机械研究所;LGJ-1型真空冷冻干燥机 上海医用分析仪器厂;HZQ-F160型全温振荡培养箱 哈尔滨东联电子技术开发有限公司;DELTA 320型精密pH计、AL204型分析天平 梅特勒-托利多仪器中国有限公司;QT-1型微型漩涡混合器 上海琦特分析仪器有限公司;YH-4BS型远红外恒温干燥箱 天津市中环实验电炉有限公司;DK-98-1型电热恒温水浴锅 天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 碱性蛋白酶大豆蛋白水解物的制备[10]
配制质量浓度为100mg/mL的大豆分离蛋白溶液,以2mol/L NaOH溶液调节pH值至8.0,Alcalase 2.4L FG蛋白酶添加量为1000U/g pro,50℃恒温水浴中进行酶解。不同水解时间(0.5~7h)取出样品20mL,迅速在100℃沸水浴中加热15min,冷却至室温后以2mol/L HCl溶液调节pH值至4.5,然后8000×g离心15min,分离出上清液。测定各个上清液的蛋白质含量和游离氨基含量,计算其水解度。再将各个上清液稀释至同一浓度,测定其ABTS+·清除率。
根据测定结果,确定适宜的水解时间,放大实验制备ABTS+·清除率最高的大豆蛋白水解物,冷冻干燥后保存于-20℃备用。
1.3.2 大豆蛋白水解物的类蛋白反应条件优化
采用中心组合试验,固定反应时间为6h,以反应体系的游离氨基减少量为响应值,参考李亚云等[11]的研究,分别研究酶添加量、底物质量浓度、反应温度的影响,采用三因素五水平响应面分析方法,其因素水平编码见表1。

表1 大豆蛋白水解物类蛋白反应条件响应面分析的因素水平编码表Table 1 Coded values and corresponding actual values of the reaction parameters used in response surface analysis
1.3.3 指标测定
1.3.3.1 蛋白质含量、酶活力、游离氨基含量及蛋白质水解度测定
蛋白质含量的测定:凯氏定氮法[12];蛋白酶活力的测定:福林-酚法[13];游离氨基含量及蛋白质水解度(DH)的测定:邻苯二甲醛法[14-15]。水解度计算公式[16]为:

式中:5.71为大豆蛋白质的换算系数;0.35为大豆分离蛋白的游离氨基含量/(mmol/g);7.8为大豆蛋白的肽键含量/(mmol/g);N1为大豆蛋白水解物的氮含量/(mg/mL)。
1.3.3.2 DPPH自由基的清除能力测定[17]
取D PPH 0.0 0 7 9g,以无水乙醇溶解并定容至100mL,配制成浓度为20μmol/L的乙醇溶液,放置于棕色瓶并暗处保存。将样品适当稀释以保证使分析时吸光度在0.7以下。取1mL DPPH溶液与2mL样品溶液(5.0mg/mL)混合并及时在暗处放置反应30min,然后测定其在波长517nm处的吸光度。同时,利用无水乙醇进行空白实验,平行实验3次。DPPH自由基清除率的计算公式如下:
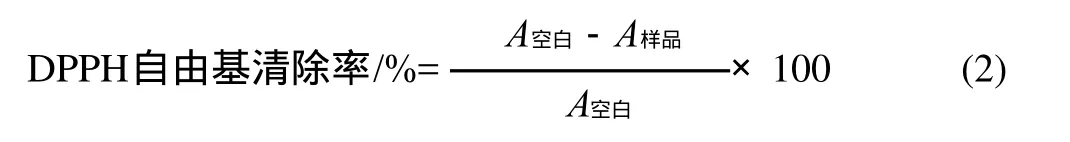
1.3.3.3 ABTS+·清除能力测定[18]
ABTS+·溶液由2mL ABTS+·溶液(7mmol/L)与1mL过硫酸钾溶液(终浓度2.45mmol/L)反应产生;混合物在使用前于暗处室温下保存12~16h。测定时,ABTS+·溶液用5mmol/L磷酸盐缓冲液(pH7.4)稀释至波长734nm处的吸光度在0.7附近。30℃条件下50μL样品溶液(2.0mg/mL)与5mL已稀释的ABTS+·溶液混合,于1、4、6min测定其在734nm波长处的吸光度。每个样品重复测定3次。以不含A B T S+·溶液的磷酸盐缓冲液作空白。ABTS+·的清除率按式(3)计算。
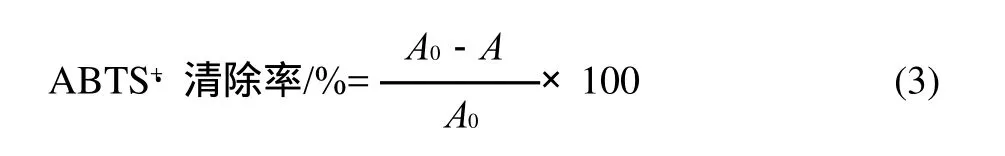
式中:A0为波长734nm处空白的吸光度;A为波长734nm处样品的吸光度。
1.3.3.4 还原力测定[19]
取5.0mg/mL的样品液1mL,与2.5mL磷酸钠缓冲液(0.2mol/L,pH6.6)和2.5mL 1%铁氰化钾溶液混合,50℃恒温反应30min,迅速冷却并加入2.5mL 10%的三氯乙酸溶液;5000×g离心10min,取2.5mL上清液,加入2.5mL蒸馏水和0.5mL 0.1%氯化铁溶液,混匀。反应10min后,700nm波长处测定吸光度,并以此表示还原力。吸光度越大说明还原能力越强。
1.3.3.5 ·OH清除能力的测定[20]
取2.0mL 0.75mmol/L邻二氮菲-磷酸盐缓冲液(0.15mol/L,pH7.4)与2.0mL 0.15mol/L FeSO4磷酸盐缓冲液(0.15mol/L,pH7.4)充分混合,然后加入1.0mL样品溶液(5.0mg/mL)和1.0mL质量分数为0.01%的H2O2溶液;37℃保温60min后,在波长536nm处测定吸光度。·O H清除率计算按式(4)计算。
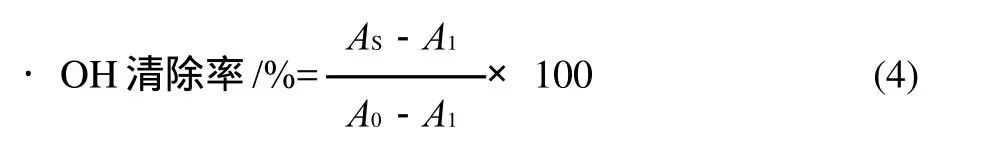
式中:AS为样品的吸光度;A1为含邻二氮菲、FeSO4和H2O2的对照样吸光度;A0为含邻二氮菲和FeSO4的空白溶液的吸光度。
1.3.3.6 O2-·清除能力的测定[21]
采用邻苯三酚自氧化方法。首先,1.0mL样品溶液(1.0mg/mL)与1.8mL 50mmol/L Tris-HCl缓冲液(pH8.2)混合;25℃保温反应10min,加入0.1mL 10mmol/L邻苯三酚溶液(溶于10mmol/L的HCl)。于320nm波长处测定溶液的吸光度,每30s读数一次,读数总时间为4min。邻苯三酚氧化速率由吸收率曲线的斜率(ΔA1)表示。空白样邻苯三酚的自氧化速率测定以1.0mL双蒸水代替样品溶液进行测定得到。O2-·清除率按式(5)计算。
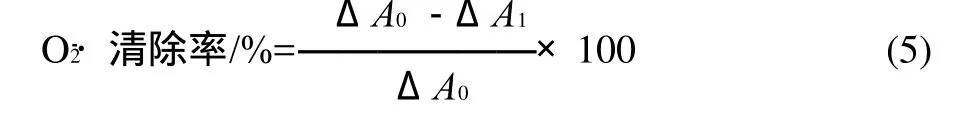
式中:ΔA0和ΔA1分别为空白样、样品测定时的吸光度曲线斜率。
1.3.4 数据统计分析
采用Excel2003软件、SPSS13.0软件和Design Expert7.0软件对数据进行处理、统计分析和绘图。
2 结果与分析
2.1 大豆蛋白水解物的制备
由图1可见,大豆蛋白水解物的抗氧化性随着其水解度的增大而增大。显著性分析发现,在水解时间为6h时,大豆蛋白水解物的水解度为14.0%,对ABTS+·的清除率达到43.6%;统计分析则显示,如果水解时间延长至7h,水解物的ABTS+·清除率无显著提高(P≥0.05)。故此,制备水解度为14.0%的水解物为随后进行的类蛋白反应的底物。
2.2 类蛋白反应条件的优化
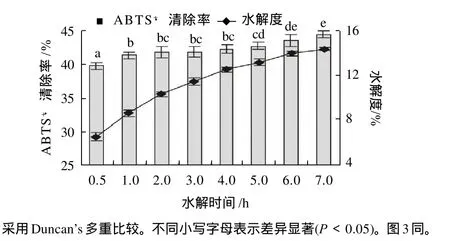
图1 大豆蛋白水解物的水解度和ABTS+·清除率Fig. 1 Effect of hydrolysis time on degree of hydrolysis and ABTS+ radical scavenging rate of SPI hydrolysates
利用Alcalase 2.4L FG蛋白酶对所制备的大豆蛋白水解物进行类蛋白反应,参照吴丹等[9]的研究结果,固定反应时间6h,并按照中心组合试验进行20组试验。应用Design Expert7.0软件作响应面曲面图,分析酶添加量、底物浓度和温度对修饰产物游离氨基减少量的影响(各个响应面中,另一条件为零水平条件),结果如图2所示。
图2a、b、c分别表示酶添加量与底物质量浓度、酶添加量与温度、底物质量浓度与温度对类蛋白反应体系中游离氨基减少量(Y)的影响。将试验数据进行二次多项回归拟合,剔除不显著的因素后得到二次多项式回归方程如下:Y=-98.05488+5.57190X2+6.98181X3+0.14064X2X3-1.25957×10-4X12-0.16811X22-0.25260X32。
以类蛋白反应后产物的游离氨基减少量为指标,通过方程式的求解,得到反应的最优条件为:酶添加量1037U/g pro、底物质量浓度30g/100mL、温度20℃。此条件下游离氨基减少量的理论值为177μmol/g pro;验证实验表明3次实验结果的平均值为171μmol/g pro,表明预测结果与实际情况很好的相符。,


图2 类蛋白反应条件对反应体系中游离氨基减少量的影响情况Fig.2 Response surface plots showing the interaction effects of the reaction parameters on the reduction of free amino groups
2.3 大豆蛋白水解物类蛋白反应修饰产物的抗氧化活性
2.3.1 大豆蛋白水解物类蛋白反应修饰产物的ABTS+·清除率
在酶添加量1037U/g pro、底物质量浓度30g/100mL 、温度20℃的条件下,对大豆蛋白水解物进行修饰,在反应时间为1~8h条件下得到8个修饰产物。通过分析发现,反应体系的游离氨基减少量随反应时间变化而不规则变化(图3) ,其范围在92.6~169.0μmol/g pro。在反应的开始,体系中的游离氨基含量逐渐减小,而反应6h后呈现增加,说明反应时间过长可导致修饰产物重新始水解。最为重要的是,修饰产物对ABTS+·的清除率在反应时间为3~7h得到显著提高(显著高于大豆蛋白水解物或大豆蛋白),并且在反应时间为6h的情况下,清除率达到最大(图3)。

图 3 大豆蛋白水解物类蛋白反应修饰产物的游离氨基减少量与ABTS+·清除率Fig. 3 Effect of plastein reaction time on the reduction of free amino groups and ABTS+ radical scavenging rate of modified SPI hydrolysates
2.3.2 大豆蛋白水解物类蛋白反应修饰产物的其他抗氧化活性
根据修饰产物的游离氨基减少量的高低不同,选取游离氨基减少量分别处于低、中、高水平(反应时间 1、3、6h)的 3个修饰产物进一步评价它们的其他抗氧化活性,进一步揭示类蛋白反应修饰对大豆蛋白水解物抗氧化活性的影响,结果见表2。
整体上看,大豆蛋白水解物、修饰产物的抗氧化活性远远好于大豆蛋白。在对·OH清除率上,类蛋白反应修饰显著地提高了大豆蛋白水解物的修饰产物的抗氧化活性;但是,在对还原力、DPPH自由基清除率和O2-·三个方面,修饰反应带来的影响作用不显著。此外,不同反应程度的修饰产物之间的抗氧化活性差别不是十分大。不过,总体上看类蛋白反应确实能够提高大豆蛋白水解物的抗氧化活性。所以,大豆蛋白水解物的Alcalase 2.4L FG蛋白酶水解、耦合类蛋白反应修饰,可以应用于制备高活性大豆蛋白抗氧化肽。
3 结 论
3.1 用 Alcalase 2.4L FG蛋白酶对大豆蛋白水解,根据不同水解度的水解物对ABTS+·的清除率,确定抗氧化性较好的水解物制备条件为:温度50℃、pH8.0、酶添加量1000U/g pro和水解反应6h。所得到的大豆蛋白水解物的水解度为14.0%,对ABTS+·的清除率为43.6%。
3.2 应用响应面设计方法,以反应体系游离氨基减少量为响应值,固定反应时间6h,对大豆蛋白水解物的类蛋白修饰反应条件进行优化,以修饰产物的游离氨基减少量为指标,结果得到:酶添加量1037U/g pro、底物质量浓度30g/100mL、温度20℃;此条件下游离氨基减少量的理论值为177μmol/g,与实际值(171μmol/g)接近。在优化条件下反应6h,所得到的修饰产物的反应程度最大且ABTS+·清除率也最高。
3.3 采用DPPH自由基清除率、还原力、·OH清除率和O2-·清除率4个评价指标,对反应程度不同的3个反应程度不同的大豆蛋白水解物类蛋白反应修饰产物进行评价,发现大豆蛋白水解物和修饰产物的抗氧化性活性远远好于大豆蛋白;修饰产物的DPPH自由基清除率和还原力与水解物没有差异,而修饰产物的·OH清除率和O2-·清除率显著高于水解物,显示类蛋白反应修饰可以在一定程度上提高大豆蛋白水解物的抗氧化活性。
[1]KEHRER J P. Free radicals as mediators of tissue injury and disease[J]. Critical Reviewsin Toxicology, 1993, 23(1): 21-48.
[2]BAYDAR N G,ZKAN G, YASAR S. Evaluation of the antiradical and antioxidant potential of grape extracts[J]. Food Control, 2007, 18 (9): 1131-1136.
[3]RAJAPAKSE N, MENDIS E, JUNG W K, et al. Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J]. FoodResearch International, 2005, 38(2): 175-182.
[4]PIHLANTO-LEPPLA. Bioactive peptides derived from bovine whey proteins: opioid and ace-inhibitory peptides[J]. Trends in Food Science and Technology, 2000, 11(9/10): 347-356.
[5]JUNG W K, RAJAPAKSE N, KIM S K. Antioxidative activity of low molecular peptide derived from the sauce of fermented blue mussel,Mytilus edulis[J]. European Food Research and Technology, 2005, 220 (5/6): 535-539.
[6]KIM S K, KIM Y T, BYUN H G, et al. Purification and characterization of antioxidative peptides from bovine skin[J]. Journal of Biochemistry and Molecular Biolog, 2001, 34(3): 214-219.
[7]YAMASHITA M, ARAI S, TSAI S J, et al. Plastein reaction as a method for enhancing the sulfur-containing amino acid level of soybean protein[J]. Journal of Agricultural and Food Chemistry, 1971, 19(6): 1151-1154.
[8]STEVENSON D E, MORGAN K R, FENTON G A, et al. Use of NMR and mass spectrometry to detect and quantify protease- catalyzed peptide bond formation in complex mixtures[J]. Enzyme and Microbial Technology, 1999, 25(3/5): 357-363.
[9]吴丹, 李铁晶, 赵新淮. 酪蛋白水解物的酶法修饰优化与抗氧化活性改善[J]. 农业机械学报, 2010, 41(1): 139-145.
[10]WANG Xiaosheng, TANG Chuanhe, LI Biansheng, et al. Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J]. Food Hydrocolloids, 2008, 22(4): 560-567.
[11]李亚云, 赵新淮. 酪蛋白水解物的酶法修饰与ACE抑制活性变化[J].食品与发酵工业, 2009, 35(5): 35-39.
[12]GB/T 5009.5—2003 食品中蛋白质的测定[S].
[13]SB/T 10317—1999 蛋白酶活力测定[S].
[14]MEDINA-HERNANDEZ M J, DOMINGO E B, VILLANUEVACAMAAS R M, et al. Evaluation of the proteolysis degree with theO-phthalaldehyde/N-acetyl-L-cysteine reagent[J]. Fresenius,Journal of Analytical Chemistry, 1990, 338(1): 62-65.
[15]SPELLMAN D, MCEVOY E, O,CUINN G, et al. Proteinase and exopeptidase hydrolysis of whey protein: comparison of the TNBS, OPA and pH stat methods for quantification of degree of hydrolysis[J]. International Dairy Journal, 2003, 13(6): 447-453.
[16]赵新淮, 冯志彪. 蛋白质水解物水解度的测定[J]. 食品科学, 1994, 15(11): 65-67.
[17]NSIMBA R Y, KIKUZAKI H, KONISHI Y. Antioxidant activity of various extracts and fractions ofChenopodium quinoaandAmaranthusspp. seeds[J]. Food Chemistry, 2008, 106(2): 760-766.
[18]PIHLANTO A, AKKANEN S, KORHONEN H J. ACE-inhibitory and antioxidant properties of potato(Solanum tuberosum)[J]. Food Chemistry, 2008, 109(1): 104-112.
[19]YILDIRIM A, MAVI A, KARA A A. Determination of antioxidant and antimicrobial activities ofRumex crispusL. extracts[J]. Journal of Agricultural and Food Chemistry, 2001, 49(8): 4083-4089.
[20]LI Yanhong, JIANG Bo, ZHANG Tao, et al. Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate(CPH)[J]. Food Chemistry, 2008, 106(2): 444-450.
[21]TANG Xueyan, HE Zhiyong, DAI Yanfeng, et al. Peptide fractionation and free radical scavenging activity of zein hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2010, 58(1): 587-593.
Effects of Enzymatic Hydrolysis and Subsequent Plastein Reaction on Antioxidant Properties of Soybean Protein Isolate
SONG Jia-tian,ZHAO Xin-huai*
(Key Laboratory of Dairy Science, Ministry of Education, Northeast Agricultural University, Harbin 150030, China)
Alcalase 2.4L FG was used to hydrolyze soybean protein isolate (SPI) to prepare soybean protein hydrolysates with the highest antioxidant activity, which showed a degree of hydrolysis of 14.0% and an ABTS+radical scavenging rate of 43.6%. The prepared hydrolysates were modified with Alcalase 2.4L FG by plastein reaction and the optimal enzyme dosage, substrate concentration and temperature to maximize the reduction of free amino groups were determined by response surface methodology to be 1037 U/g protein, 30 g/100 mL, and 20 ℃, respectively. The maximum degree of reaction and antioxidant activity were obtained after reaction for 6 h under these conditions. Moreover, the antioxidant activity of the SPI hydrolysates and their modification products obtained after reaction for 1, 3 h and 6 h was better than that of SPI. The DPPH and superoxide anion radical scavenging activity and reducing power of the hydrolysates and modification products showed no significant difference, while a significant difference was observed in their hydroxyl radical scavenging activity.
soybean protein hydrolysates;plastein reaction;antioxidant activity;response surface analysis
Q814.9
A
1002-6630(2012)01-0115-05
2011-03-15
国家自然科学基金项目(30972132);黑龙江省高等学校科技创新团队建设计划项目(2010td11)
宋佳天(1985—),女,硕士研究生,主要从事食品科学研究。E-mail:sjiatian@gmail.com
*通信作者:赵新淮(1963—),男,教授,博士,主要从事食品化学研究。E-mail:zhaoxh@mail.neau.edu.cn
