黄海胆棘壳色素理化性质和稳定性的研究
2012-10-27王晓东周大勇朱蓓薇吕艳红
王晓东,周大勇,*,朱蓓薇,吕艳红
(1.大连工业大学食品学院,辽宁 大连 116034;2.海洋食品教育部工程研究中心,辽宁 大连 116034;3.辽宁省海洋食品科学与技术重点实验室,辽宁 大连 116034)
黄海胆棘壳色素理化性质和稳定性的研究
王晓东1,2,3,周大勇1,2,3,*,朱蓓薇1,2,3,吕艳红1
(1.大连工业大学食品学院,辽宁 大连 116034;2.海洋食品教育部工程研究中心,辽宁 大连 116034;3.辽宁省海洋食品科学与技术重点实验室,辽宁 大连 116034)
对黄海胆棘壳色素理化性质及稳定性进行研究。结果表明:黄海胆棘壳色素在水、甲醇等极性溶剂中溶解性较好,在石油醚、正己烷等非极性溶剂中溶解性较差;在酸性环境中显橘黄色,在碱性环境中显土黄色;耐热性较好,但耐光性较差;Na2SO3和山梨酸钾既可引起色素颜色改变,又可降低色素稳定性;H2O2和NaCl不改变色素颜色,但可降低色素稳定性;高质量浓度蔗糖可增强色素稳定性;VC对色素起到护色增色作用。
黄海胆;色素;理化性质;稳定性
海胆棘壳是海胆加工中的副产物。研究表明,海胆棘壳中含有多种多羟基萘醌类色素(polyhydroxylated 1,4-naphthoquinone,PHNQ)[1-2]。PHNQ呈现出从橘黄到深红的一系列颜色,具有抗菌[3]、保护心脏[4]和抗氧化[5]等诸多功效。近年来,由于合成色素的安全性受到挑战[6],天然色素越来越受到人们的关注[7]。以海胆棘壳为原料开发天然色素,既避免了资源的浪费,又提高了海胆加工业的附加值,具有很好的开发利用前景。黄海胆(Glyptocidaris crenularis)又名海刺猬,是大连地区主产的3种经济海胆之一[8]。本实验以黄海胆棘壳色素为研究对象,对该色素的理化性质和稳定性进行研究,旨在为该色素的进一步开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
黄海胆(Glyptocidaris crenularis)于2009年7月采自大连黄海周边海域。新鲜黄海胆破壳后取出海胆黄、脏器,剩余棘壳部分用水洗干净,于40℃烘箱内烘干,粉碎后备用。
其他所用试剂均为分析纯级,用水为去离子水。
1.2 仪器与设备
紫外-可见全波长扫描仪 美国珀金埃尔默公司;酶标定量检测仪 瑞士Tcean公司;AB204-N电子分析天平 瑞士梅特勒-托利多有限公司;PHS-3C精密pH计 上海雷磁仪器厂。
1.3 方法
1.3.1 黄海胆棘壳色素的提取
取经干燥粉碎后的黄海胆棘壳粉末,用酸性乙醇溶液溶解,离心过滤后得深红色澄清提取液,减压浓缩得无乙醇味的浓缩液,经水适当稀释后,离心过滤后用NKA-9大孔吸附树脂进行吸附,再用乙醇洗脱,洗脱液浓缩冻干得色素粉末,低温避光保存[9-10]。
1.3.2 黄海胆棘壳色素的溶解性
取去离子水、甲醇、无水乙醇、丙酮、正丁醇、乙酸乙酯、无水乙醚、氯仿、石油醚、正己烷各5mL,分别于室温(15℃)溶解固体色素样品至过饱和,离心取上清液观察溶解状况。
1.3.3 黄海胆棘壳色素母液的配制
室温条件下精确称取1.0g黄海胆棘壳色素,用去离子水溶解并定容至250mL,离心取上清液作为母液并避光保存。
1.3.4 黄海胆棘壳色素的紫外-可见光谱特征
室温条件下将色素母液用去离子水稀释至原质量浓度的1/4,取适量用紫外-可见全波长扫描仪在波长200~600nm范围内进行扫描(去离子水做空白样)。
1.3.5 pH值对黄海胆棘壳色素颜色的影响
室温条件下分别配制pH值为2.2、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、10.6的缓冲溶液各50mL,然后按色素母液与缓冲溶液体积比为1:9的比例配10mL溶液于塑料具塞试管中,充分摇匀,观察色素颜色有无变化。
1.3.6 光照对黄海胆棘壳色素稳定性的影响
室温条件下将色素母液用去离子水稀释至原质量浓度的1/4,各取10mL于两支玻璃具塞试管中,分别在自然光和暗处放置2周。定期用酶标定量检测仪测定其在475nm波长处的吸光度,计算保存率。

式中:A为某时刻特征吸收波长处的色素溶液吸光度;A0为色素溶液在特征吸收波长处的初始吸光度。1.3.7 温度对黄海胆棘壳色素稳定性的影响
室温条件下将色素母液用去离子水稀释至原质量浓度的1/4,各取10mL于4支塑料具塞试管中,分别置于20、40、60、80℃的恒温水浴锅中保温(避光),每隔一定时间取出冷却,用酶标定量检测仪测定其在475nm波长处的吸光度,计算保存率。
1.3.8 H2O2和Na2SO3对黄海胆棘壳色素稳定性的影响
室温条件下分别配制不同质量分数的H2O2溶液和不同质量浓度的Na2SO3溶液。然后按色素母液与缓冲溶液体积比为1:9的比例配10mL溶液于塑料具塞试管中,充分混匀,避光放置,定期用酶标定量检测仪测定其在475nm波长处的吸光度,计算保存率。
1.3.9 部分食品添加剂对黄海胆棘壳色素稳定性的影响
室温下分别配制不同质量浓度的NaCl、蔗糖、山梨酸钾、VC溶液,然后按色素母液与缓冲溶液体积比为1:9的比例配10mL溶液于塑料具塞试管中,充分混匀,避光放置,定期用酶标定量检测仪测定其在475nm波长处的吸光度,计算保存率。
1.3.10 数据统计分析方法
数据的统计分析借助SPSS 15.0 分析软件(SPSS Inc. Chicago,IL,USA)实现。组间差异性检验采用单因素方差分析中的LSD法完成。
2 结果与分析
2.1 黄海胆棘壳色素的溶解性
冻干后的黄海胆棘壳色素为暗红色的固体粉末。15℃条件下色素的去离子水饱和溶液呈黑红色,甲醇、无水乙醇饱和溶液呈深红色,丙酮、正丁醇、乙酸乙酯、乙醚、氯仿的饱和溶液较浅,呈橘黄色,而石油醚、正己烷的饱和溶液基本无色。色素在极性大的溶剂中溶解性较好,这是因为黄海胆棘壳色素的主要成分是一些多羟基1,4-萘醌类物质,极性较大,所以易溶于水等极性较强的溶剂。
2.2 黄海胆棘壳色素的紫外-可见吸收光谱
低质量浓度的黄海胆棘壳色素水溶液呈现橘黄色。如图1所示,黄海胆棘壳色素的水溶液分别在波长272、325、475nm附近出现3个吸收峰,符合PHNQ类化合物的典型光谱吸收特征:有3~4个明显的吸收峰,其中可见区波长处最大的吸收峰多出现在450~550nm处[2]。本实验制备的是粗色素,可能含有蛋白质等的非色素物质。非色素物质的吸收波长多集中在紫外区,为了排除其对测定结果的干扰,选取可见光区的最大吸收波长475nm为黄海胆棘壳色素的检测波长,用于对色素稳定性的分析。

图1 黄海胆棘壳色素的紫外-可见吸收光谱Fig.1 UV-Vis absorption spectrum of sea urchin pigments
2.3 pH值对黄海胆棘壳色素颜色的影响
实验现象显示,黄海胆棘壳色素水溶液的颜色会随着溶液pH值的不同而发生变化。色素水溶液颜色在pH<6时变化不明显,呈橘黄色,pH7~9 时呈土黄色,pH10时呈深土黄色,pH10.6时呈暗黄色,其中在pH8~10时溶液中立即产生絮状物。文献表明,PHNQ在高pH值下会失去不同数目的羟基氢离子而以阴离子的形式存在[11],这可能是色素随pH值变化而变色的原因。产生絮状物的原因可能是色素中含有的非色素物质在碱性条件下不溶造成的。另外当pH<10.0时,某些PHNQ在有氧情况下稳定性很差,会导致氧化速率加快[11]。因此不论从利用色素橘黄色色调的角度讲,还是从稳定性的角度讲,黄海胆棘壳色素适宜在偏酸性环境中应用。2.4 光照对黄海胆棘壳色素稳定性的影响
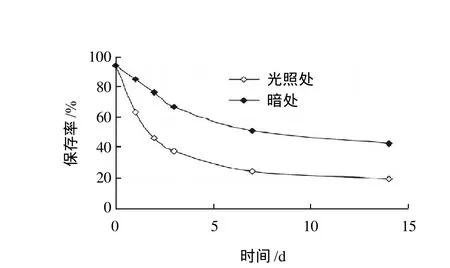
图2 光照对黄海胆棘壳色素稳定性的影响Fig.2 Effect of light on stability of sea urchin pigments
随保存时间延长,色素在光照处和暗处的保存率都呈下降趋势,外观颜色变浅,同时还伴随有一些褐色絮状物的产生,但在光照处变化的更为明显。由图2可知,同样放置14d后,暗处的色素溶液保存率下降至46.07%,而光照处的色素溶液保存率下降至21.83%。
Lebedev等[12]在研究中发现,以海胆色素A(2,3,5,7, 8-五羟基-1,4-萘醌)为代表的PHNQ存在着原理为自由基反应的自氧化现象,生成含4个羰基的终产物。终产物因失去羟基而极性下降,水溶性也相应降低,这可能是色素水溶液在保存过程中颜色变浅并出现絮状物的原因。而在光的辐射作用下,水会产生水合电子、氢原子、过氧化氢等物质,在有氧条件下,水合电子会转化为超氧阴离子,氢原子会转化为过氧化氢自由基(HO2·),再部分转化为超氧阴离子自由基[13],从而加速了色素的氧化进程,所以黄海胆棘壳色素在保藏和使用时要尽量避免长时间的与光直接接触。
2.5 温度对黄海胆棘壳色素稳定性的影响
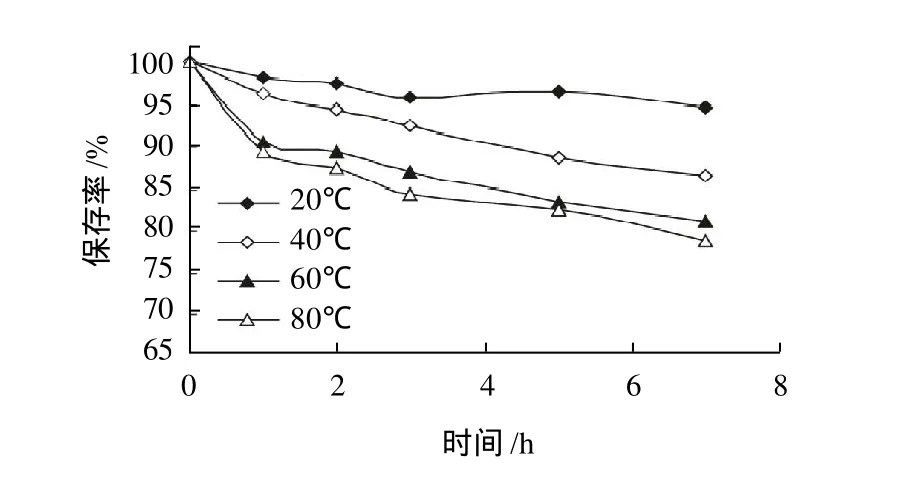
图3 温度对黄海胆棘壳色素稳定性的影响Fig.3 Effect of temperature on stability of sea urchin pigments
由图3可知,保存温度越高,黄海胆棘壳色素的稳定性越差。保温7h后,20、40、60、80℃条件下色素的保存率分别为94.59%、86.75%、81.29%和79.02%,且80℃条件下试管底部明显地出现了絮状物。出现上述结果的原因可能是高温加快了多羟基萘醌类物质的自氧化速率,也可能是萘醌类物质在高温中发生了热降解。2.6 H2O2和Na2SO3对黄海胆棘壳色素稳定性的影响

图4 H2O2对黄海胆棘壳色素稳定性的影响Fig.4 Effect of H2O2 on stability of sea urchin pigments
由图4可知,低质量分数H2O2对黄海胆棘壳色素稳定性的影响不大,但随着H2O2质量分数增加,色素的稳定性下降明显,并有少量沉淀生成。不包括对照在内,色素在质量分数由低到高的H2O2溶液中保存7h后,保存率分别是94.68%、89.07%、88.96%和82.19%。H2O2是一种强氧化剂,可分解出羟自由基[15],加速棘壳色素的氧化进程。因此,黄海胆棘壳色素在保藏及使用时要尽量避免与高浓度的氧化物质相接触。
Na2SO3的加入使黄海胆棘壳色素溶液的颜色由橘黄色变为土黄色。表1的保存率数据显示,Na2SO3的加入还会显著降低色素的稳定性。Na2SO3是强碱弱酸盐,溶液显碱性,棘壳色素在碱性溶液中会发生颜色改变和稳定性降低。因此,黄海胆棘壳色素使用时不能与Na2SO3同时添加。
表1 Na2SO3对黄海胆棘壳色素稳定性的影响(±s,n=3) Table 1 Effect of Na2SO3 on stability of sea urchin pigments (±s,n=3)

表1 Na2SO3对黄海胆棘壳色素稳定性的影响(±s,n=3) Table 1 Effect of Na2SO3 on stability of sea urchin pigments (±s,n=3)
注:同行小写字母不同,表示差异显著(P<0.05);同列大写字母不同,表示差异显著(P<0.05)。下同。
保存率/%时间/h Na2SO3质量浓度/(g/L) 0 0.045 0.9 1.35 1.8 1 99.42±0.25aAB98.95±0.84aA 100.34±2.61aA100.23±0.76aA100.49±0.62aA 2 99.87±0.61aA 98.93±0.56aA 98.37±2.23aAB99.11±1.45aA99.37±1.33aA 3 98.65±1.15aAB96.59±1.39abB95.90±0.71bBC95.25±1.34bB95.22±1.50bB 5 97.45±1.37aBC94.95±0.21abB93.58±0.54bCD 94.07±1.98bB90.08±2.62cC 7 95.88±2.24aC 92.50±2.21bC 91.31±0.46bcD 89.09±1.82cC89.54±1.14cC
2.7 食品添加剂对黄海胆棘壳色素稳定性的影响
加入山梨酸钾使黄海胆棘壳色素溶液的橘黄色变暗,且由表2可知,添加山梨酸钾的色素溶液稳定性降低。原因同样可能是显碱性的山梨酸钾溶液使多羟基萘醌类色素的自氧化程度加重,所以该色素不能与山梨酸钾混合使用。
NaCl和蔗糖的加入不会对黄海胆棘壳色素的颜色造成影响。但随着添加物质量浓度的增加,NaCl会降低色素的稳定性(表3);高质量浓度蔗糖则略增加色素的稳定性(表4),其原因可能是高质量浓度糖液中,水分活度降低,溶解氧减少,从而减慢了黄海胆棘壳色素的自氧化速度[16]。
由表5可知,当VC的质量浓度大于0.045g/L时,可明显起到护色增色作用。VC是一种抗氧化剂,可阻止色素的氧化进程,起到护色作用。发色团如羰基等使物质具有颜色,助色团如羟基等会增大发色团的发色能力,若一个化合物的分子中含有数个发色团和助色团,而且发色团之间或是发色团和助色团之间形成共轭体系时,化合物的颜色就会加深[17]。多羟基萘醌类色素的分子中同时含有发色团和助色团,色素溶液颜色加深可能是VC的存在阻止了羟基被氧化而使共轭作用发生所致,所以黄海胆棘壳色素在使用当中可以选择VC作为它的护色增色剂。
表2 山梨酸钾对黄海胆棘壳色素稳定性的影响(±s,n=3)Table 2 Effect of potassium sorbate on stability of sea urchin pigments (±s,n=3)

表2 山梨酸钾对黄海胆棘壳色素稳定性的影响(±s,n=3)Table 2 Effect of potassium sorbate on stability of sea urchin pigments (±s,n=3)
保存率/%时间/d 山梨酸钾质量浓度/(g/L) 0 0.18 0.45 0.9 1.35 1.8 1 97.97±0.95aA 96.28±1.42abA 94.13±1.85bA 94.63±1.24bA 94.39±2.86bA 90.78±2.00cA 2 98.34±3.01aA 87.96±2.66bB 74.01±0.55cB 74.08±3.50cB 68.45±1.45dB 70.16±1.93cdB 3 95.88±3.43aA 74.23±2.99bC 60.42±1.76cC 54.27±0.74dC 49.12±1.92eC 47.20±1.27eC 7 81.53±1.72aB 46.70±1.08bD 35.68±0.16cD 37.57±1.65cD 36.92±1.58cD 35.08±1.99cD 14 65.82±2.11aC 35.90±1.74bE 35.86±1.58bD 39.41±2.18bD 36.32±1.41bD 34.26±1.31bD
表3 NaCl对黄海胆棘壳色素稳定性的影响(±s,n=3)Table 3 Effect of NaCl on stability of sea urchin pigments(±s,n=3)

表3 NaCl对黄海胆棘壳色素稳定性的影响(±s,n=3)Table 3 Effect of NaCl on stability of sea urchin pigments(±s,n=3)
保存率/%时间/d NaCl质量浓度/(g/100mL) 0 0.9 1.8 4.5 9.0 13.5 1 99.93±2.37aA 97.26±2.01bA 97.86±0.95abA 96.29±0.64bcA 96.94±0.29bcA 94.63±1.30cA 2 97.03±4.18aAB 92.34±1.74bB 92.78±1.30bB 90.28±0.38bB 90.47±1.92bB 85.23±1.15cB 3 93.06±1.07aB 86.11±1.26bC 84.61±1.94bC 85.04±2.07bC 75.43±2.00cC 71.33±1.62dC 7 74.68±1.63aC 69.06±1.57bD 64.90±2.00cD 59.23±1.50dD 54.74±2.00eD 48.89±1.81fD 14 56.50±2.08aD 52.55±2.23bE 46.63±1.98cE 44.44±2.07cdE 41.33±0.88dE 37.66±1.37eE
表4 蔗糖对黄海胆棘壳色素稳定性的影响(±s,n=3)Table 4 Effect of cane sugar on stability of sea urchin pigments(±s,n=3)

表4 蔗糖对黄海胆棘壳色素稳定性的影响(±s,n=3)Table 4 Effect of cane sugar on stability of sea urchin pigments(±s,n=3)
保存率/%时间/d 蔗糖质量浓度/(g/100mL) 0 0.9 4.5 9.0 18.0 27.0 1 94.43±0.56bA 98.45±2.48aA 97.52±2.32abA 98.92±2.13aA 98.33±1.11aA 98.03±2.13aA 2 87.53±2.66bB 92.39±2.96aA 93.24±1.63aB 93.07±2.14aB 93.85±2.70aB 94.19±2.57aB 3 88.68±2.67aB 86.12±4.90aB 85.55±1.06aC 88.51±1.74aC 87.81±1.90aC 87.38±1.54aC 7 78.90±2.35aC 74.28±4.44bC 74.61±1.67abD 76.56±1.68abD 77.58±1.61abD 77.93±1.36abD 14 57.75±0.76bcD 54.28±0.47dD 55.75±1.44cdE 60.14±1.64abE 61.58±2.31aE 60.08±1.59abE

表5 VC对黄海胆棘壳色素稳定性的影响Table 5 Effect of VC on stability of sea urchin pigments
3 结 论
黄海胆棘壳色素在极性大的溶剂如去离子水、甲醇、乙醇中溶解性较好,在极性小的溶剂如石油醚、正己烷中溶解性差。色素在pH≥7的缓冲溶液中颜色会随pH值变化而发生变化。色素的耐热性较好,但耐光性较差。Na2SO3和山梨酸钾会改变色素的颜色并使色素稳定性下降;H2O2、NaCl和蔗糖不会对色素颜色构成不良影响,但前两者会使色素稳定性下降。VC对色素有护色增色作用。
[1]MOORE R E, SINOH H, SCHEUER P J. Isolation of eleven new spinochromes from echinoids of the genus echinothrix[J]. J Org Chem, 1966, 31(11): 3645-3650.
[2]ANDERSON H A, MATHIESON J W, THOMSON R H. Distribution of apinochrome pigment in echinoids[J]. Comp Biochem Phys, 1969, 28(1): 333-345.
[3]SERVICE M, WARDLAW A C. Echinochrome A as a bactericidal substance in the coelomic fluid ofEchinus esculentus(L.)[J]. Comp Biochem Phys, 1984, 79(2): 161-165.
[4]ANUFRIEV V P, NOVIKOV V L, MAXIMOV O B, et al. Synthesis of some hydroxynaphthazarins and their cardioprotective effects under ischemiareperfusionin vivo[J]. Bioorg Med Chem Lett, 1998, 8(6): 587-592.
[5]MISHCHENKO N P, FEDOREEV S A, BAGIROVA V L. Histochrome: a new original domestic drug[J]. Pharm Chem J, 2003, 37(1): 48-52.
[6]丁成翔, 代汉慧, 陈冬东. 六种着色剂毒性研究进展[J]. 检验检疫学刊, 2009, 19(2): 70-73.
[7]王薇. 食用天然色素的营养保健作用[J]. 中国食物与营养, 2005(1): 45-47.
[8]童圣英, 陈炜, 由学策, 等. 三种海胆性腺总脂的脂肪酸组成的研究[J]. 水产学报, 1998, 22(3): 247-252.
[9]秦磊. 大连紫海胆的综合加工利用研究[D]. 大连: 大连工业大学, 2010.
[10]ZHOU Dayong, QIN Lei, ZHU Beiwei, et al. Extraction and antioxidant property of polyhydroxylated naphthoquinone pigments from spines of purple sea urchinStrongylocentrotus nudus[J]. Food Chem, 2011, 129 (4): 1591-1597.
[11]LEBEDEV A V, IVANOVA M V, RUUGE E K. How do calcium ions induce free radical oxidation of hydroxy-1,4-naphthoquinone? Ca2+stabilizes the naphthosemiquinone anion-radical of echinochrome A[J]. Arch Biochem Biophys, 2003, 413(2): 191-198.
[12]LEBEDEV A V, LEVITSKAYA E L, TIKHONOVA E V, et al. Antioxidant properties, autooxidation, and mutagenic activity of echinochrome: a compared with its etherified derivative[J]. Biochemistry (Moscow), 2001, 66(8): 885-893.
[13]连喜军. 红曲色素光稳定性研究[D]. 天津: 天津科技大学, 2004.
[14]董文艺, 杜红. 过氧化氢氧化法的原理及对有机物的去除[J]. 中国农村水利水电, 2004(2): 47-48.
[15]阚建全. 食品化学[M]. 北京: 中国农业大学出版社, 2002: 294-295.
[16]吴谋成. 仪器分析[M]. 北京: 科学出版社, 2003: 21-24.
Physico-chemical Properties and Stability of Pigments from Spine and Shell of Sea UrchinGlyptocidaris crenularis
WANG Xiao-dong1,2,3,ZHOU Da-yong1,2,3,*,ZHU Bei-wei1,2,3,LYan-hong1
(1. School of Food Science and Technology, Dalian Polytechnic University, Dalian 116034, China;
2. Engineering Research Center of Seafood of Ministry of Education, Dalian 116034, China;
3. Liaoning Province Key Laboratory of Seafood Science and Technology, Dalian 116034, China)
The present study aimed to characterize physicochemical properties and stability of pigments extracted from the spine and shell of sea urchin (Glyptocidaris crenularis). Our results showed that the pigments had relatively high solubility in polar solvents such as water and methanol but had relatively low solubility in non-polar solvents such as light petroleum and hexane. The pigments showed orange color in acidic conditions but yellowish brown color in basic conditions. The pigments were relatively stable to heat but unstable to light. Na2SO3 and potassium sorbate could not only cause changes in the color but also decrease the stability of the pigments. H2O2 and NaCl could not cause any changes in the color but decrease the stability of the pigments. High concentrations of cane sugar could enhance the stability of the pigments. Vitamin C could protect and enhance the color of the pigments.
Glyptocidaris crenularis;pigment;physico-chemical properties;stability
TS254.9
A
1002-6630(2012)01-0044-05
2011-01-07
“十一五”国家科技支撑计划项目(2008BAD94B07);辽宁省博士科研启动基金项目(20091002)
王晓东(1985—),男,硕士研究生,研究方向为水产品加工理论与技术。E-mail:wangcy451@163.com
*通信作者:周大勇(1977—),男,讲师,博士,研究方向为水产品加工理论与技术。E-mail:zdyzf1@163.com
