鲐鱼中产组胺菌的分离筛选与生物学特性初步研究
2012-10-26吴祖芳周秀锦翁佩芳李微微
杨 健,吴祖芳,*,周秀锦,翁佩芳,李微微
(1.应用海洋生物技术教育部重点实验室,宁波大学生命科学与生物工程学院,浙江宁波315211;2.舟山出入境检验检疫局,浙江舟山 316100)
鲐鱼中产组胺菌的分离筛选与生物学特性初步研究
杨 健1,吴祖芳1,*,周秀锦2,翁佩芳1,李微微1
(1.应用海洋生物技术教育部重点实验室,宁波大学生命科学与生物工程学院,浙江宁波315211;2.舟山出入境检验检疫局,浙江舟山 316100)
利用产组胺菌鉴别培养基,对鲐鱼内脏中产组胺菌进行初步筛选,结合高效液相色谱分析方法对分离菌株的产组胺能力进行了确认;并通过菌株的生理生化、形态和16S rDNA基因序列分析对分离得到的菌株进行鉴定;研究了温度和pH对菌株生长和产组胺的影响。结果表明,从鲐鱼中初步分离的4株菌(T4、T5、T6和T9)在组胺发酵培养基中能够产生164.1~466.1μg/100mL组胺;经生理生化特性及16S rDNA序列测定为相同菌种,对其中T4菌株进行进化树分析,发现菌株T4与产粘液变形杆菌相似性最高。T4菌株生长和产组胺的最适温度均为20℃,最适pH均为7。
鲐鱼,产组胺菌,生理生化特性,16S rDNA序列分析
鲐鱼(Pneumatophorus japonicus),鲈形目,鲭科,鲐属,属中上层鱼类,分布广泛,是我国重要的经济鱼类之一;其体内含有丰富的蛋白质,氨基酸含量很高,尤其是组氨酸,而组氨酸极易被一些酶类(组氨酸脱羧酶)分解而产生组胺(超过一定含量能够使人体产生过敏反应),因此由于食用含有高含量组胺的鱼类而产生的中毒事件常有报道[1-3],组胺也是出口水产食品重要的控制指标之一。关于组胺的产生机制目前存在两种观点,一是由于中上层鱼体内含有丰富的组氨酸,在贮藏或加工过程中,合适的条件会令鱼体内酶系打破之前的平衡状态,发生自溶现象而产生组胺;另一观点是体内的组氨酸在微生物作用下发生分解而产生组胺。据文献报道,大部分的产组胺菌属肠道菌如肠杆菌科等[4-6]。本研究利用鉴别培养基并结合高效液相色谱法,对由鲐鱼内脏分离出的产组胺菌进行形态特征、生理生化特性以及16S rDNA序列分析和菌种鉴定,并研究了温度和pH环境因素对菌株生长和产组胺能力的影响,研究结果可为控制冷冻水产品中组胺含量提供重要依据。
1 材料与方法
1.1 材料与设备
新鲜鲐鱼 2011年4月16日购自于浙江省宁波市江北区庄市菜市场,无菌袋包装、冰袋冷藏,于0.5h内运到实验室,-18℃保藏,以备实验用;组胺标准品
Sigma公司;丹磺酰氯 ACROS公司;L-组氨酸、1,7-二氨基庚烷 阿拉丁试剂公司;琼脂糖凝胶回收试剂盒 上海捷瑞生物工程有限公司;DNA聚合酶、质粒载体pMD18-T vector 大连宝生物公司;乙腈、甲醇 迪马公司;色谱分析试剂 色谱纯;其它试剂均为化学纯或分析纯;初步筛选培养基(产组胺菌鉴别培养基) 胰蛋白胨5g、酵母膏5g、L-组氨酸2g、NaCl 5g、琼脂15g、甲酚红0.2g、蒸馏水1000m L加热溶化,调pH至6.5;组胺发酵培养基 L-组氨酸10g、大豆蛋白胨17g、NaCl 3.0g、磷酸氢二钾2.5g、丙酮酸钠10.0g、葡萄糖2.5g、蒸馏水1000m L,调pH至7.0,分装试管;运动性检测培养基和产酸产气检测培养基 参照陶志华等人的运动型检测和糖分解实验所用培养基[7],以上培养基于1.01×105Pa高压下,121℃蒸汽灭菌15m in。
XSP-2CA型普通光学显微镜 上海永亨光学仪器制造有限公司;LRH-190-S型恒温恒湿培养箱 广东省医疗器械厂;LDZX-40BI型立式蒸汽灭菌锅 上海申安医疗器械厂;LC1200型液相色谱仪 美国安捷伦公司;Mastercycler pro型梯度PCR仪 德国Eppendorf公司。
1.2 实验方法
1.2.1 组胺含量的测定 发酵液预处理:取各菌株发酵液及空白对照1m L于5m L离心管,同时分别取10mg/L组胺标准使用液(用0.1mol/L盐酸配制而成)0、50、100、200、500μL(浓度10μg/m L)于5m L离心管中,依次加入100μL 2mol/L氢氧化钠(标准品不加)、20μL 100mg/L 1,7-二氨基庚烷(内标物,用0.1mol/L盐酸配制而成)标准使用液、300μL饱和碳酸氢钠、2m L丹酰氯衍生剂溶液(用色谱级丙酮配制成浓度为10mg/m L)进行衍生,振荡混匀后于60℃烘箱内放置45m in,再加入100μL氨水放置40m in,最后用乙腈定容至5m L,振荡混匀,取1m L经0.22μm微孔滤膜过滤后进样。色谱条件:流动相A:0.01mol/L乙酸铵,流动相B:乙腈与0.01mol/L乙酸铵9∶1混合;流动相A∶流动相B=2∶8,流速1.0m L/m in,紫外检测器波长254nm,进样量20μL。
1.2.2 菌悬液的制备 将初步分离菌种的斜面保藏菌种连续转接2次,接种于营养肉汤培养基。取一定量新鲜菌液离心弃上清,用组胺发酵培养基将菌体调至105cfu/m L,备用。
1.2.3 产组胺菌的初步筛选 将冷冻(-18℃以下)鲐鱼的内脏取出后,用无菌剪刀剪碎,称取10.0g置于装有90.0m L无菌生理盐水的三角瓶中,混匀。用无菌生理盐水将其依次稀释到10-1、10-2、10-3、10-4、10-5和10-6后,取0.1m L稀释液涂布到初步筛选培养基上,30℃培养48h,菌落周围出现紫色晕环的为可能产组胺的菌株,再在初筛培养基上纯化两次以上,取单菌落保存菌种。
1.2.4 待测菌株产组胺能力确认 取1m L初步分离菌株菌悬液接种于9m L组胺发酵培养基中(此时菌液浓度约为104cfu/m L),并设置空白对照组(不接种菌株),30℃下静置恒温培养48h,检测发酵液是否有组胺产生。
1.2.5 产组胺菌株16S rDNA的PCR扩增与序列分析及系统发育树的构建 以分离菌菌悬液为模板,选用细菌16S rDNA通用引物27F:5’-AGAGTTTGATCCTGGCTCAG-3’和1492R:5’-TACGGTTACCTTGTTACGACTT-3’扩增产组胺菌株16S rDNA全长。25μL反应体系:15μL H2O、2.5μL Buffer10×、1.5μLMgCl2、4μL 2.5mM dNTP、0.5μL 10μM引物27F、0.5μL 10μM引物1492R、0.2μL 5U/μL Ex Taq聚合酶、1μL菌液为模板;PCR程序:95℃预变性8min、94℃变性50s、54℃复性50s、72℃延伸90s,总计30个循环,最后在72℃延伸10m in;PCR反应物用1%(m/V)琼脂糖凝胶电泳检测;预期大小的扩增条带用Genden琼脂糖凝胶DNA回收试剂盒纯化,连接入pMD18-T Vector质粒载体,转化到大肠杆菌DH 5α,涂布在添加有氨苄的LB琼脂培养基上,37℃过夜培养,选取长势较好的菌落,挑取菌种并接种到LB培养基中,再次37℃过夜培养,利用PCR检测基因是否转录成功,若成功,从剩下菌落挑取细菌接种至LB液体培养基中37℃培养过夜,菌液送上海英潍捷基公司测序;所得序列通过NCBI数据库检索,进行序列比对,最后选取数株同源性较高的细菌,利用MEGA 4.1软件建立产组胺菌株的系统发育树。
1.2.6 温度对产组胺微生物生长和产组胺的影响 取1m L产组胺菌株的菌悬液接种至9m L组胺发酵培养基中,分成五组分别于4、20、25、30、35℃下静置培养24h,每个温度均设置空白对照;取1m L稀释到平板,测定细菌总数;另取1m L通过高效液相色谱法测定组胺含量。
1.2.7 pH对产组胺菌株生长和产组胺的影响 取1m L菌悬液接种于9m L pH分别为4、5、6、7、8的组胺发酵培养基中(每个pH均设置空白对照),30℃培养箱中静置培养24h;采用1.2.5中的方法测定发酵液中的细菌总数和组胺含量。
2 结果与分析
2.1 发酵液中产组胺含量的测定
取0、50、100、200、500μL的10μg/m L组胺标准溶液分别加入1m L发酵培养液,经1.2.1衍生处理后,通过高效液相色谱法测定,利用A09.03【1417】积分模块处理数据,结果如图1所示。
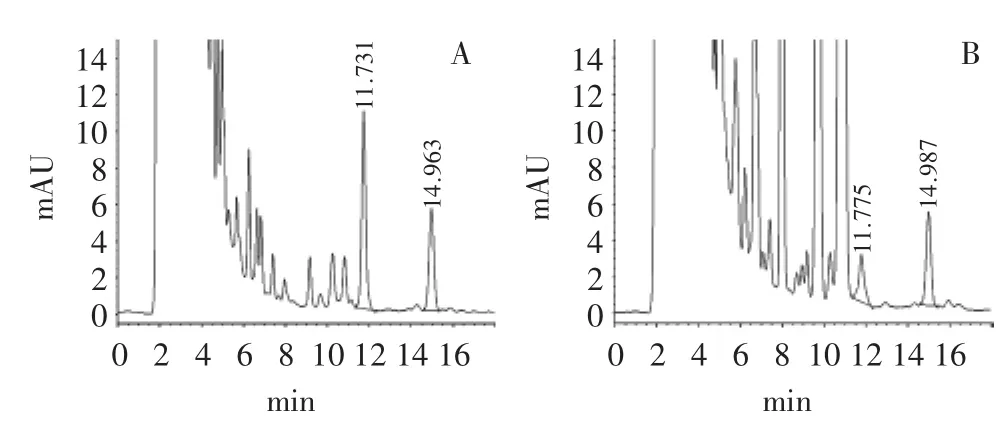
图1 组胺检测的HPLC色谱图Fig.1 Chromatogram of histamine detected by HPLC
从图1中的A和B可以看出,组胺和1,7-二氨基庚烷均能够很好的从发酵液中分离出来,组胺峰出现在11.7min左右,1,7-二氨基庚烷峰出现在14.9min左右,并且能准确测定组胺的含量。其中,图1B是T5菌株发酵液检测到组胺存在的HPLC色谱图,这表明T5菌株能够产生组胺。由于菌株T4、T6和T9发酵液HPLC色谱图中除组胺峰强大小与T5有较大区别外,其它没有明显不同,因此不再列出色谱图。另外,以空白发酵培养基为基底,进行三个水平回收率实验,每个水平进行3个平行实验,回收率见表1。
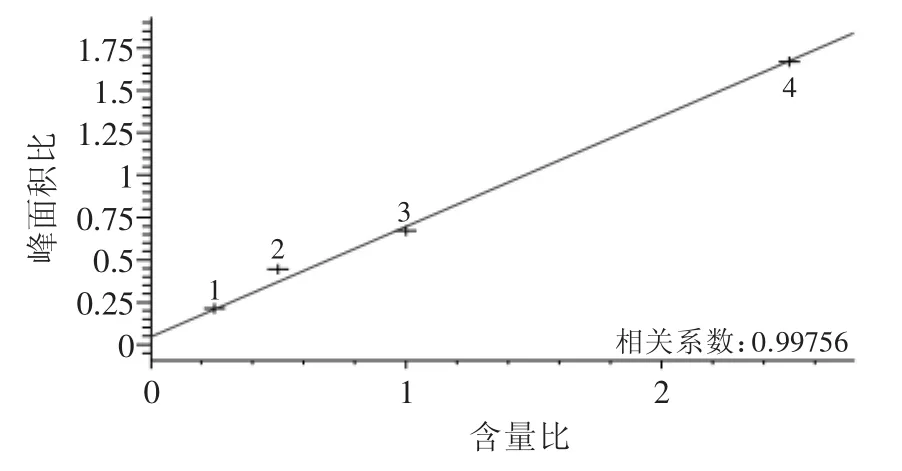
图2 组胺标准曲线Fig.2 Standard curve of histamine
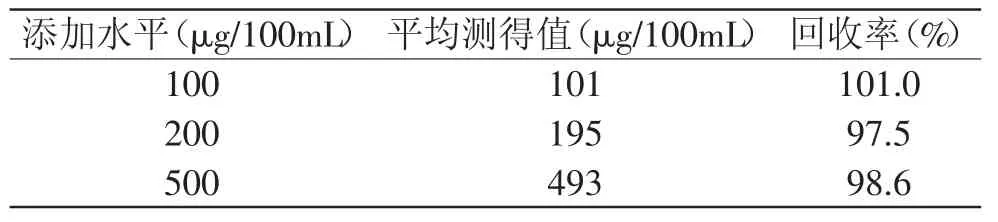
表1 组胺回收率实验结果Table 1 Test results of histamine recovery
从图2和表1可看出,本方法组胺标准曲线回归系数为0.9976,且平均回收率在99.03%,因此,能满足菌株发酵液中组胺含量的检测需要。
2.2 产组胺菌株的初步筛选与产组胺能力的测定
从鲐鱼内脏中初步筛选得到的菌株再次接种于产组胺菌鉴别培养基(产组胺菌株能使培养基变紫色)上分纯,均能使培基变成紫色。进一步通过筛选培养基,将分离筛选得到的10株菌(分别记为T1-T10),利用高效液相色谱检测发酵培养液中组胺,结果如表2。

表2 10株菌产组胺能力确认Table 2 Identification of the ability to produce histamine of ten bacteria
从表2可知,从内脏中初步分离得到的10株菌中,只有4株菌(T4、T5、T6和T9)能产组胺,经高效液相色谱检测,其产生组胺量范围在164.1~466.1μg/100m L,其余均不能产生。
2.3 产组胺微生物的生理生化鉴定
对产组胺菌株进行生化特性鉴定,共检测10项指标,实验结果如表3。
根据表3中各株菌的生理生化特征,并结合个体形态和群体形态特征,参照沈萍《微生物学实验》(第三版)和《伯杰氏细菌鉴定手册》(第九版),这4株细菌的初步鉴定结果均可能属变形杆菌属[8-9]。据报道Torres等人直接从智利鲭鱼中分离到摩根氏菌(Morganellamorganii),并研究了其产组胺条件[10]。变形杆菌属不仅存在于鲭鱼中,在其它鱼中也有发现,Rodtong等人发现将印度凤尾鱼放置于35℃下能迅速积累组胺,并从中分离到摩根氏菌(Morganella morganii),变形杆菌(Proteus vulgaris)和产气肠杆菌(Enterobacter aerogenes)三种主要的组胺微生物,在液体培养基中能产生104.1~203.0mg/100m L组胺[11]。本实验分离得到的产组胺菌株还需进一步通过分子鉴定来确认。
2.4 产组胺微生物的16S rDNA基因序列分析
4株产组胺菌株的PCR产物经琼脂糖凝胶电泳检测,扩增产物为1条大小约1500bp的特异性条带;将序列在NCBI上进行16S rDNA序列同源性比较,分析了相关序列的同源性,结果进一步证明分离得到的产生组胺的菌株属于同一种菌,选择产组胺相对较多的菌株T4,构建了分子系统发育树(图3)。

图3 16S rDNA基因序列分类聚类结果Fig.3 Themolecular phylogenetic tree of strain T4 based on 16S rDNA sequences
从图3上16S rDNA基因序列相似性和系统发育树上可以看出,T4与产粘液变形菌(Proteusmyxofaciens)聚成一支,具有最高的序列相似性,这表明T4与产粘液变形菌的亲缘关系最近。
2.5 温度对T4菌株生长和产组胺的影响
将产组胺菌株菌悬液接种至组胺发酵培养基中(此时菌浓度约为104cfu/m L),分成5组(每组至少3个平行)在4、20、25、30、35℃条件下静置培养24h(每个温度均设置空白对照),测定培养液中细菌总数和组胺含量,结果见图4。
从图4A可知,在20℃下,细菌总数达到最大,有最大生物量11.75logCFU/m L,在20~30℃温度范围内,T4菌的生长速度随着温度升高而稍有下降。4℃下,细菌总数较初始值几乎没有变化,表明4℃冷藏温度能够抑制该菌生长。
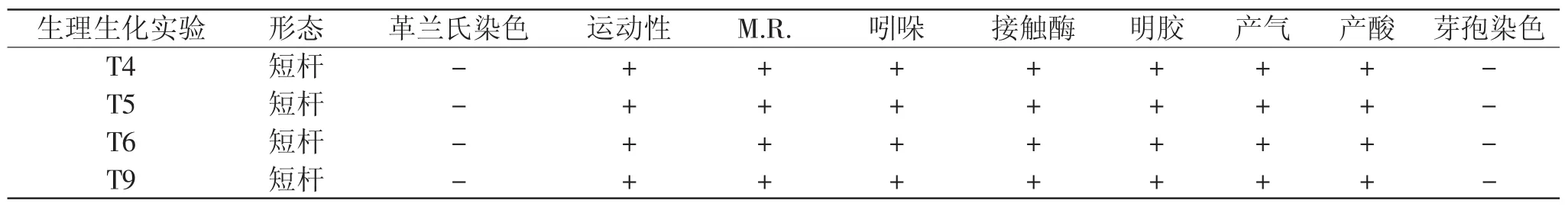
表3 4株产组胺菌生理生化特性鉴定Table 3 Identification of physiological and biochemical characteristics of four histamine-forming bacteria
从图4B可以看出,4℃下,该菌株不能产生组胺,表明该温度不仅能够抑制该菌生长,而且能够抑制其产生组胺。但在20℃时,有最大的组胺产生量491.1μg/100m L。之后,随温度上升而下降,表明温度高于20℃,对该菌产生组胺是不利的。对比图4A和图4B,可以发现,该菌的生长最适温度与产组胺最适温度相同。
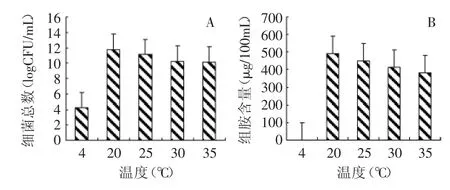
图4 温度对T4菌株生长和产组胺的影响Fig.4 Effectof the temperature on growth and histamine production of strain T4
2.6 pH对T4菌株生长和产组胺的影响
将组胺发酵培养基pH分别调至4、5、6、7和8,然后取1m L J2和J4菌悬液接种于装有9m L培养基的试管中,30℃静置培养24h(每个pH均设置空白对照),测定培养液中细菌总数和组胺含量,结果见图5A和图5B。

图5 pH对菌株T4生长和产组胺的影响Fig.5 Effectof the pH on growth and histamine production of strain T4
从图5A可以看出,T4菌株的生长最适pH为7,此时有最大生物量11.32logCFU/m L,pH低于或高于7都将会使其生长速度减慢。从图5B中可知,T4菌产组胺的最适pH也为7,此时有最大生物量465.3μg/100m L,降低或升高pH也会使生物量减少。综合图5A和图5B,同样可以看出,T4菌的生长最适pH和产组胺最适pH相同。
3 结论
利用产组胺鉴别培养基,从鲐鱼中初步筛选出的菌株中有4种菌在组胺发酵培养基中能够产生组胺,在组胺发酵培养基中产生组胺的量为164.1~466.1μg/100m L;经生理生化实验和16S rDNA初步判定为变形杆菌,属细菌,其中菌株T4与产粘液变形杆菌(Proteus myxofaciens)相似性最高,其最适生长温度为20℃,最适pH为7,此条件下分别有最大生物量11.75logCFU/m L和11.32logCFU/m L;最适产组胺温度为20℃,最适pH为7,分别有最大生物量491.1mg/100m L和465.3mg/100m L。本研究结果可为鲐鱼食品深加工及质量安全控制方法提供重要依据,也为研究鲐鱼等鱼类的加工新工艺奠定了基础。
[1]蔡利民.一起组胺食物中毒调查[J].浙江预防医学,2007,19(1):50.
[2]Chang SC,Kung H F,Chen H C,et al.Determination of histamine and bacterial isolation in swordfish fillets(Xiphias gladius)implicated in a food borne poisoning[J].Food Control,2008(19):16-21.
[3]Tsai Y H,Hsien H S,Chen H C,et al.Histamine level and species identification of billfish meats implicated in two foodborne poisonings[J].Food Chemistry,2007,104(4):1366-1371.
[4]TsaiY H,Lina CY,Chang SC,etal.Occurrence ofhistamine and histamine-forming bacteria in salted mackerel in Taiwan[J]. Food Microbiology,2005,22(5):461-467.
[5]Huang Y,Liu K,Hsieh H,etal.Histamine leveland histamineforming bacteria in dried fish products sold in Penghu Island of Taiwan[J].Food Control,2010(21):1234-1239.
[6]Hsu H,Chuang T,Lin H,et al.Histamine content and histamine-forming bacteria in dried milkfish(Chanos chanos)products[J].Food Chemistry,2009,114(3):933-938.
[7]陶志华,佐藤实.金枪鱼肉中高组胺菌的分离及理化性质分析[J].生物技术,2009,19(5):41-43.
[8]沈萍,范秀荣,李广武.微生物学实验[M].北京:高等教育出版社,2001:116-123.
[9]Elliot J M,Mathre D E,Sand D C.Identification and characterization of rhizosphere-competent bacteria of wheat[J]. Applied and Environmental Microbiology,1987,53(12):2793-2799.
[10]Torres S,Roeckel M,Cristina MartíM.Histamine formation by Morganella morganii isolated from trachurus murphyii(Chilean mackerel)[J].Latin American Applied Research,2002,32(2):209-214.
[11]Rodtong S,Nawong S,Yongsawatdigul J.Histamine accumulation and histamine-forming bacteria in Indian anchovy(Stolephorusindicus)[J].Food Microbiology,2005,22(5):475-482.
Study on isolation and biological characteristics of histam ine-producing bacteria from mackerel
YANG Jian1,WU Zu-fang1,*,ZHOU Xiu-jin2,WENG Pei-fang1,LIW ei-wei1
(1.Faculty of Life Science and Biotechnology,Ningbo University,Ningbo 315211,China;2.Zhoushan Entry-Exit Inspection and Quarantine Bureau,Zhoushan 316100,China)
Histam ine-form ing bacteria were isolated by p resc reening step using the identification med ium from viscera ofmackerel,and the ability to p roduce histam ine of true histam ine formers were confirmed by HPLC analysis method.The strains were identified by physiology and biochem istry indicators,morphology and 16S rDNA gene sequence analysis.The results showed that the four histam ine-p roducing bac teria(T4,T5,T6 and T9)isolated from mackerel could p roduce 164.1~466.1μg/100m L histam ine in tryp ticase soya broth supp lemented w ith 1.0%L-histid ine.These strains were found identity by mean of physiochem ical p roperties and 16S rDNA gene sequence analysis among them.The T4 strain further conducted by phylogenetic analysis was found the highest sim ilarity w ith Proteus myxofaciens.The op timalgrow ing tem perature and pH to p roduce histam ine of strain T4 were 20℃and 7 respectively.
mackerel;histam ine-p roducing bacteria;physiological and biochem ical characteristics;16S rDNA sequence analysis
TS254.1
A
1002-0306(2012)09-0190-04
2011-08-12 *通讯联系人
杨健(1987-),男,硕士研究生,研究方向:食品生物技术。
浙江省公益性技术应用研究项目(2010C33180)。
