正交试验优化番茄红素微胶囊化工艺
2012-10-25邱伟芬汪海峰高瑀珑
邱伟芬,李 敏,汪海峰,高瑀珑
(南京财经大学食品科学与工程学院,江苏省粮油品质控制与深加工技术重点实验室,江苏 南京 210046)
正交试验优化番茄红素微胶囊化工艺
邱伟芬,李 敏,汪海峰,高瑀珑
(南京财经大学食品科学与工程学院,江苏省粮油品质控制与深加工技术重点实验室,江苏 南京 210046)
以水溶性大豆多糖为壁材,对喷雾干燥法番茄红素的微胶囊化工艺条件进行优化。通过单因素试验和正交试验考察壁材质量浓度、芯材壁材比、乳化剂含量、喷雾干燥进风口温度、出风口温度对番茄红素微胶囊效率的影响作用,同时用扫描电子显微镜法(SEM)对产品进行了形态观察。结果表明:最优工艺为壁材质量浓度0.28g/mL、芯材壁材比1:7、乳化剂质量分数2%、喷雾干燥进风口温度160℃、出风口温度88℃,所得微胶囊效率为91.8%,此番茄红素微胶囊产品膜结构致密完整。水溶性大豆多糖为壁材喷雾干燥法对番茄红素红素进行微胶囊包埋具有可行性。
番茄红素;微胶囊;水溶性大豆多糖;喷雾干燥
番茄红素(lycopene)是类胡萝卜素中的一种,它是许多类胡萝卜素生物合成的中间产物,是一种功能性的脂溶性色素,具有清除自由基、抗氧化、诱导细胞间连接通讯、调控肿瘤增殖、心血管病防治等多种功能[1],人体中存在番茄红素,它与人体的健康关系密切[2]。由于番茄红素分子中含不饱和双键,因此它非常不稳定,在光、热和氧的作用下容易氧化降解[3],这就大大限制了其使用价值,提高番茄红素在功能性产品中的可用性是近年来需进一步研究的一项核心技术。采用微胶囊技术对番茄红素进行包埋,可以使番茄红素与外界环境隔绝,保持其理化性质,提高溶解度和稳定性,促进其生理功能的发挥,最大限度地保护番茄红素的生物活性。
理想的微胶囊壁材应具有以下主要特性:良好的乳化稳定性和成膜性;黏度低,易溶解;可食性,无异味等[4]。水溶性大豆多糖(soluble soybean polysaccharides,SSPS)是近年来研究较多的一种新型水溶性天然高分子材料,具有特殊的分子结构,它表现出良好的乳化性、分散性、稳定性、抗黏结性及成膜性等,因此受到人们越来越多的关注[5]。同时水溶性大豆多糖本身就是膳食纤维,兼有抗氧化性和免疫学活性,它作为食品添加剂已经得到了广泛的研究与应用[6],但大豆多糖作为壁材的研究还不多见,因此本研究选用水溶性大豆多糖作为番茄红素的包埋材料,开发其作为微胶囊壁材的应用价值。目前,在番茄红素微胶囊领域,开发新型壁材也是研究的一个热点,已采用明胶、阿拉伯胶、β-环糊精、麦芽糊精和可变性淀粉等作为微胶囊化壁材,尚未见大豆多糖作为壁材制备番茄红素微胶囊的报道。
本研究采用大豆多糖为壁材,对番茄红素进行包埋处理,探讨喷雾干燥法制备番茄红素微胶囊的工艺条件,从而为实际生产提供理论依据。
1 材料与方法
1.1 材料与试剂
番茄红素油树脂(纯度6%) 红帆生物科技有限公司;番茄红素标准品(纯度>90%) 美国Sigma公司;Soyafibe-S-DA100水溶性大豆多糖 日本不二制油公司;乙酸乙酯、石油醚沸程(30~60℃)、丙酮、吐温-80和吐温-20(均为分析纯) 南京化学试剂有限公司。
1.2 仪器与设备
HH-4型数显恒温水浴锅 国华电器有限公司;JB25-M型电动搅拌机、DS-1型高速组织捣碎机 上海标本模型厂;L-117型喷雾干燥机 北京来亨科贸有限责任公司;722N型可见分光光度计 上海精密科学仪器有限公司;HG202-2(2A/2AD)电热干燥箱 南京实验仪器厂;UV2401PC紫外-可见连续扫描分光光谱仪 日本岛津公司;3400N扫描电子显微镜 日本日立公司。
1.3 方法
1.3.1 番茄红素微胶囊的制备
采用大豆多糖为壁材,对番茄红素油树脂进行包埋。将大豆多糖加入到一定量的蒸馏水中,并加入一定量吐温-20,在80℃进行搅拌溶解,制成水相。同时,在避光条件下,将番茄红素油树脂加入到乙酸乙酯中,并加入一定量吐温-80在60℃进行搅拌溶解后得到油相。将油相缓慢加入到水相中,并进行充分搅拌,使混合液温度保持在80℃,以蒸发混合液中多余的有机溶剂,从而得到符合本试验设计的固形物量含量的乳液,再经组织捣碎机均质(12000r/min、2min)后,番茄红素充分被基质包裹,最后进行喷雾干燥即可得到粉末状的番茄红素微胶囊化产品。
1.3.2 番茄红素微胶囊化效果测定
1.3.2.1 番茄红素最大吸收波长的测定
称取番茄红素标准品适量,用适量乙酸乙酯溶解,配制成一定质量浓度标准溶液,在300~600nm波长范围内进行扫描,结果显示番茄红素的吸收光谱在447.5、473.0nm和504.5nm处均出现较大的吸收峰,其中以473.0nm处的吸光度最大,故本研究选用此波长473nm来进行测定。
1.3.2.2 番茄红素标准曲线的绘制
参照GB/T 14215—2008《番茄酱罐头》中番茄红素测定方法,进行改进制作番茄红素标准曲线。具体如下:称取0.0025g番茄红素标准品溶解于适量乙酸乙酯中,完全转移至50mL棕色容量瓶,定容,摇匀。分别吸取0、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0mL置于50mL棕色容量瓶中,用乙酸乙酯定容,得到质量浓度为0.0、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0μg/mL的番茄红素标准溶液,在番茄红素的最大吸收波长473nm处,以乙酸乙酯为空白对照,分别测定吸光度。以番茄红素标准溶液质量浓度和相应吸光度分别为横、纵坐标,绘制标准曲线,得线性拟合方程为:y=0.0766x+0.0127,R2=0.9996。由此可知,番茄红素在0~10.00μg/mL质量浓度范围内,其质量浓度与吸光度存在良好的线性关系。
1.3.2.3 番茄红素微胶囊中番茄红素的测定
微胶囊中番茄红素含量的测定:称取番茄红素微胶囊0.1g于锥形瓶中,加适量的水,反复振荡使其充分溶解,然后加入石油醚与丙酮(1:1,V/V)的混合液,超声波(频率40kHz) 处理1min,番茄红素完全溶于有机溶剂,如此反复提取,直至水相变为无色为止。将有机相合并,加入适量无水硫酸钠进行脱水处理,于可见分光光度计在473nm处测定吸光度,对照标准曲线计算番茄红素含量。
微胶囊表面番茄红素含量的测定:称取番茄红素微胶囊0.1g于50mL具塞试管中,加入10mL石油醚,振荡1min,真空抽滤将滤液与不溶物质分离,不溶物质中加入石油醚多次提取至提取液无色,石油醚提取液合并后,于可见分光光度计在473nm处测定吸光度,对照标准曲线计算番茄红素含量。
1.3.2.4 番茄红素微胶囊化效率评定
微胶囊效率是评价所制备的微胶囊产品质量的重要指标。微胶囊效率高表明芯材裸露在微胶囊表面的数量少,与外界环境接触的机会少,产品的稳定性高,便于长时间贮藏。按照式(1)计算微胶囊效率。

1.3.3 番茄红素微胶囊制备单因素试验
分别设不同水平,分析壁材质量浓度、芯壁比、乳化剂含量、进风口温度和出风口温度5个单因素对微胶囊化效果的影响。
1.3.4 番茄红素微胶囊制备正交试验
在单因素试验基础上,采用L16(45)正交试验,设计5因素4水平试验,通过正交试验及方差分析来确定优化番茄红素微胶囊的最佳工艺条件。
1.3.5 番茄红素微胶囊产品的扫描电镜形态
参照文献Rosenberg[7]、谢良[8]和邓宇峰[9]等的方法。具体如下:取适量番茄红素微胶囊样品,使其均匀分散在双面胶上面,然后粘于样品台上,用离子溅射器喷一层150的金粉于微胶囊样品的表面,最后采用扫描电子显微镜(scanning electron microscopy,SEM),观察番茄红素微胶囊的表面形态结构。加速电压10kV,观察时间应尽可能短,以避免电子束长时间照射引起电子损伤。
2 结果与分析
2.1 单因素试验
2.1.1 壁材质量浓度对微胶囊化的影响
选择乳化剂添加量2%、芯材壁材比例1:4、进风口温度160℃、出风口温度90℃,考察不同壁材质量浓度对番茄红素微胶囊效率的影响。

图1 壁材质量浓度对番茄红素微胶囊化效果的影响Fig.1 Effect of wall material concentration on lycopene microencapsulation
由图1可知,在0.1~0.25g/mL范围内,随壁材质量浓度的增大,微胶囊效率逐渐增大;当质量浓度超过0.25g/mL时,微胶囊效率基本不变,壁材质量浓度为0.25~0.30g/mL时,微胶囊的效率达到最高,大约为82.7%。这是因为壁材质量浓度提高,有利于喷雾干燥过程中囊壁致密结构的形成;同时,由于壁材质量浓度的增加,缩短了玻璃态形成时间,减弱了番茄红素向囊壁表面的扩散和迁移,番茄红素能更好的持留,所以微胶囊效率有所提高。当壁材质量浓度较低时,乳化液中的水分含量相对较多,干燥过程中蒸发的水分增加,液滴的成膜速度减慢,番茄红素向外的扩散增多,微胶囊效率会降低。但当壁材质量浓度大于0.30g/mL后,由于壁材质量浓度的增大,会给乳化液的雾化造成困难,雾滴颗粒在干燥塔内的粘附很严重,故选择壁材质量浓度为0.25g/mL较为合适。
2.1.2 芯材壁材比例的选择
选择壁材质量浓度0.25g/mL,其他条件同2.1.1节,研究不同芯材壁材比例对番茄红素微胶囊效率的影响。

图2 芯材壁材比对番茄红素微胶囊化效果的影响Fig.2 Effect of ratio of core material to wall material on lycopene microencapsulation
从图2可知,当芯材壁材比例从1:2变化到1:4时,微胶囊效率显著增加,芯材壁材比例在1:4时达到最高,为72.1%,而当芯材壁材比例超过1:4时,微胶囊效率逐渐下降,当芯材壁材比例小于1:6时,微胶囊效率没有明显变化。其原因可能是随着壁材比例的逐渐增加,形成的微胶囊囊壁致密,有利于番茄红素的持留,微胶囊效率有所升高;但当壁材比例继续增加时,微胶囊效率有所下降,可能是由于壁材比例较大时,微胶囊粉末流动性变差,出现黏着现象;芯材含量过高,壁材分子表面吸附的番茄红素相应增加,暴露在表面的番茄红素易挥发和发生降解,从而使番茄红素微胶囊效率降低,故选择合适的芯壁质量比为1:6。
2.1.3 乳化剂含量的选择
选择芯材壁材比例1:6,其他条件同2.1.2节,研究不同乳化剂含量对番茄红素微胶囊效率的影响。

图3 乳化剂含量对番茄红素微胶囊化效果的影响Fig.3 Effect of emulsion content on lycopene microencapsulation
从图3可知,乳化剂质量分数含量在0~2%范围内,微胶囊效率上升,在2%~4%内,微胶囊效率变化很小。总体来讲,乳化剂含量对包埋效果影响不明显,其原因可能是由于大豆多糖乳化液油水界面膜的强度大,其乳化稳定性较高。但是在制备微胶囊时,不添加乳化剂的乳化液的稳定性差,不利于乳化液雾化成小液滴分散到热气流中,故成膜性不好,微胶囊效率低;而添加适量的乳化剂可以得到稳定性较高、分散性较好的的乳化液,有利于提高微胶囊效率;王俊华等[10]研究表明,乳化剂用量太多,会导致制备的微胶囊产品粒径过小,相对表面积增大,微胶囊易相互黏连,过多的乳化剂还会影响产品的风味等性质。因此应选取一个最适添加量,在本研究中乳化剂含量选择2%比较适宜。
2.1.4 进风口温度的选择
选择乳化剂添加量2%,其他条件同2.1.3节,研究不同进风口温度对番茄红素微胶囊效率的影响。
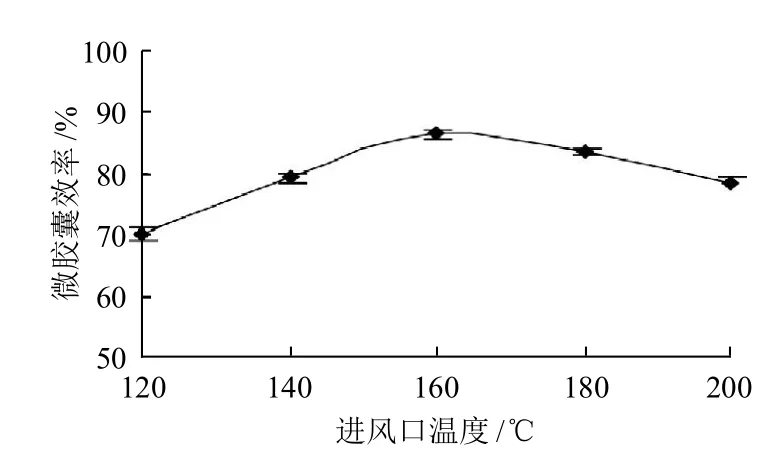
图4 进风口温度对番茄红素微胶囊化效果的影响Fig.4 Effect of inlet temperature on lycopene microencapsulation
由图4可知,随着进风口温度升高,番茄红素微胶囊效率显著增大,在进风口温度为160℃时番茄红素微胶囊效率最高,但当温度超过160℃,微胶囊效率反而下降。由此可见,适当提高进风口温度有利于番茄红素的包埋效果。由于提高了进风口温度,雾化后液滴等速干燥阶段的时间缩短,使得水包油(O/W)微细液滴表面水分迅速蒸发,形成完整致密的微胶囊膜结构,即促进微胶囊的玻璃化转变,番茄红素的持留能力增加。在微胶囊制备过程中,当喷雾干燥进风口温度低于150℃时,液滴颗粒较大,易黏结在干燥塔的塔壁上面,而只有细小的颗粒通过旋风分离器被收集,从而微胶囊效率较低;另外,进风口温度低,蒸发能力相对减弱,液滴表面膜结构形成所需时间较长,液滴不能充分干燥,导致产品水分含量过高,从而影响其流动性。当进风口温度超过160℃时,由于水分迅速蒸发导致微胶囊表面产生裂缝和凹痕,壁材成膜性降低,从而使得微胶囊中的番茄红素暴露或向囊壁扩散,番茄红素的持留能力减弱,微胶囊效率下降,为避免在高温下出现“焦粉”现象及番茄红素的降解,进风口温度在160℃较为合适。许多研究[11-14]表明,进风口温度会影响喷雾干燥速度和干燥能力;同时,也影响微胶囊产品的颗粒结构,吸湿性和热稳定性。因此本研究喷雾干燥过程中选用的进风口温度为160℃。
2.1.5 出风口温度的选择
选择进风口温度160℃,其他条件同2.1.4节,分析不同出风口温度对番茄红素微胶囊效率的影响。

图5 出风口温度对番茄红素微胶囊化效果的影响Fig.5 Effect of outlet temperature on lycopene microencapsulation
由图5 可知,微胶囊效率随着出风口温度的升高而逐渐增大,在90℃时达到最大,但是出风口温度高于95℃,番茄红素微胶囊效率明显下降。适当提高出风口温度,可以缩短物料减速干燥阶段的时间,使微胶囊壁快速形成致密结构,降低番茄红素的挥发损失,从而提高微胶囊效率;同时微胶囊产品中水分含量也明显降低,有利于提高产品的贮存期。出风口温度过低时,干燥时间长,会加速番茄红素的氧化降解,导致微胶囊效率下降;并且微胶囊产品水分含量高会造成产品保存性变差,容易产生黏结现象。出风口温度过高,会使微胶囊过度受热,出现裂缝,降低产品质量。因此本研究喷雾干燥过程中选用的出风口温度为90℃。
2.2 番茄红素微胶囊化工艺正交试验优化
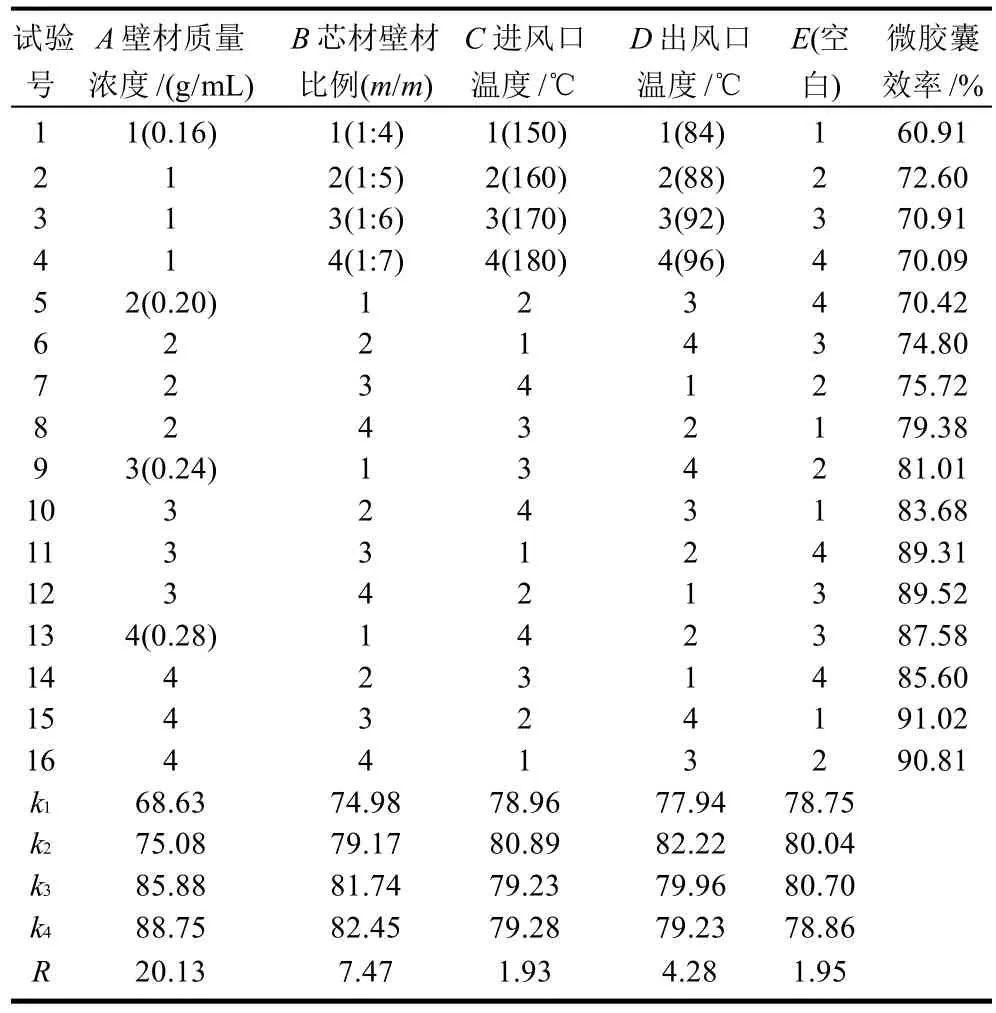
表1 番茄红素微胶囊化工艺优化正交设计和结果Table 1 Trials of orthogonal array design and experimental results
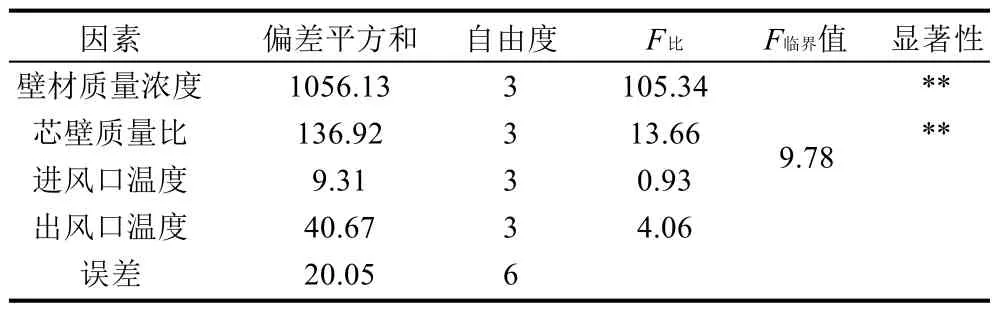
表2 正交试验结果方差分析Table 2 Analysis of variance of orthogonal array design
采用正交试验对番茄红素微胶囊工艺进行优化,以大豆多糖作为番茄红素微胶囊壁材,乳化剂添加量为2%,考察壁材质量浓度、芯壁质量比、进风口温度、出风口温度对微胶囊效率的综合影响,设计了5因素4水平正交试验L16(45),试验结果及方差分析分别见表1、2。
由表2可知,当以微胶囊效率为指标时,综合评价极差大小结果显示各因素作用主次顺序为A>B>D>C,即壁材质量浓度>芯壁质量比>出风口温度>进风口温度。由方差分析结果可以看出,当置信水平a=0.01时,由于FA>F0.01,FB>F0.01,说明壁材质量浓度、芯壁质量比对微胶囊效率影响极显著,进风口温度、出风口温度对微胶囊效率影响不显著。当置信水平a=0.05,FA>F0.05,FB>F0.05,说明壁材质量浓度、芯壁质量比对微胶囊效率影响显著,进风口温度、出风口温度对微胶囊效率影响不显著。
综合表1、2直观分析与方差分析,确定了喷雾干燥法制备番茄红素微胶囊工艺的最优组合为A4B4C2D2,即工艺条件为壁材质量浓度0.28g/mL、芯壁质量比1:7、进风口温度160℃和出风口温度88℃。在此条件下进行3次平行实验,所得番茄红素微胶囊平均效率为91.8%。正交试验结果与单因素试验结果有差别,其原因可能是各种因素之间的交互作用的影响。
2.3 番茄红素微胶囊产品的电镜扫描形态

图6 番茄红素微胶囊扫描电镜图(×600)Fig.6 Scanning electron microscope micrograph of lycopene microcapsule (×600)
从图6可观察到,本实验所制备的番茄红素微胶囊颗粒大多呈椭圆形或圆球形,除少数颗粒表面有凹陷以外,整个表面平滑、连续、无裂痕,说明微胶囊产品具有良好的流动性;番茄红素微胶囊的膜结构致密完整,可以有效阻止氧气、光线、水分子进入到微胶囊内部,达到保护番茄红素的目的。
本研究制备的番茄红素微胶囊产品少数颗粒表面有凹痕,与相关文献的结果一致。喷雾干燥法制备的微胶囊产品表面会出现凹痕是正常现象,Nilsson等[15]认为,凹痕的形成是由雾化液滴在干燥和冷却过程中发生收缩而导致的。凹痕的存在对微胶囊化的效果影响较小,但是不利于微胶囊产品的流动和分散。因此,在微胶囊制备过程中应尽量消除或减轻导致凹痕形成的因素。Pedroza-Ialas等[16]和Vernon-Carter等[17]研究表明,利用空气或水蒸气的热膨胀加快雾化液滴的干燥速率,可减少凹痕的形成。微胶囊表面不光滑平整,原因是在微胶囊制备过程中,壁材物质在芯材物质周围交织,当溶液中的水分受热蒸发时,壁材物质中的大量支链和环状结构形成薄膜,将芯材物质包埋其中,但是壁材种类不同,分子间的作用效果也不同,由于本研究采用的大豆多糖分子之间的结合作用力不同,导致微胶囊囊壁的厚度不同,使其表面凹凸不平。
3 结 论
本研究采用大豆多糖为壁材,采用喷雾干燥法对番茄红素进行微胶囊化处理,通过单因素试验和正交试验考察了壁材质量浓度、芯材壁材比、乳化剂含量、喷雾干燥进风口温度、出风口温度等因素对番茄红素微胶囊效率的影响作用,同时用SEM法对产品进行了形态观察。试验优化结果为壁材质量浓度0.28g/mL、芯材壁材比为1:7、乳化剂含量2%、喷雾干燥进风口温度160℃、出风口温度88℃,所得微胶囊效率为91.8%,此番茄红素微胶囊产品膜结构致密完整,因此,水溶性大豆多糖为壁材喷雾干燥法对番茄红素进行包埋是有可行性的。本研究为大豆多糖应用于番茄红素的微胶囊化提供了一定理论依据。
[1] REBOUL E, BOREL P, MIKAIL C, et al. Enrichment of tomato paste with 6% tomato peel increases lycopene andβ-carotene bioavailability in men[J]. The Journal of Nutrition, 2005, 135(4): 790-794。
[2] SEREN S, LIEBERMAN R, BAYRAKTA U, et al. Lycopene in cancer prevention and treatment[J]. American Journal of Therepeutics, 2008, 15(2): 68-81.
[3] 邱伟芬, 汪海峰, 陶婷婷. 超高压协同中温处理对番茄汁中番茄红素和总VC含量的研究[J]. 食品科学, 2010, 31(23): 93-95.
[4] LI Weigang, WU Gang, CHEN Hongzheng, et al. Preparation and characterization of gelatin/SDS/NaCMC microcapsules with compact wall structure by complex coacervation[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2009, 333(7): 133-137.
[5] NARASAKI T, FUJIMOTO J K. Separation of soybean hemicelluloses by paper electrophoresis[J]. Tech Bull Fac Agr Kagawa Univ, 1964, 16(3): 73-78.
[6] MATEOS-APARICIO I, MATEOS-PEINADO C, JIMENEZ-ESCRIG A et al. Mutifunctional antioxidant activity of polysaccharide fractions from the soybean by product okara[J]. Carbohydrate Polymers, 2010, 82(2): 245-250.
[7] ROSENBER M, KOPELMAN I J, TALMON Y. A scanning electron microscopy study of microencapsulation[J]. J of Food Sci, 1985, 50(22):139-144.
[8] 谢良, 许时婴, 王璋. 用扫描电镜(SEM)研究微囊化茴香油的超微结构[J]. 中国调味品, 1999, 6(12): 11-14.
[9] 邓宇峰. 采用复合壁材的ω-3多不饱和脂肪酸微胶囊化[J]. 食品与发酵工业, 2001, 27(6): 30-34.
[10] 王俊华, 蔡再生. 织物护肤整理剂角鳖烷微胶囊的研制[J]. 印染助剂, 2010, 27(1): 9-12.
[12] SAENZ C, TAPAOA S, CHAVEZ J, et al. Microencapsulation by spray drying of bioactive compounds from cactus pear (Opuntia ficus-indica)[J]. Food Chemistry, 2009, 114(2): 616-622.
[13] 朱选, 阳会军, 黄慧敏.β-胡萝卜素微胶囊化工艺参数的研究[J].食品与机械, 2000, 5(8): 54-58.
[14] SHU Bo, YU Wenli, ZHAO Yaping. Study on microencapsulation of lycopene by spry-drying[J]. Journal of Food Engineering, 2006, 76(4):664-669.
[15] NISSON W B, SEABOM GT, HUSTON J K. Partition coefficients for fatty acid esters in supercritical fluid CO2with and without ethanol[J]. J Am Oil Chem Soc, 1992, 69(4): 305-307..
[16] PEDROZA-IALAS R, VEMOM-CARTER E J. Using biopolymer blends for shrimp feedstuff microencapsulation-Ⅰ. Microcapsule particle size, morphology and microstructure[J]. Food Research International,1999, 32(3): 367-374.
[17] VEMONCARTER E J, SHERMAN P. Rheological properties and application of mesquito tree gum[J]. J Dispersion Sci Technol, 1981, 6(2):381-397.
Optimization of Lycopene Microencapsulation by Orthogonal Array Design
QIU Wei-fen,LI Min,WANG Hai-feng,GAO Yu-long
(Jiangsu Provincial Key Laboratory of Quality Control and Further Processing of Food and Oils, College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210046, China)
Lycopene microcapsulation was prepared by spray-drying method using a wall system consisting of soluble soybean polysaccharides (SSPS). The microencapsulation efficiency was optimized by single factor and orthogonal array design experiments. Factors such as wall material concentration, ratio of core and wall material, contents of emulsifier, inlet temperature and outlet temperature were thoroughly studied. Scanning electron microscope was also employed to observe the product appearance. The optimal condition was determined to be 0.28 g/mL, 1:7, 2%, inlet temperature at 160 ℃, and outlet temperature at 88 ℃, respectively. The microencapsulation efficiency of products obtained under these conditions was 91.8%. The structure of the microencapsulated lycopene product is compact and complete. Microencapsulating by spray-drying of lycopene using SSPS is feasible.
lycopene;microencapsulation;soluble soybean polysaccharide;spray-drying
TS202.3
A
1002-6630(2012)10-0045-06
2012-02-04
江苏省自然科学基金项目(BK2008364);江苏省高校自然科学研究资助项目(07KJB550033)
邱伟芬(1965—),女,教授,博士,研究方向为食品分析及天然物的提取。E-mail:weifenqiu@yahoo.com.cn
