不同植物源蜂胶挥发性成分差异分析
2012-10-25张红城
延 莎,张红城,董 捷*
(中国农业科学院蜜蜂研究所,农业部国家蜂产品加工专业分中心,北京 100093)
不同植物源蜂胶挥发性成分差异分析
延 莎,张红城,董 捷*
(中国农业科学院蜜蜂研究所,农业部国家蜂产品加工专业分中心,北京 100093)
采用顶空固相微萃取-气质联用技术分析4种不同植物来源的蜂胶挥发性成分,并结合主成分分析法对其进行分析。结果表明,不同植物源的蜂胶挥发性成分存在差异,主要表现在共有组分的含量和特有组分两个方面。其中的共有组分有3-甲基-3-丁烯-1-醇、异戊二烯、4-戊烯-1-乙酸酯、梨醇酯、4-异丙基甲苯、柠檬烯、桉叶油醇、3-蒈烯、壬醛、α-古巴烯、α-依兰油烯、去氢白菖烯、β-马榄烯、β-桉叶醇和α-桉叶醇,它们在各样品中的含量相差较大。特有组分,如:样品a,α-松油烯、α-柏木烯;样品c,α-姜黄烯、α-愈创木烯;样品d,石竹烯、γ-依兰油烯、苯甲酸苄酯。实验结果有利于提取蜂胶的特征信息,进行指纹图谱及区分模型的研究。
蜂胶;胶源植物;挥发性成分;固相微萃取;主成分分析
蜂胶是蜜蜂将采自植物的枝条、叶芽及愈伤组织等的分泌物与上腭腺、腊腺等的分泌物同少量花粉混合后所形成的黏性物质[1]。大量研究已经证明,蜂胶具有多种药理作用,抑菌、抗真菌、抗病毒、抗炎症、保肝、抗氧化和抗肿瘤等[2]。有报道指出,蜂胶的化学组成及功能特性与当地的植物源息息相关[3-4]。蜂胶中的化学成分由挥发性成分和非挥发性成分共同组成,其中的一些挥发性成分形成了蜂胶独特的气味,可作为一个重要的质量指标,具有指纹特征[5]。以往,研究者习惯于比较不同产地蜂胶的挥发性成分,如,Melliou等[6]研究了希腊5个不同地区的蜂胶挥发性成分,结果表明所有样品挥发性成分的组成主要是萜类化合物,尤其是α-蒎烯。在国内,也有一些研究者对不同产地的蜂胶挥发性成分进行了研究,曾晞等[7]用气相色谱-质谱法分析比较了贵州两个产地的蜂胶挥发油化学成分,结果表明两地蜂胶所含挥发油种数相近,成分有一定差异但不大。但是,来源产地的差异无法反映出不同蜂胶样品本质上的差异,因为胶源植物才是决定蜂胶差异的更为重要的因素。本实验利用顶空固相微萃取和气质联用技术(headspace-solid phase microextraction-gas chroma-tography-mass spectrometry,HS-SPME-GC-MS)分析4 种不同植物来源的蜂胶样品,并结合主成分分析法对其挥发性成分进行比较,以期为蜂胶质量评价及其标准制定提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
毛胶样品由国家蜂产业技术体系的专家通过当地的蜂业推广站直接提供,胶源信息见表1。

表1 蜂胶样品的产地及主要胶源植物Table 1 Original regions and plant sources of propolis samples
1.2 仪器与设备
PL303电子天平 瑞士Mettler Toledo公司;7890A GC/5975C MS气相色谱-质谱联用仪 美国Agilent 公司;中草药粉碎机 天津市泰斯特仪器有限公司;手动固相微萃取装置、DVB/Carboxen/PDMS萃取纤维(2cm-50/30μm) 美国Supelco公司;FDB02DD型加热器 英国Techne公司。
1.3 方法
1.3.1 蜂胶原料前处理
毛胶剔除杂质后放入冷冻柜冷冻4h以上,取出后迅速放入中草药粉碎机粉碎,过20目筛备用。
1.3.2 蜂胶挥发性成分的提取
对萃取时间、萃取温度和萃取头3个固相微萃取条件进行优化。结果表明,使用50/30μm DVB/CAR/PDMS萃取纤维,55℃萃取45min为最适宜萃取条件。
准确称取0.5g蜂胶样品,置于15mL顶空瓶中,55℃平衡15min,然后将装有萃取头的手动进样器插入顶空瓶中(萃取头使用前根据说明书进行老化),55℃顶空吸附45min,260℃解吸5min。
1.3.3 气相色谱-质谱条件
气相色谱条件:HP-5MS毛细管色谱柱(30m×250μm,0.25μm);初始温度40℃,保持3min,5℃/min升温到200℃,保持1min,再以12℃/min升至260℃,保持1min。进样口温度:260℃;载气He,流速1.0mL/min;5∶1 分流进样。
质谱条件:电离方式EI;电子能量70eV;离子源温度230℃;接口温度280℃;扫描质量范围45~550u。各组分经过NIST标准谱库检索和Wiley谱库相匹配。
1.3.4 数据处理方法
每个样品重复3次,根据面积归一法得到每种挥发性成分的相对含量。利用Alpha MOS公司的电子鼻自带数据处理软件,版本12.3,以在不同保留时间流出的化合物作为不同指标,对4个样品各组分的相对含量,12组数据进行主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 HS-SPME-GC-MS检测结果
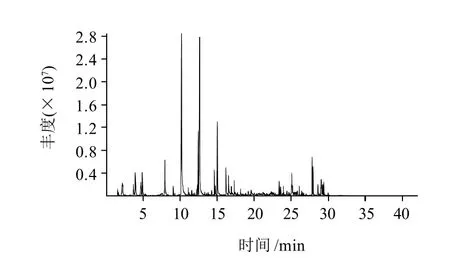
图1 HS-SPME-GC-MS法测定样品c挥发性成分的GC-MS总离子流图Fig.1 Total ion current of volatile components in propolis determined by HS-SPME-GC-MS
通过HS-SPME-GC-MS法得到的蜂胶挥发性成分的总离子流图(样品c)见图1,各样品主要的挥发性成分及根据面积归一法得到的相对含量见表2。胶源植物主要为党参的蜂胶样品根据保留时间共得到66个组分,占总组分的97.5073%,其中3-甲基-2-丁烯醛(5.133%)、苯甲醛(5.1179%)、α-柏木烯(9.5903%)、β-马榄烯(6.7502%)、β-桉叶醇(7.2866%)和α-桉叶醇(6.025%)含量较高;主要胶源植物为杨树的蜂胶样品共得到68个组分,占到总组分的96.9488%,其中苯甲醇(13.4731%)、壬醛(4.6823%)、苯甲酸(10.7157%)、α-紫穗槐烯(5.1566%)、β-桉叶醇(5.0611%)和α-桉叶醇(5.6298%)相对含量较高;主要胶源植物为毛栗子、五蓓子和漆树的蜂胶样品共得到74个组分,占总组分的97.1627%,其中苯乙烯(3.5063%)、苯甲醛(17.7887%)、桉叶油醇(3.7663%)、苯甲醇(19.4435)和壬醛(6.0427%)相对含量较高;主要胶源植物为椴树、松树和杨树的蜂胶样品得68个挥发性组分,占总组分的98.613%,其中苯甲醛(11.2215%)、苯甲醇(27.8108%)的含量显著高于此样品中的其他组分。
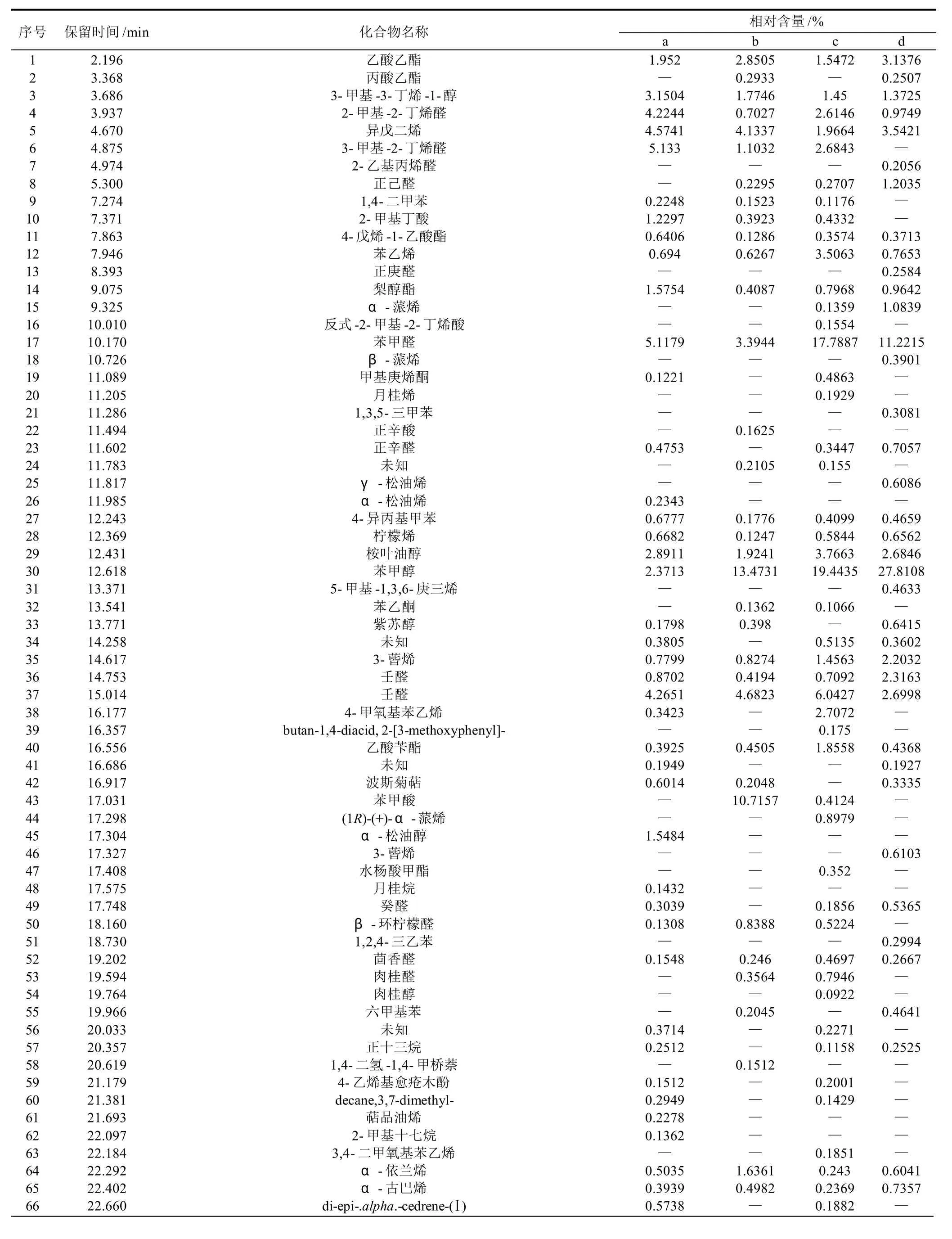
表2 不同植物源蜂胶各挥发性成分组成及其相对含量Table 2 Chemical compositions and relative contents of volatile components in propolis samples from different plant sources
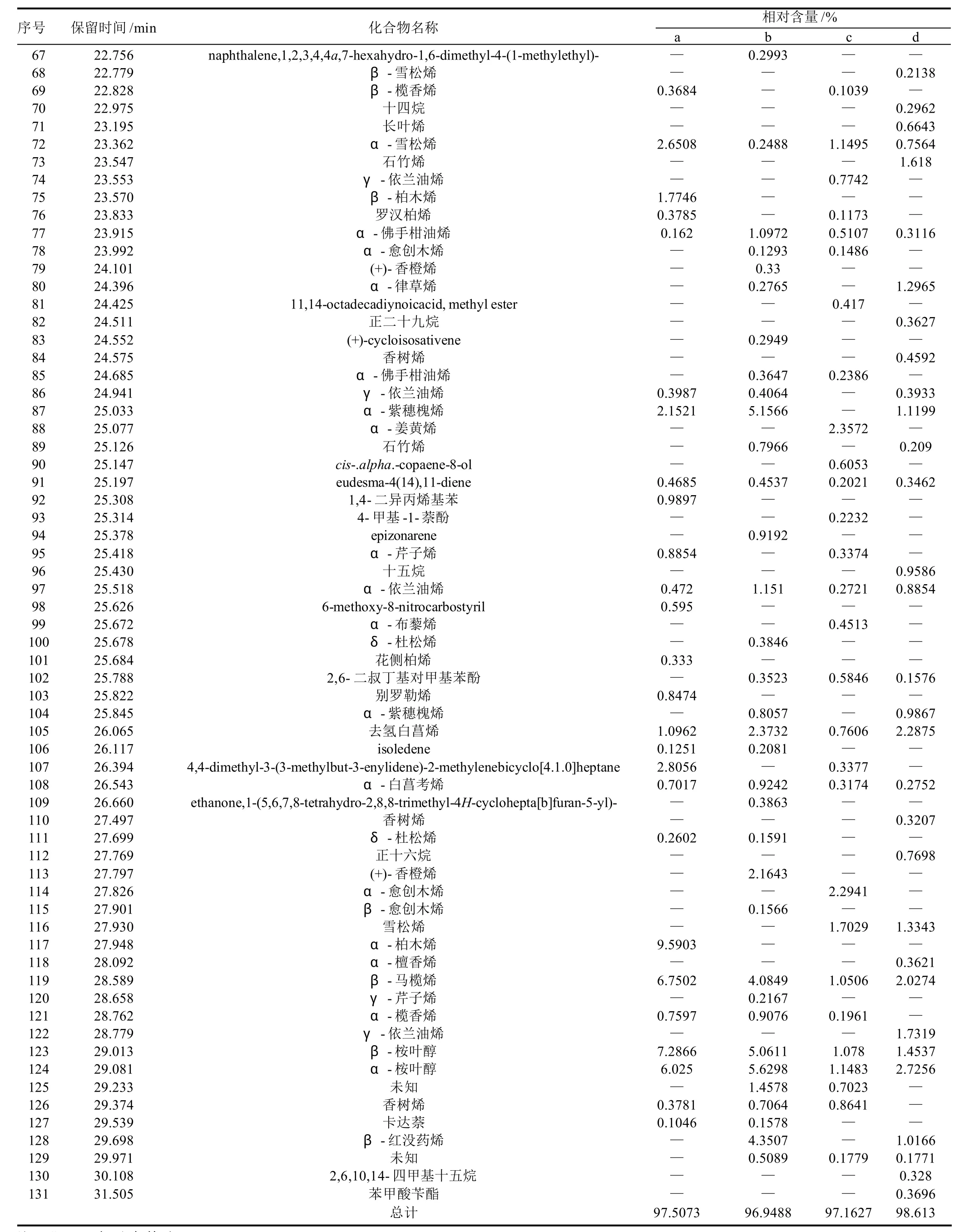
续表2
2.2 主成分分析结果
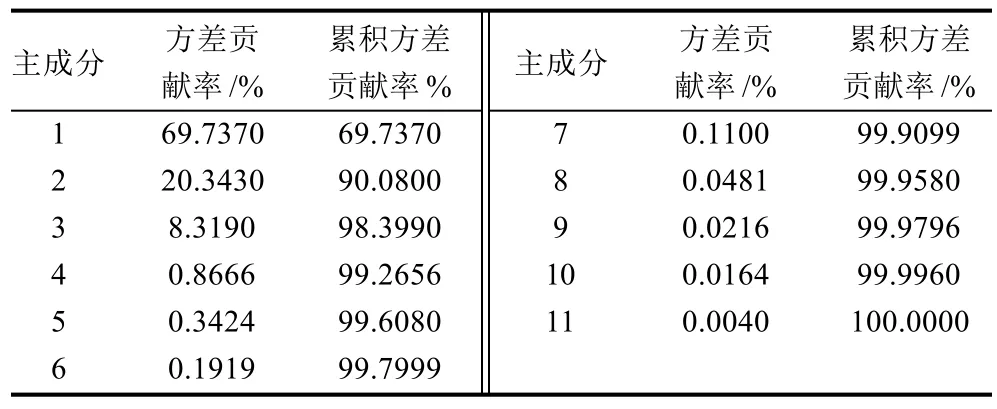
表3 主成分的累积方差贡献率Table 3 Cumulative proportion of principal components
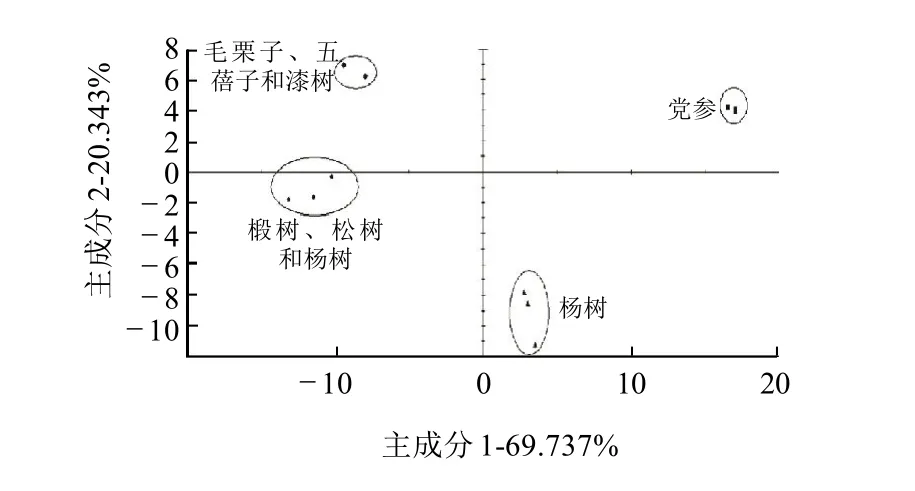
图2 不同植物源蜂胶主成分分析结果Fig.2 PCA results of propolis samples from different plant sources
如表2所示,通过HS-SPME-GC-MS所检测到的蜂胶挥发性组分很多,很难从中明显地发现不同植物源蜂胶样品之间的差异程度。主成分分析的中心目的是将数据降维,以排除众多化学信息共存中相互重叠的信息。它是将原变量进行转换,使少数几个新变量成为原变量的线性组合,同时,这些变量要尽可能多地表征原变量的数据结构特征而不丢失信息。新变量互不相关,即正交[8-9]。如表2所示,第1主成分的方差贡献率为69.737%,第2主成分的方差贡献率为20.343%,前两个主成分的累积方差贡献率为90.08%,故前两个主成分基本反映了所有数据的信息量(90.08%>80%)。
通过主成分分析,将原有的131个组分,减少到2个主成分,从而使引起不同植物源蜂胶挥发性成分差异的多维数据降到二维,差异更加明显化。利用这种数据处理方法,可以进一步建立不同植物源蜂胶的识别模式。对4种不同植物源的蜂胶主成分分析结果见图2,识别指数(DI)达到97(满分为100),表明这4种蜂胶样品差异较大,通过PCA能将其区分开。
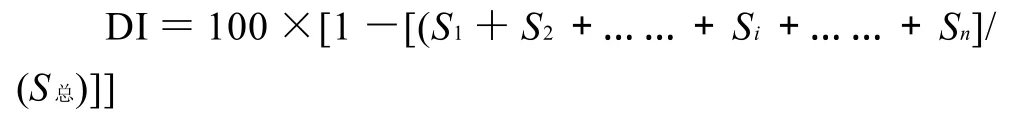
式中:Si代表各组样本的表面积;S总代表所有样本的总面积。
结合原始数据与主成分分析结果,在所列的区分四种蜂胶样品的挥发性成分中,其中的共有组分有3-甲基-3-丁烯-1-醇、异戊二烯、4-戊烯-1-乙酸酯、梨醇酯、4-异丙基甲苯、柠檬烯、桉叶油醇、3-蒈烯、壬醛、α-古巴烯、α-依兰油烯、去氢白菖烯、β-马榄烯、β-桉叶醇和α-桉叶醇,它们在各样品中的含量相差较大。还有一些组分是某样品的特有组分,如:样品a,17.304minα-松油烯,27.948minα-柏木烯;样品c,25.077minα-姜黄烯,27.826minα-愈创木烯;样品d,23.547min石竹烯,28.779minγ-依兰油烯,31.505min苯甲酸苄酯。这些组分信息可能是区分不同胶源植物的特征信息。
3 讨 论
利用SPME技术富集蜂胶中的挥发性成分,再进行GC-MS分析,方便、快捷、不消耗溶剂[10-11],有利于提取蜂胶挥发性成分中的特征信息。4种蜂胶样品的挥发性成分都由酸、醇、酯及烃类化合物构成,尤其是萜烯类化合物种类较多。Melliou等[6]指出希腊蜂胶抑菌活性可能与主要成分α- 蒎烯有关,徐响等[12]研究也发现蜂胶的挥发油具有抑菌作用。Popova等[13]用GC-MS分析和鉴别地中海不同地区蜂胶样品中的二萜类化合物,并指出二萜类化合物的色谱和质谱鉴别,对于快速地构建蜂胶类型和了解其植物来源是非常有利的。本研究中所得的化合物组成与Yang等[14]报道的较为相似,但与徐响等[15]报道的北京延庆和河北唐山两地蜂胶挥发性成分的主要贡献化合物有差异,这很可能是由于地理位置的不同,或者胶源植物的不同所引起的。
主成分分析结果表明,植物源是影响蜂胶挥发性成分差异的主要因素。a和c蜂胶样品都是来自甘肃省,b蜂胶样品和d蜂胶样品分别来自辽宁喀则和吉林敦化,但分析结果表明没有因为地理位置的相近而其特性相近,反而是样品c和样品d的特性较为相近。结合主成分分析结果与原始数据,一方面可以从蜂胶的挥发性成分中提取共有的特征信息,建立指纹图谱;另一方面可以辨出不同植物源蜂胶的特有信息,帮助快速准确的识别植物源。
本研究用HS-SPME-GC-MS分析4种不同植物源蜂胶的挥发性成分,其构成主要是醇、酯及烃类化合物,尤其是萜烯类化合物种类较多,不同植物源的蜂胶其含量相对较高的化合物类型并不相同。结合主成分分析,不同植物源的蜂胶样品挥发性成分确实有差异,且造成差异的因素一是共有组分的含量差异,另一方面是特有组分的显示,这些结果有利于提取其特征信息,进行指纹图谱及区分模型的研究。
[1] NY 5136 — 2002 无公害食品∶ 蜂胶[S].
[2] BANKOVA V. Chemical diversity of propolis and the problem of standardization[J]. Journal of Ethnopharmacology, 2005, 100(1/2)∶ 114-117.
[3] MARCUCCI M C. Propolis∶ chemical composition, biological properties and therapeutic activity[J]. Apidologie, 1995, 26(2)∶ 83-99.
[4] BANKOVA V, de CASTRO S L, MARCUCCI M C. Propolis∶ recent advances in chemistry and plant origin[J]. Apidologie, 2000, 31(1)∶ 3-15.
[5] 李雅萍, 贺丽萍, 陈玉芬, 等. SPME-GC/MS联用技术分析蜂胶中挥发性成分的研究[J]. 现代食品科技, 2007, 23(7)∶ 78-80.
[6] MELLIOU E, STRATIS E, CHINOU I. Volatile constituents of propolis from various regions of Greece-antimicrobial activity[J]. Food Chemistry, 2007, 103(2)∶ 375-380.
[7] 曾晞, 卢玉振, 牟兰等. GC-MS法分析比较贵州不同产地蜂胶挥发油化学成分[J]. 生命科学仪器, 2004(2)∶ 28-29.
[8] 许禄, 邵学广. 化学计量学方法[M]. 2版. 北京∶ 科学出版社, 2004∶130-137.
[9] SOLA L C , NAVARRO B I. Chemometric analysis of minerals and trace elements in raw cow milk from the community of Navarra, Spain[J]. Food Chemistry, 2009, 112(1)∶ 189-196 .
[10] MAZIDA M M, SALLEH M M, OSMAN H. Analysis of volatile aroma compounds of fresh chilli (Capsicum annuum) during stages of maturity using solid phase microextraction(SPME)[J]. Journal of Food Composition and Analysis, 2005, 18(5)∶ 427-437.
[11] 吴继红, 张美莉, 陈芳, 等. 固相微萃取GC-MS法测定苹果不同品种中主要芳香成分的研究[J]. 分析测试学报, 2005, 24(4)∶ 101-104.
[12] 徐响, 董捷, 丁小宇, 等. 不同方法萃取蜂胶挥发油组成及抑菌作用的研究[J]. 食品科学, 2010, 31(3)∶ 60-63.
[13] POPOVA M P, GRAIKOU K, CHINOU I, et al. GC-MS profiling of diterpene compounds inMediterranean propolisfrom Greece[J]. Agricultural and Food Chemistry, 2010, 58(5)∶ 3167-3176.
[14] YANG Chao, LUO Liping, SONG Huanlu, et al. Common aroma-active components of propolis from 23 regions of China[J]. Society of Chemical Industry, 2010, 90(7)∶ 1268-1282.
[15] 徐响, 董捷, 李洁. 固相微萃取与GC-MS法分析蜂胶中挥发性成分[J]. 食品工业科技, 2008, 29(5)∶ 57-60.
Difference in Volatile Compounds of Propolis from Different Plant Sources
YAN Sha,ZHANG Hong-chenge,DONG Jie*
(National Research Center of Bee Product Processing, Ministry of Agriculture, Institute of Apicultural Research,Chinese Academy of Agricultural Sciences, Beijing 100093, China)
Propolis is a sticky dark-colored material. Its pharmacological activity and chemical compositions are highly variable,which depends on the plant sources. Solid phase microextraction coupled with GC-MS was used to analyze the volatile compounds in propolis from 4 types of plant sources. The results of principal component analysis (PCA) revealed the difference of volatile compounds in different plant sources. The same components included 3-methyl-3-butene-1-ol, isoprene,4-pentene-acetate, prenyl acetate, 4-cymene, limonene, cineole, 3-carene, nonanal,α-cubaene,α-muurolene,β-eudesmol andα-eudesmol. This study will provide a theoretical reference for further investigation of fingerprints and distinguish diagram of propolis.
propolis;plant source;volatile compounds;solid phase microextraction (SPME);principal component analysis (PCA)
S896
A
1002-6630(2012)10-0268-06
2011-05-06
国家蜂产业技术体系资助项目(CARS-45-KXJ18);“十二五”国家科技支撑计划项目(2011BAD33B04)
延莎(1986—),女,硕士研究生,主要从事功能食品研究。E-mail:yansha052@126.com
*通信作者:董捷(1966—),女,研究员,硕士,主要从事功能食品研究。E-mail:jiedon@126.com
