HPLC法测定茶树花中可溶性糖、儿茶素和游离氨基酸
2012-10-25徐人杰汪名春屠幼英曾晓雄
徐人杰,王 琳,汪名春,叶 红,屠幼英,曾晓雄,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.浙江大学农业与生物技术学院茶学系,浙江 杭州 310029)
HPLC法测定茶树花中可溶性糖、儿茶素和游离氨基酸
徐人杰1,王 琳1,汪名春1,叶 红1,屠幼英2,曾晓雄1,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.浙江大学农业与生物技术学院茶学系,浙江 杭州 310029)
采用高效液相色谱法测定茶树(Camellia sinensis)花中可溶性糖、儿茶素和游离氨基酸的含量。结果表明:茶树花中含有216.85mg/g可溶性糖,其花冠、雄蕊群和雌蕊群部分(F-1)及花托、萼片和花梗部分(F-2)的含量分别为250.945mg/g和112.65mg/g;茶树花中总儿茶素含量为37.03mg/g,且F-2中的含量(46.90mg/g)高于F-1(30.88mg/g);茶树花中含有包括茶氨酸在内的16种游离氨基酸,含量为10.87mg/g,虽然F-2中游离氨基酸的种类较少,但其含量(16.47mg/g)显著高于F-1(10.59mg/g)。
茶树花;可溶性糖;儿茶素;游离氨基酸;高效液相色谱法
茶树花是茶树的生殖器官之一,一般于每年5月开始花芽分化,于9—12月陆续开放。成龄茶园每亩可采鲜花200~300kg,全国茶区每年可产茶树花300多万吨,资源丰富。此外,茶树花中含有丰富的蛋白质、茶多糖、氨基酸等活性物质[1-3]。因此充分利用茶树花资源,不仅有较大的社会效益,而且有极大的经济效益。据报道,茶树花中有机物占17.46%,其中茶多酚、蛋白质、茶多糖、可溶性糖、VC和氨基酸的含量分别为2.41%、4.67%、6.45%、0.63%、0.81%和0.503%[4]。董瑞建等[5]用常规水浴浸提法和超声波辅助浸提法来提取茶树花中的多酚,并研究了浸提温度、时间、料液比等因素对多酚得率的影响。Yang等[6]对茶树花的醇溶物进行了提取分离,并测定了其抗氧化活性,结果表明儿茶素类物质的抗氧化活性最强。陈小萍等[7]对茶树花多糖的提取、脱色和脱蛋白工艺进行了优化。Yoshikawa等[8]对茶树花的功能性皂苷类物质进行了分离,并研究了其在胃保护和降血糖等方面的活性。
尽管有文献报道了茶树花的主要生化成分,但对于其各组成部分的定性与定量分析鲜有报道。因此根据植物花的结构,将茶树花分为由花冠、雄蕊群和雌蕊群构成的第一部分(F-1)和由花托、萼片和花梗构成的第二部分(F-2),并采用高效液相色谱法(high pressure liquid chromatography,HPLC)对其可溶性糖、儿茶素与游离氨基酸的含量进行分析。通过对茶树花中主要生化成分(可溶性糖、儿茶素和游离氨基酸)的含量测定,为茶树花的深入研究与应用开发提供理论基础。
1 材料与方法
1.1 材料、试剂与仪器
茶树(Camellia sinensisL.)品种龙井43 的茶树花由浙江大学茶学系提供。
蔗糖、邻苯二甲醛(OPA)、4-苯磺酰氯和咖啡碱美国Sigma公司;果糖 美国Fluka公司;葡萄糖 德国Merck公司;表没食子儿茶素(EGC)、儿茶素(C)、表没食子儿茶素没食子酸酯(EGCG)、表儿茶素(EC)、表儿茶素没食子酸酯(ECG) 日本Funakoshi 公司;茶氨酸日本东京化学工业公司,其他各种氨基酸 上海楷洋生物技术有限公司;乙腈和甲醇(HPLC级) 江苏汉邦公司;(-)-表没食子儿茶素3-O(3-O-甲基)没食子酸酯(EGCG3"Me)和(-)-3-O-甲基-表儿茶素没食子酸酯(ECG3'Me)根据文献[9]方法制备。
1100高效液相色谱仪(配有四元泵、二极管阵列检测器(DAD)、柱温箱和化学工作站) 美国Agilent公司;Heidolph Laborota 4000真空旋转蒸发仪 德国Heidolph 公司;AY-120电子精密天平、BL-220H分析天平 日本Shimadzu公司;Anke TDL-5低速离心机 上海安亭科学仪器厂;HH-4数显恒温水浴锅 江苏国华电器有限公司;Sep-pak-C18固相萃取柱 美国Waters公司。
1.2 方法
1.2.1 茶树花的预处理
将茶树花样品分为F-1和F-2,然后分别用植物原料粉碎仪将茶树花、F-1和F-2粉碎,过60目筛,置干燥器中保存备用。
1.2.2 可溶性糖的测定
可溶性糖的测定采用HPLC法和苯酚-硫酸法[10-12]。称取一定量粉末样品,加入10mL 体积分数50%的乙醇溶液于50℃水浴中振荡提取30min,5000r/min离心10min,倾出上清液,残渣用同样方法提取2次,合并3次上清液并经真空旋转蒸发仪浓缩至干,加入体积分数50%的乙腈溶液溶解,0.45μm滤膜过滤,取滤液待用。
1.2.2.1 HPLC法
采用HPLC外标法测定样品中的可溶性糖含量,色谱条件:色谱柱Sugar-D(4.6mm×250mm,5μm,Nacalai Tesque Inc.);柱温 40℃;流动相为乙腈 -水(75∶25,V/V);流速1.0mL/min;进样量20μL。
1.2.2.2 苯酚-硫酸法[12]
取经0.45μm滤膜过滤的样品液,按苯酚-硫酸法处理测定490nm处的吸光度。准确称取一定量的葡萄糖,溶于蒸馏水中,分别配制成不同浓度梯度的标准溶液,按上述方法测定吸光度并制作工作曲线。
1.2.3 儿茶素的测定
称取一定量粉末样品,加入10mL 50%的乙腈于30℃水浴振荡提取40min,5000r/min离心后取上清液,经0.45μm滤膜过滤,取滤液待用。
采用HPLC外标法测定样品中的儿茶素含量[13]。色谱条件:色谱柱TSKgel ODS-100Z (150mm×4.6mm,5μm,Tosoh);柱温40℃;梯度洗脱(流动相A:10mmol/L KH2PO4,pH2.5;流动相B:CH3OH),洗脱时间15min,流动相B的比例由18%升至60%;流速1.0mL/min;进样量20μL。
1.2.4 游离氨基酸的测定
1.2.4.1 样品的制备
游离氨基酸的测定参照Wang等[14]的方法。称取一定量粉末样品,加入10mL蒸馏水,沸水浴浸提20min,5000r/min离心提取上清液,经0.45μm滤膜过滤。取1mL滤液上Sep-pak-C18固相萃取柱,用5mL 10%乙醇洗脱,收集洗脱液并旋转蒸发至干,再用1mL蒸馏水溶解,0.45μm滤膜过滤,取滤液待用。
1.2.4.2 OPA衍生化法测定游离氨基酸含量
取70μL滤液与10μL OPA(5mg OPA溶于0.05mL甲醇,再加入0.45mL 0.4mol/L硼酸缓冲液,最后加入25μLβ-巯基乙醇)衍生化试剂混合,25℃反应2min,然后进行色谱分析。色谱条件:色谱柱Zorbax Eclipse XDB-C18(150mm×4.6mm,5μm,Agilent);柱温:40℃;流动相A为甲醇-乙腈-水(45∶45∶10),流动相B为磷酸盐缓冲液(pH7.5),采用梯度洗脱(表1);流速:1.0mL/min;进样量:20μL。
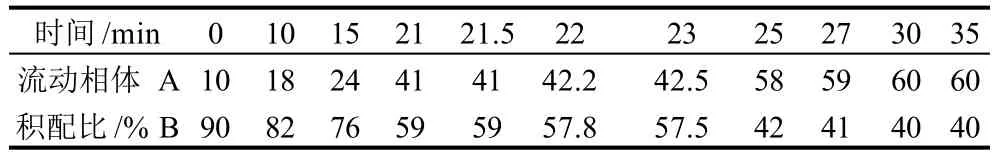
表1 HPLC分析流动相梯度洗脱Table 1 Elution gradient for HPLC analysis
准确称取各氨基酸标准样品,溶于一定量的蒸馏水中,分别配制成不同浓度梯度的标准溶液,按上述方法进行OPA衍生化与HPLC分析,制作工作曲线。
1.2.4.3 脯氨酸含量测定
脯氨酸含量测定采用HPLC法[15]。取50μL滤液与50μL 4-苯磺酰氯溶液(丙酮溶解,1mg/mL)混合,67℃反应10min,HPLC分析。色谱条件:色谱柱Zorbax Eclipse XDB-C18(150mm×4.6mm,5μm),柱温30℃;流动相A为乙腈,流动相B为0.045mol/L醋酸钠溶液(pH 4.0);流速1.0mL/min;进样量20μL。准确称取脯氨酸的标准样品,溶于一定量蒸馏水中,配制成不同浓度梯度的标准溶液,按上述方法进行苯磺酰氯衍生化与HPLC分析,制作工作曲线。
1.2.5 统计分析方法
数据分析采用微软Office Excel 2003进行统计分析。
2 结果与分析
2.1 茶树花中可溶性糖的测定
采用Sugar-D色谱柱和示差检测器对茶树花中的可溶性糖进行HPLC分析,结果显示茶树花中可溶性糖的组分得到了有效分离(图1)。根据与标准样保留时间的比较,茶树花中的可溶性糖主要为果糖、葡萄糖和蔗糖。此外,采用苯酚-硫酸法对茶树花中的总可溶性糖含量进行测定,结果如表2所示。
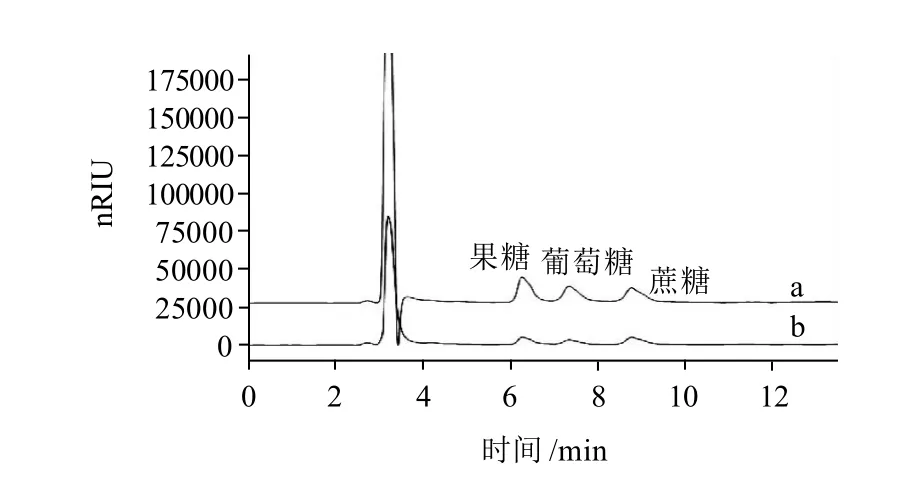
图1 茶树花F-1(a)和F-2(b)中可溶性糖的HPLC图谱Fig.1 HPLC chromatograms of soluble sugars in F-1 (a) and F-2 (b)from tea flowers
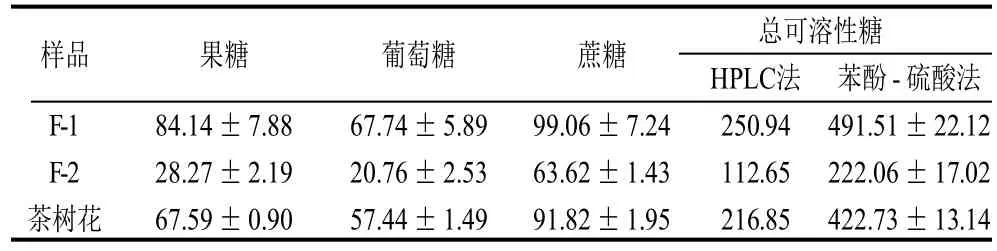
表2 茶树花中可溶性游离糖的含量Table 2 Content of soluble sugars in tea flowers mg/g
从表2可以看出,虽然F-1与F-2的可溶性糖的组成相同,但F-1中可溶性糖含量约是F-2的两倍。此外苯酚-硫酸法的测定结果约是HPLC法测得结果的两倍,这可能是茶树花中含有可溶性多糖等成分的原因。硫酸-苯酚法可以测定总糖的含量,但不能测定各种糖的具体含量,且特异性不强,原因是受到其他可与硫酸-苯酚试剂反应的物质干扰,如可溶性多糖可与硫酸-苯酚发生显色反应,而HPLC法主要分析可溶性糖中的单糖与低聚糖,因此硫酸-苯酚法的测定值会高于HPLC法的测定值。本实验测定了茶树花中游离糖的种类与含量,与报道的文献相比,茶树花中可溶性糖含量(216.85mg/g)远高于茶叶(绿茶 45mg/g)[16]。
2.2 茶树花中的儿茶素
采用TSKgel ODS-100Z色谱柱和DAD检测器对茶树花中的儿茶素进行HPLC分析,结果表明茶树花中含有EGC、C、EGCG、EC、ECG、EGCG3"Me、ECG3'Me及咖啡碱(图2),各成分含量见表3。国立台湾大学学者Lin等[17]分析了不同茶树品种茶树花的儿茶素与咖啡碱的含量,其结果与本实验结果一致。但本实验在茶树花中还检测到两种甲基化儿茶素
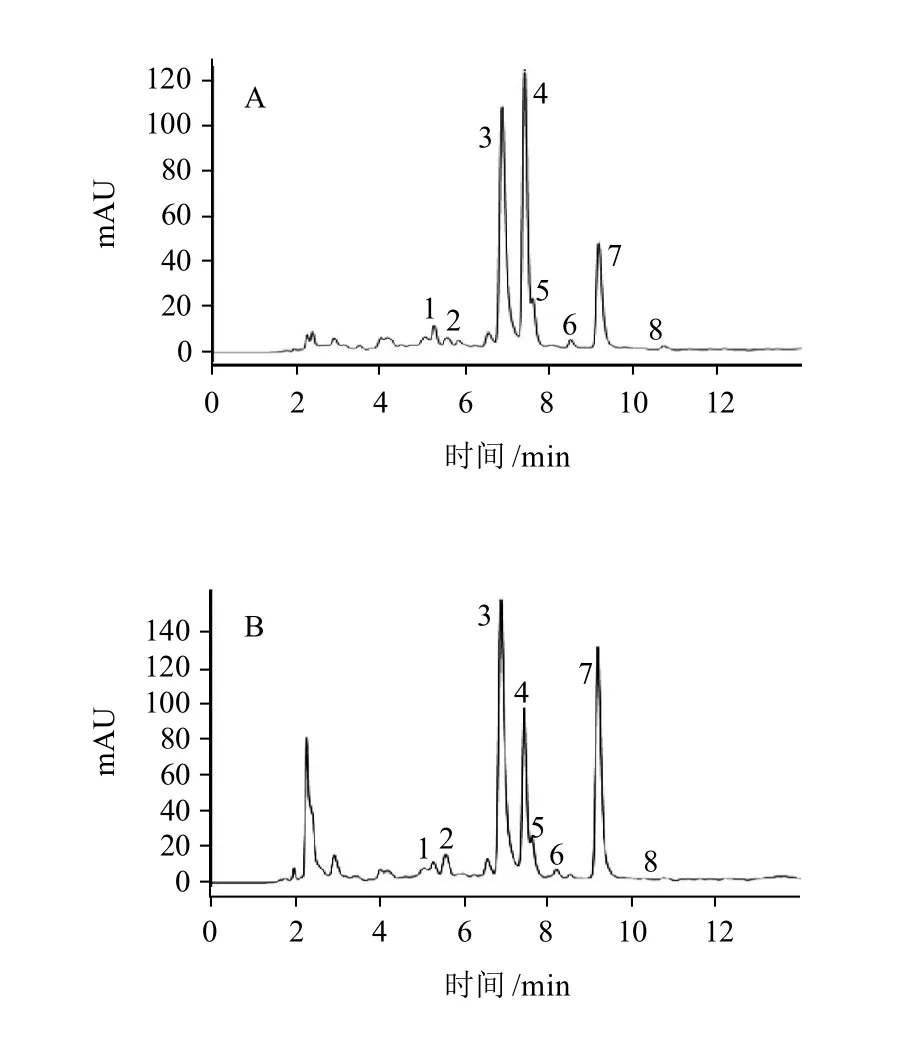
图2 茶树花F-1(A)与F-2(B)中儿茶素的HPLC图谱Fig.2 HPLC chromatograms of catechins in F-1 (A) and F-2 (B) from tea flowers
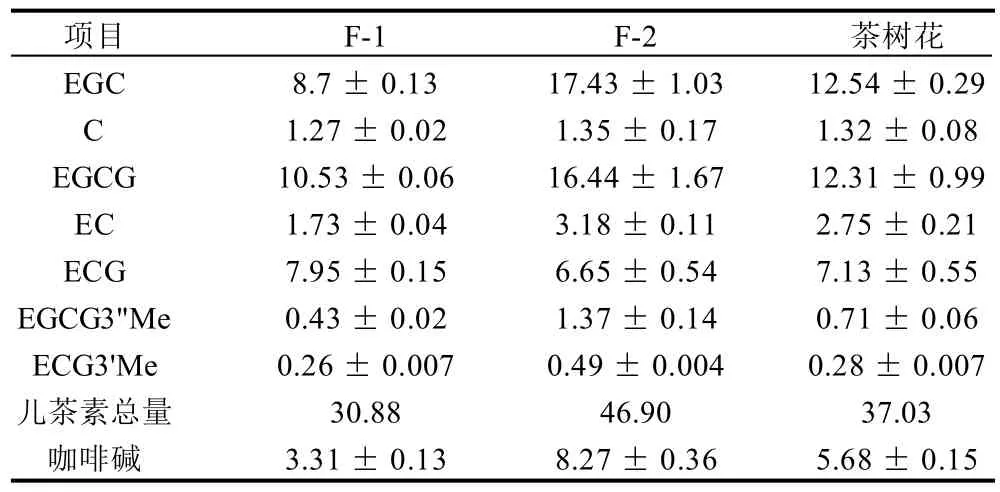
表3 茶树花中儿茶素与咖啡碱的含量Table 3 Contents of catechins and caffeine in tea flowers
(EGCG3"Me和ECG3'Me),其含量达1.86mg/g(F-2)。此外,值得注意的是F-1中咖啡碱的含量显著低于F-2。据报道,儿茶素具有抗肿瘤、抗氧化、抗癌、抗心脑血管疾病等生物活性[18],甲基化儿茶素对治疗花粉过敏等过敏反应症有极其显著的效果,而且它们的生物学功能己经在体外和体内的临床实验中得以证实[19]。
2.3 茶树花中的游离氨基酸
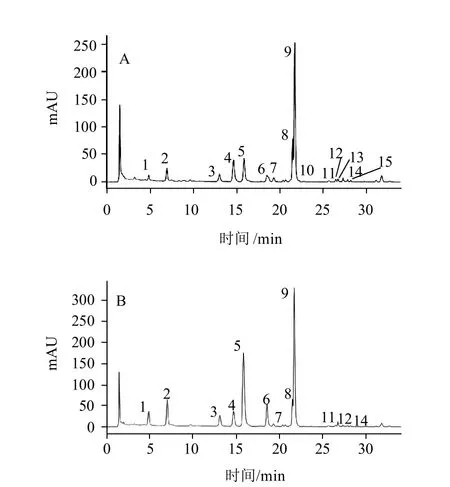
图3 茶树花F-1(A)与F-2(B)中游离氨基酸的HPLC图谱Fig.3 HPLC chromatograms of free amino acids in F-1 (A) and F-2 (B)from tea flowers
采用Zorbax Eclipse XDB-C18色谱柱和DAD检测器对茶树花中的游离氨基酸进行HPLC分析,图3表明,茶树花中的主要游离氨基酸得到了有效的分离。由于OPA衍生化方法不能检测脯氨酸,实验采用苯磺酰氯衍生化方法分析了茶树花中的游离脯氨酸,结果表明茶树花中含有游离的脯氨酸(图4)。根据各氨基酸标准样的保留时间,实验发现茶树花中含有16种游离氨基酸,其中15种为蛋白质氨基酸和1种非蛋白质氨基酸(茶氨酸),而且F-1与F-2的游离氨基酸组成基本相同。
根据各氨基酸的工作曲线,对茶树花中的游离氨基酸的含量进行分析,结果见表4。茶树花中茶氨酸(4.93mg/g)、组氨酸(2.14mg/g)、脯氨酸(1.28mg/g)的含量较高;F-1与F-2相比,F-1中含有较多的脯氨酸(2.15mg/g),而F-2中茶氨酸(5.94mg/g)、组氨酸(5.57mg/g)、谷氨酸(1.42mg/g)和精氨酸(1.12mg/g)的含量较高。
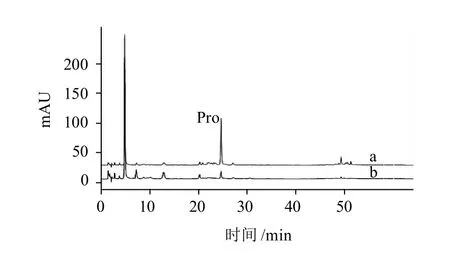
图4 茶树花F-1(a)与F-2(b)中游离脯氨酸的HPLC图谱Fig.4 HPLC chromatograms of free proline in F-1 (A) and F-2 (B)from tea flowers
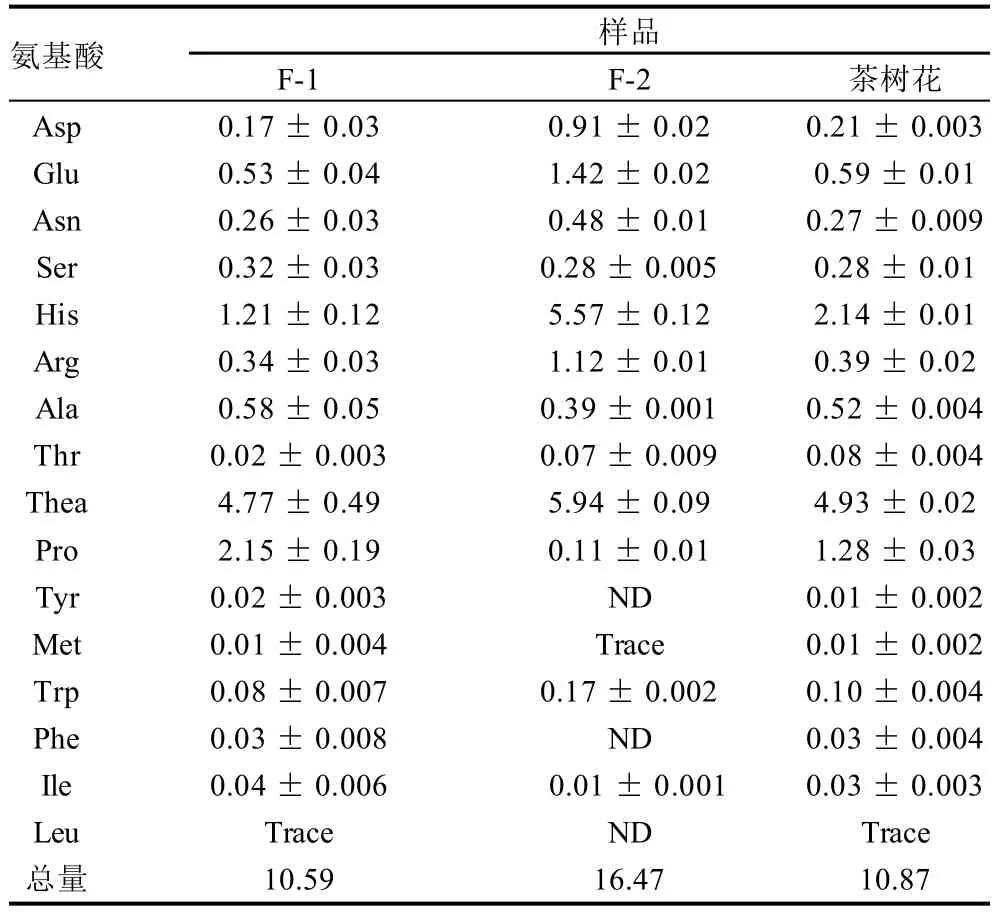
表4 茶树花中游离氨基酸的含量Table 4 Contents of free amino acids in tea flowersmg/g
茶氨酸是茶叶和部分山茶科植物特有的酰胺类物质,也是重要的功能成分。茶氨酸具有抗肿瘤、保护神经、增强记忆、抗糖尿病、降血压、抗疲劳、缓解抑郁症、保护心脑血管、减轻酒精对肝脏的伤害、增强对流行性感冒病毒疫苗的免疫响应等生理作用[20]。与茶叶相比,茶树花中茶氨酸的含量(4.93mg/g)高于茶叶中的含量(1.62~4.12mg/g)[14-15]。
3 结 论
本研究采用HPLC法对茶树花的主要生化成分(可溶性糖、儿茶素、咖啡碱和游离氨基酸)进行了系统的分析,结果表明茶树花含有儿茶素和茶氨酸等生理活性物质,而且茶氨酸等活性成分的含量较高。因此,鉴于我国丰富的茶树花资源,茶树花应是一种极具开发利用价值的茶叶副产物。
[1] 伍锡岳, 熊宝珍, 何睦礼, 等. 茶树花果利用总结报告[J]. 广东茶叶,1996(3)∶ 11-23.
[2] 王郁风. 开发茶树花资源增加茶农收入[J]. 茶叶机械杂志, 2002(3)∶3-4.
[3] 史和平. 茶树除花摘果,茶叶增产增收[J]. 农业科技通讯, 1985(9)∶ 15.
[4] 田国政, 王东辉, 周光来, 等. 茶树花营养成分的分析与评价[J]. 湖北民族学院学报∶ 自然科学版, 2004, 22(2)∶ 26-28.
[5] 董瑞建, 黄阿根, 梁文娟. 茶树花多酚提取工艺的研究[J]. 食品与机械, 2007, 23(1)∶ 83-86.
[6] YANG Z Y, TU Y Y, BALDERMANN S, et al. Isolation and identification of compounds from the ethanolic extract of flowers of the tea (Camellia sinensis) plant and their contribution to the antioxidant capacity[J]. LWTFood Science and Technology, 2009, 42(8)∶ 1439-1443.
[7] 陈小萍, 张卫明, 史劲松, 等. 茶树花水提多糖的精制工艺初探[J].食品科技, 2007(4)∶ 72-76.
[8] YOSHIKAWA M, WANG T, SUGIMOTO S, et al. Functional saponions in tea flower (flower buds ofCamellia sinensis)∶ gastroprotective and hypoglycemic effects of floratheasaponins and qualitative analysis using HPLC[J]. Yakugaku Zasshi, 2008, 128(1)∶ 141-151.
[9] 周蓓, 王琳, 李伟, 等. 茶叶中甲基化儿茶素的分离、纯化和高效液相色谱法分析[J]. 分析化学, 2008, 36(4)∶ 494-498.
[10] 向小丽, 杨立怡, 华双, 等. 不同品种鹰嘴豆中α-低聚半乳糖与蔗糖的含量分析[J]. 中国农业科学, 2008, 41(9)∶ 2762-2768.
[11] XIANG Xiaoli, YANG Liyi, HUA Shuang, et al. Determination of oligosaccharide contents in 19 cultivars of chickpea (Cicer arietinumL.)seeds by high performance liquid chromatography [J]. Food Chemistry,2008, 111(1)∶ 215-219.
[12] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,1956, 28(3)∶ 350-356.
[13] HU Bing, WANG Lin, ZHOU Bei, et al. Efficient procedure for isolating methylated catechins from green tea and effective simultaneous analysis of ten catechins,three purine alkaloids, and gallic acid in tea by highperformance liquid chromatography with diode array detection[J]. Journal of Chromatography A, 2009, 1216(15)∶ 3223-3231.
[14] ALICAZAR A, BALLESTEROS O, JURADO J M, et al. Differentiation of green, white, black, oolong, and Pu-erh teas according to their free amino acids content[J]. Journal of Agricultural and Food Chemistry,2007, 55(15)∶ 5960-5965.
[15] SYU K Y, LIN C L, HUANG H C, et al. Determination of theanine,GABA, and other amino acids in green, oolong, black, and pu-erh teas with dabsylation and high-performance liquid chromatography[J]. Journal of Agricultural and Food Chemistry, 2008, 56(17)∶ 7637-7643.
[16] 曾晓雄, 李雅萍, 孙怡, 等. 高效液相色谱法测定茶叶中游离糖的含量[J]. 分析化学, 2007, 35(6)∶ 930.
[17] LIN Yungsheng, WU Sangshung, LIN Jenkun. Determination of tea polyphenols and caffeine in tea flowers (Camellia sinensis) and their hydroxyl radical scavenging and nitric oxide suppressing effects[J]. Journal of Agricultural and Food Chemistry, 2003, 51(4)∶ 975-980.
[18] SCALBERT A, MANACH C, MORAND C, et al. Dietary polyphenols and the prevention of diseases[J]. Critical Reviews in Food Science and Nutrition, 2005, 45(4)∶ 287-306.
[19] SUZUKI M, YOSHINO K, MAEDA-YAMAMOTO M, et al. Inhibitory effects of tea catechins andO-methylated derivatives of (-)-epigallocatechin-3-O-gallate on mouse typeⅣ allergy[J]. Journal of Agricultural and Food Chemistry, 2000, 48(11)∶ 5649-5663.
[20] 王开荣, 邵淑宏, 叶俭慧, 等. 茶氨酸保健功能研究进展[J]. 茶叶,2009, 35(3)∶ 140-144.
Determination of Soluble Sugars, Catechins and Free Amino Acids in Tea Flowers by High Performance Liquid Chromatography
XU Ren-jie1,WANG Lin1,WANG Ming-chun1,YE Hong1,TU You-ying2,ZENG Xiao-xiong1,*
(1. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;
2. Department of Tea Science, College of Agriculture and Biotechnology, Zhejiang University, Hangzhou 310029, China)
The contents of soluble sugars, catechins and free amino acids in tea flowers fromCamellia sinensiswere analyzed by high performance liquid chromatography (HPLC). The results showed that tea flowers contained 216.85 mg/g soluble free sugars. Meanwhile, the contents of soluble sugars in corolla, stamen and pistil (F-1) and receptacle, sepal and pedicel (F-2) were 250.945 mg/g and 112.65 mg/g, respectively. Tea flowers contained 37.03 mg/g catechins. In addition, the content of catechins in F-2 was 46.90 mg/g, which was higher than that in F-1 (30.88 mg/g). Tea flower contained 16 kinds of free amino acids, and the content of total free amino acids was 10.87 mg/g. Although only 13 kinds of free amino acids were detected in F-2,its content (16.47 mg/g) was notably higher than that in F-1 (10.59 mg/g).
tea flower;soluble sugar;tea catechins;free amino acid;high performance liquid chromatography (HPLC)
Q946.3
A
1002-6630(2012)10-0246-05
2011-12-20
江苏省科技支撑项目(BE2010346);江苏高校优势学科建设工程项目
徐人杰(1985—),男,硕士,研究方向食品生物技术。E-mail:xurenjie0623@163.cn
*通信作者:曾晓雄(1964—),男,教授,博士,研究方向食品生物技术。E-mail:zengxx@njau.edu.cn
