白附子酪氨酸酶活性抑制成分的提取与分离
2012-10-24魏海柳张喜梅董方圆胡松青
穆 燕,魏海柳,李 琳,张喜梅,董方圆,胡松青
(华南理工大学 轻工与食品学院,广东广州 510640)
白附子酪氨酸酶活性抑制成分的提取与分离
穆 燕,魏海柳,李 琳,张喜梅,董方圆,胡松青*
(华南理工大学 轻工与食品学院,广东广州 510640)
研究了不同溶剂及提取方式对白附子中酪氨酸酶抑制成分的影响,并应用活性追踪法对白附子中酪氨酸酶活性抑制成分进行考察。结果表明,以20%乙醇水溶液为溶剂从白附子中提取的粗提物对酪氨酸酶活性的抑制作用最强,抑制率可达到96.35%,与恒温水浴振荡提取法相比,超声波辅助提取法对活性成分的提取效果更好。在此提取条件下所得白附子粗提物对酪氨酸酶的半抑制浓度IC50为24.69mg/mL。该粗提物依次经乙醚和正丁醇萃取,所得正丁醇萃取组分对酪氨酸酶的抑制率达71.94%。对高活性的正丁醇萃取组分进行分离,获得了一种酪氨酸酶抑制率高达98.82%的组分,是一种潜在的酪氨酸酶抑制剂。研究结果对白附子及其活性组分在医药和食品领域的应用有指导意义。
白附子,酪氨酸酶,抑制率,提取分离
酪氨酸酶(EC.1.14.18.1)是一种含铜的氧化还原酶,广泛存在于生物体中。植物酪氨酸酶与一些水果和蔬菜加工过程中的褐变有关,不利的酶促褐变会导致食品营养物质的减少以及经济损失;哺乳动物酪氨酸酶常见于黑色素细胞中,酪氨酸酶是目前已知的生物体中参与黑色素(Melanin)合成的关键酶[1-2],不仅决定黑色素合成的速率,还是黑色素细胞分化成熟的特征性标志[3],其异常过量表达可导致人体的色素沉着性疾病,如雀斑、黄褐斑、老年斑[4],在食品工业中酪氨酸酶抑制剂被作为食品保鲜剂[5]。随着对酪氨酸酶了解的不断深入,从植物中寻找高效、安全的酪氨酸酶活性抑制剂已成为重要研究方向,其生物活性和作用也将越来越受到人们的重视。近年来,研究发现多种植物提取物对酪氨酸酶有显著的抑制作用,如青梅花[6]、龙井[7]、柿叶[8]以及多种中草药[9]。白附子为天南星科梨头尖属植物独角莲(Typhonium giganteum Engl)的地下块茎,收载于我国2010版药典[10]。在中药美容药方中,白附子出现频率较高,占20%以上[11]。白附子的主要成分是脂肪酸、甾醇类化合物、挥发油成分和氨基酸等[12],近年来对白附子抗肿瘤、抗菌、抗炎等作用的研究很多[13],关于白附子的美白作用研究是相关研究领域中的热点。本文采用超声辅助提取白附子中有效成分,探讨白附子提取物对酪氨酸酶活性的抑制作用,并应用有机溶剂萃取、硅胶柱层析等分离手段,获得对酪氨酸酶具有较强抑制作用的活性组分。
1 材料与方法
1.1 材料与仪器
白附子 产地吉林省吉林市;氯仿、甲醇 天津大茂化学试剂厂,分析纯;正丁醇 江苏强盛化工有限公司,分析纯;乙醚 广州化学试剂厂,分析纯;L-酪氨酸 上海伯奥生物科技有限公司,生化试剂;酪氨酸酶 德国Sigma公司,生化试剂;磷酸二氢钾 国药集团化学试剂有限公司,生化试剂;硅胶 青岛谱科分离材料有限公司,100~200目。
GF254型硅胶板 青岛海洋化工厂分厂;BS210S型分析天平 德国Sartorius公司,T1-H-25型超声波清洗机 德国Elma公司;KR25i型高速冷冻离心机法国Jouan公司;UV-2102PC型紫外-可见分光光度计 尤尼柯(上海)仪器公司;DHG-9145A型旋转蒸发器 上海恒科有限公司;SHZ-D(Ⅲ)型循环水式真空泵 巩义市英裕予华仪器厂;PB-10型电子pH计 德国Sartorius公司。
1.2 实验方法
1.2.1 酪氨酸酶抑制率的测定 酪氨酸酶活性的测定参照文献[14-15]并做适当修改。样品溶于10%的DMSO溶液。将酶解反应底物L-酪氨酸溶于pH6.8的磷酸盐缓冲溶液中,配制成浓度为1.0mmol/L的L-酪氨酸溶液,将1mL的L-酪氨酸溶液加入编号为1、2、3的三支试管中,在1号试管中加入1mL磷酸盐缓冲溶液,在2、3号试管中加入1mL已配制好的白附子分离组分溶液,然后在1、2号试管加入0.5mL酪氨酸酶溶液(溶于pH6.8磷酸盐缓冲溶液),用pH6.8磷酸盐缓冲溶液将三个试管内的溶液体积补至3mL,体系中酶的终浓度为173U/mL。将1、2、3号试管于30℃孵育30min后在475nm处测其吸光值,记为A1、A2、A3。按式(1)计算白附子分离组分对酪氨酸酶活性的抑制率:
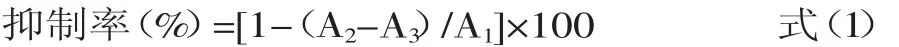
1.2.2 白附子粗提物对酪氨酸酶的抑制作用
1.2.2.1 不同溶剂提取物对酪氨酸酶活性的抑制作用 白附子原料粉碎后准确称取白附子样品10g于150mL锥形瓶内,分别用纯水与20%、40%、60%、80%的乙醇-水溶液50mL在50℃下恒温水浴提取1h,中速滤纸过滤后将滤液加3倍体积无水乙醇,置于4℃冰箱内静置24h将多糖鞣质等杂质沉降。沉降后粗提液于4000r/min高速离心15min后弃残渣,上清液于50℃减压浓缩去除乙醇,将浓缩液定容到50mL不同浓度乙醇水溶液提取的白附子粗提液,采用1.2.1所述方法测定各粗提物对酪氨酸酶活性的抑制率。
1.2.2.2 超声波及恒温水浴提取物对酪氨酸酶活性的抑制作用 根据1.2.2.1的实验结果,确定提取白附子中酪氨酸酶抑制有效成分的溶剂为20%乙醇水溶液,提取温度为50℃,提取时间为1h。分别在频率35kHz、功率1300W的超声水浴和转速150r/min的恒温水浴振荡条件下提取白附子有效成分,并采用1.2.2.1所述方法处理粗提液并测量其对酪氨酸酶活性的抑制率。
1.2.3 有机溶剂萃取分离白附子超声辅助提取物按1.2.2.2所述方法采用超声辅助提取白附子有效成分,将粗提液于50℃减压浓缩去除乙醇得到的白附子膏状提取物用蒸馏水混悬至密度为1.1~1.2g/cm3,依次用等体积的乙醚、正丁醇反复萃取4次。将获得的萃取液减压浓缩除去溶剂,分别记为乙醚相、正丁醇相、水相。各组分配制成10mg/mL粗分离液,测定其对酪氨酸酶活性的抑制率。
1.2.4 硅胶柱层析分离 用氯仿浸泡硅胶24h后湿法装柱。将正丁醇相萃取物与硅胶以1∶10的比例拌样后上样。用氯仿/甲醇(V/V)混合溶剂线性梯度洗脱(氯仿∶甲醇,100∶0→50∶50),按柱体积收集流出组分。室温下用硅胶G薄层板以氯仿-甲醇溶液作展开剂、碘蒸气为显色剂对流出组分进行薄层层析(TLC)示踪,根据TLC检测结果对分离部位进行合并,得到9个组分(A-I),将各组分去除有机溶剂后测定其对酪氨酸酶活性的抑制率。
2 结果与讨论
2.1不同溶剂白附子粗提物对酪氨酸酶活性的抑制作用

表1 不同溶剂提取物对酪氨酸酶活性的影响Table 1 Effect of extracts by different solvents on tyrosinase activity
不同浓度溶剂对提取白附子中酪氨酸酶活性成分的影响见表1。提取溶剂分别为水、20%乙醇水溶液、40%乙醇水溶液、60%乙醇水溶液和80%乙醇水溶液时,所得粗提物对酪氨酸酶活性的抑制率分别为33.99%、96.35%、4.41%、-3.57%和-16.58%。在所选的提取溶剂中,采用20%乙醇水溶液为提取溶剂所获得的粗提物基本可以完全抑制酪氨酸酶的活性,抑制率高达到96.35%,远高于采用其他溶剂体系下的白附子粗提物对酪氨酸酶活性的抑制率。当乙醇浓度达到60%或80%时,所获得的粗提物溶液对酪氨酸酶表现出轻微的激活作用。根据“相似相溶”原理可以推测白附子中抑制酪氨酸酶活性的主要成分为大极性组分。据此,本文后续实验中选择20%乙醇水溶液为提取溶剂来研究白附子中酪氨酸酶活性抑制组分。
2.2 不同提取方式的粗提物对酪氨酸酶活性抑制作用研究
固定其他条件不变,分别采用超声波辅助与恒温水浴振荡提取了白附子中的活性成分,并研究了粗提物对酪氨酸酶活性的抑制率。结果表明,两种提取方法所得的粗提物对酪氨酸酶活性的抑制率均超过90%,分别为98.1%和90.7%,即超声波辅助提取所得白附子粗提物对酪氨酸酶活性的抑制作用比恒温水浴振荡提取提高了7.4%。两种提取方法所用的提取溶剂及提取温度相同,所得到的粗提物成分基本一致;一般地,酪氨酸酶活性会随加入抑制剂的浓度而变化。因此,两种提取方法所得粗提物溶液对酪氨酸酶活性的抑制效果不同,是因粗提物中有效成分的含量不同所导致,在相同的提取时间内,采用超声波辅助提取,可以从白附子中提取出更多的活性成分。
2.3 白附子粗提物对酪氨酸酶活性的抑制作用研究
白附子粗提液对酪氨酸酶活性的抑制作用如图1所示。结果表明白附子粗提液对酪氨酸酶活性有较好的抑制作用,且其对酪氨酸酶的抑制作用呈浓度依赖性。以抑制率I(%)为因变量,白附子粗提物浓度C(mg/mL)为自变量,对相关数据进行线性拟合得如式(2)所示的线性方程[16],相关系数R2=0.99,表明在实验数据范围内,式(2)能较好地模拟白附子粗提物对酪氨酸酶活性抑制率I与浓度C之间的关系。
I(%)=2.60C-14.20式(2)
根据式(2)计算得到酪氨酸酶抑制率为50%时的白附子粗提物浓度(IC50)为24.69mg/mL。该半抑制率浓度虽然远低于化妆品中常用的酪氨酸酶抑制剂熊果苷的半抑制浓度(1.44mg/mL)[17],但是,作为植物来源的粗提物用于抑制酪氨酸酶活性具有一定的应用前景。而且,通过进一步研究粗提物中的高效、安全的酪氨酸酶抑制剂,将对开发天然的酪氨酸酶抑制剂提供重要依据。

图1 白附子粗提物对酪氨酸酶活性的影响Fig.1 Effect of crude extract of RT on tyrosinase activity
2.4 白附子粗提物的分离产物对酪氨酸酶的抑制作用
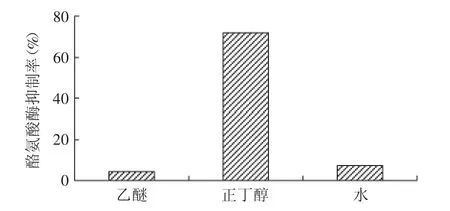
图2 不同溶剂萃取物对酪氨酸酶活性的影响Fig.2 Effect of extract by different solvents from crude extract on tyrosinase activity

表2 正丁醇相分离产物对酪氨酸酶活性的影响Table 2 Effect of extract of butanol on tyrosinase activity
白附子粗提物经乙醚、正丁醇依次萃取后,各组分对酪氨酸酶活性的抑制作用如图2所示。结果表明,在相同浓度下,乙醚萃取物溶液和水萃取物对酪氨酸酶活性几乎没有抑制作用,均低于10%。与之相比,正丁醇萃取物对酪氨酸酶活性的抑制率则高达71.94%,表明白附子粗提物中具有抑制酪氨酸酶活性的主要物质被富集到正丁醇中。
为了进一步分离纯化白附子中酪氨酸酶活性抑制的有效成分,采用硅胶柱层析分离正丁醇萃取部位,共获得了9个不同的组分,其对酪氨酸酶活性的抑制率如表2所示。由表2可见,D、E、F、G、H对酪氨酸酶活性表现出不同程度的抑制效果,其中由洗脱液为氯仿∶甲醇=8∶2的洗脱组分E对酪氨酸酶的抑制作用最强,其对酪氨酸酶的抑制率为98.82%,几乎完全抑制酪氨酸酶活性,不但高于其他组分,而且高于正丁醇萃取物,说明组分E很有可能是是白附子中抑制酪氨酸酶活性的成分的主要来源;组分D、F、G和H对酪氨酸酶都有一定的抑制作用,但都明显低于组分E,也低于白附子正丁醇萃取物。组分A、B、C和I为非极性组分和大极性组分,对酪氨酸酶活性的抑制率分别为-5.09%、-29.63%、-69.76%和-45.85%,表明它们不但对酪氨酸酶活性没有抑制作用,反而具有激活作用,其中组分C的激活率最高。
3 结论与展望
实验结果表明以20%乙醇水溶液为提取溶剂,应用超声辅助法提取可以从白附子中获得对酪氨酸酶活性具有显著抑制作用的粗提物;通过粗提物对酪氨酸酶活性抑制作用的研究,发现其对酪氨酸酶抑制效果明显,且具有浓度依赖性,其对酪氨酸酶的半抑制率浓度IC50为24.69mg/mL。利用不同种萃取剂对粗提物进行萃取分离,发现正丁醇萃取物对酪氨酸酶活性具有较高的抑制率;进一步应用硅胶柱层析对正丁醇萃取物进行分离,在洗脱液为氯仿∶甲醇=8∶2时收集到对酪氨酸表现出强抑制效果的组分,其对酪氨酸酶的抑制率高达98.82%。
本研究从白附子中获得了对酪氨酸酶具有较强抑制效果的组分,虽然该组分并非单一物质,深入的分离纯化工作尚待进一步探讨,但是,将该组分直接作为酪氨酸酶抑制剂应用于食品工业、化妆品工业乃至农业中,既可以达到应用效果,又能节约工业成本。另外,该方面的深入研究有望获得天然产物来源的高活性酪氨酸抑制单体化合物,对白附子及其有效成分的酪氨酸酶活性抑制剂的开发和应用有指导意义。
[1]Te-Sheng Chang.An updated review of tyrosinase inhibitors[J].International Journal of Molecular Sciences,2009,10:2440-2475.
[2]K Bao,Y Dai,Z-B Zhu,et al.Design and synthesis of biphenyl derivatives as mushroom tyrosinase inhibitors[J].Bioorganic&Medicinal Chemistry,2010,18:6708-6714.
[3]Oetting W S.The tyrosinase gene and oculocutaneous albinism type 1(OCA1):a model for understanding the molecular biology of melanin formation[J].Pigment Cell Res,2000,13:320-325.
[4]Yan F, William H F.Purification and characterization of tyrosinase from gill tissue of Portabella mushrooms[J].Phytoehemistry,2004,65(6):671-678.
[5]Lee-Wen Changa, Lih-Jeng Juangb, Bor-Sen Wanga, et al.Antioxidant and antityrosinase activity of mulberry(Morus alba L.) twigs and root bark[J].Food and Chemical Toxicology,2011,49(4):785-790.
[6]石嘉怿.青梅花提取物的酪氨酸酶抑制作用及机理研究[J].食品工业科技,2011,32(10):205-211.
[7]马燕燕,鲁晓翔.龙井乙醇提取物对酪氨酸酶活性的抑制作用[J].食品工业科技,2011,32(11):141-143.
[8]鲁军,任迪峰,杨阳,等.柿叶多酚的提取及体外生物活性的研究[J].食品工业科技,2010,31(7):88-91.
[9]宋业强,陈会苓,唐志坤,等.53味治疗白癜风中药水提物对蘑菇酪氨酸酶活性的影响[J].中华中医药杂志,2011,26(11):2724-2725.
[10]国家药典委员会编.中华人民共和国药典 (一部)[S].北京:中国医药科技出版社,2010.
[11]陈西平,张晓丹.《千金要方》美容药物关联分析[J].黑龙江中医药,2010(4):47-48.
[12]石延榜,张振凌.白附子化学成分及药理作用研究进展[J].中国实用医药,2008,3(9):130-131.
[13]胡长效,朱静,孙晓静.独角莲的化学成分及药理作用研究进展[J].农业与技术,2007,27(2):50-54.
[14]鄢贵龙,刘乃森.葛根提取物对酪氨酸酶活性的影响[J].天然产物研究与开发,2009,21:96-98.
[15]K Nagendra Prasad, Bao Yang, Shaoyu Yang, et al.Identification of phenolic compounds and appraisal of antioxidant and antityrosinase activities from litchi(Litchi sinensis Sonn.)seeds[J].Food Chemistry,2009,116:1-7.
[16]龚盛昭,杨卓如,程江.酪氨酸酶抑制剂IC50值的计算方法及其验证[J].日用化学工业,2007,37(3):149-155.
[17]宋康康,邱凌,黄璜,等.熊果甙作为化妆品添加剂对酪氨酸酶抑制作用[J].厦门大学学报:自然科学版,2003,42(6):791-794.
Extraction and isolation of crude tyrosinase inhibitory compounds from Rhizoma Typhonii
MU Yan,WEI Hai-liu,LI Lin,ZHANG Xi-mei,DONG Fang-yuan,HU Song-qing*
(College of Light Industry and Food Sciences,South China University of Technology,Guangzhou 510640,China)
The extracting solvent and conditions were evaluated to extract compounds with tyrosinase inhibitory effect from Rhizoma Typhonii(RT) and the inhibitory effect of the crude extract of RT was also discussed.Compounds extracted with 20%ethanol aqueous solvent presented the best inhibition ability on tyrosinase with tyrosinase inhibitory rate of 96.35%.Additionally,more effective compounds were extracted by ultrasoundassisted extraction method than that of shaking method.Results showed that crude extract of RT could well inhibit tyrosinase activity with an IC50value of 24.69 mg/mL.The crude extract was extracted by ether and nbutyl alcohol in succession.Constitutes in n-butyl alcohol layer could inhibit tyrosinase activity with an inhibitory rate of 71.94%.Moreover,extracts in n-butyl alcohol layer were separated on a silica gel column,and the compounds with an inhibition rate of 98.82%on tyrosinase were obtained,which was a potential tyrosinase inhibitor.Study result will be beneficial to the application of RT and its effective compounds in medicine and food industry.
Rhizome Typhonium;tyrosinase;inhibition rate;extraction and separation
TS201.2
B
1002-0306(2012)11-0247-04
2011-11-29 * 通讯联系人
穆燕(1984-),女,博士,主要从事天然产物分离纯化的研究。
新世纪优秀人才支持计划(NCET-10-0362);华南理工大学中央高校经费资助项目(2012ZG0007)。
