一株芒果炭疽病拮抗菌抑菌活性的研究及其鉴定
2012-10-24李春玲王庆国胥丽娜陈庆敏
李春玲,王庆国,*,胥丽娜,陈庆敏
(1.山东农业大学食品科学与工程学院,山东泰安 271018;2.山东省果蔬食用安全工程技术研究中心,山东济南 251400)
一株芒果炭疽病拮抗菌抑菌活性的研究及其鉴定
李春玲1,王庆国1,*,胥丽娜2,陈庆敏2
(1.山东农业大学食品科学与工程学院,山东泰安 271018;2.山东省果蔬食用安全工程技术研究中心,山东济南 251400)
从芒果表皮分离得到29株内生细菌,对峙培养法发现菌株B2-1对芒果炭疽病菌丝的生长具有较强的抑制作用。通过离体实验和活体实验对拮抗菌株B2-1抑菌活性进行了研究,离体实验结果表明,B2-1的发酵滤液、挥发性代谢产物以及非挥发性代谢产物都对芒果炭疽病菌丝的生长有很强的抑制作用,其中B2-1发酵液的非挥发性代谢产物对芒果炭疽病菌丝生长的抑制率达到了99.86%,抑菌效果显著。活体实验结果表明,B2-1的菌悬液和发酵液与对照相比显著降低了芒果炭疽病的发病率,提高了芒果的可食用果率。进一步对菌株B2-1进行鉴定,综合形态学观察和生理生化特征检测以及16S rDNA序列分析,B2-1菌株被鉴定为枯草芽孢杆菌。
芒果,拮抗菌株B2-1,炭疽病,抑菌活性,鉴定
芒果是著名的热带水果,被誉为“热带水果之王”,在热带水果中排名第三。芒果果实因具有丰富的营养价值而备受国内外特别是东方国家消费者的欢迎[1]。炭疽病由胶孢炭疽菌引起[2],是采后芒果的主要病害[3-4],在世界各芒果产区广泛发生[5],其致病菌为黑盘孢科胶孢炭疽菌(Colletotrichum gloeosporioides Penz)。该菌以分生孢子侵染植物的叶、梢、花穗、果,导致梢枯、叶斑、落叶和落花、落果。炭疽病菌于采前在田间潜伏侵染芒果,采后很难控制,因而易导致贮运期间果实腐烂,缩短芒果的商品货架期[6]。目前主要依靠化学杀菌的方法来抑制芒果炭疽病害,也有利用植物提取物防治芒果炭疽病[7-8]。但采用化学农药防治芒果炭疽病,引入的不安全因素较多,不仅毒害有益的微生物并导致病原菌产生抗药性,还会造成严重的环境污染。植物提取液防治芒果炭疽病的方法成本较高,工作量大。生物制剂具有用量少、无残留、无公害、不形成抗性等特点,是防治芒果炭疽病的理想选择,应用拮抗微生物防治芒果炭疽病害虽然在国内外已有一些报道[9-15],但大多都是在采前进行防治,采后防治研究也大多局限于离体实验。本研究在离体实验的基础上,对芒果活体进行接种和浸蘸实验,统计其自然炭疽病发病率,该方法与实际情况相结合更具有实用评价价值,为进一步把生物防治芒果炭疽病的方法应用到实际打下了基础。
1 材料与方法
1.1 实验材料
芒果炭疽菌 由中国农业微生物菌种保藏管理中心提供;拮抗菌株B2-1 山东农业大学食品学院果蔬保鲜实验室分离筛选获得;PDA培养基 马铃薯200g,葡萄糖20g,琼脂15~20g,蒸馏水1000mL;NB培养基 蛋白胨10g,牛肉粉3g,氯化钠5g,蒸馏水1000mL。
1.2 拮抗菌株B2-1的分离筛选
取10g感染芒果炭疽病的芒果果皮病健交界处,用无菌水进行表面冲洗,晾干,切成长度和宽度为5mm×5mm、厚度为1mm左右的小块组织,依次用75%乙醇(v/v)、5%NaClO(v/v)分别进行30s、5min的表面消毒,再用无菌水中漂洗3次,研碎,然后转入装有100mL无菌水的200mL三角瓶中,在28℃下180r/min振荡培养20min,取原液按常规稀释法稀释成10-2、10-3、10-4,然后各取120μL(包括原液)涂板,28℃下培养。根据平板上长出的菌落形态,挑取形态有差异的细菌菌落,纯化后用对峙培养法作抗性初筛[16]。在PDA平板中央接种6mm芒果炭疽病的菌落的圆柱形琼脂块,28℃恒温培养24h,在芒果炭疽病菌菌落圆片周围3cm处沿四个方向,对称点种分离得到的细菌,一周后观察抑菌带产生情况[15],选择抑菌带最宽的1个菌株作为芒果炭疽病菌的拮抗细菌进行后续实验。
1.3 离体抑菌活性的测定
1.3.1 拮抗菌株B2-1发酵滤液对芒果炭疽菌丝的抑制作用 NB液体培养基100mL,灭菌后接种一环活化的B2-1菌种,25℃下180r/min振荡培养72h,将此发酵液用无菌过滤器过滤,然后用熔化的PDA培养基进行浓度稀释,分别稀释为原浓度的20%、10%和5%,然后将其倒入灭菌的培养皿中冷却凝固成平板,在平板中央接种6mm的芒果炭疽病圆形琼脂块,对照用PDA培养基代替稀释的发酵滤液。28℃恒温培养,待对照菌落布满平板时,测量处理菌落的直径。每个处理三个重复。计算拮抗细菌培养滤液对芒果炭疽病菌丝的抑制率,抑制率计算公式[17]如下:
抑制率(%)=[(对照菌落净生长直径-处理菌落净生长直径)/对照菌落净生长直径]×100
1.3.2 拮抗菌株B2-1挥发性代谢产物对芒果炭疽菌丝的抑制作用 采用平板对扣法[18],在NB平板上接种200μL的B2-1发酵液(另一处理NB平板涂满拮抗菌株B2-1),PDA平板中央接种6mm的病菌菌饼后,去皿盖后与接种B2-1发酵液的NB平板皿底相扣,然后用保鲜膜封好两皿底相扣处的边缘,接种拮抗细菌B2-1的平板在上,置于28℃恒温培养。以只接种病菌菌饼的PDA平板和不做任何处理的NB平板对扣为对照,7d后测量病菌菌落直径,计算抑制率[17],每个处理三个重复。
1.3.3 拮抗菌株B2-1非挥发性代谢产物对病菌菌丝的抑制作用 采用双平板—滤纸法。先于直径9cm的培养皿中倒入15mL PDA培养基为底层培养基,待培养基冷凝后,将预先准备好的边缘上折的直径为12cm的无菌滤纸轻轻贴于PDA平板上,再向滤纸上倒入10mL PDA培养基为上层培养基,待培养基冷却后,吸取120μL B2-1发酵滤液均匀涂抹于上层平板,28℃恒温培养48h后,除去滤纸以及滤纸上所有部分,并在底层培养基中央接入直径为6mm的芒果炭疽病病菌菌饼,28℃下恒温培养7d,测量病菌菌落直径[19],计算抑制率[17],每个处理三个重复。
1.4 活体抑菌活性测定
1.4.1 芒果活体接种实验 将健康七成熟的芒果用2%NaClO(v/v)浸泡2min,自来水冲洗干净,晾干,用消毒的打孔器在果实的腰部打直径为5mm、深2mm的伤口。三种处理在伤口部位分别接种20μL的1×108cfu/mL B2-1菌悬液、B2-1发酵液和450mg/kg的咪酰胺,2h后再共同接种20μL的1×104cfu/mL炭疽病病原孢子菌悬液,以无菌水代替炭疽病病原孢子菌悬液做对照,28℃恒温培养,7~8d后统计并计算果实炭疽病发病率、可食用果率和病情指数[9],每个处理3个重复,每个重复30个芒果。发病率、可食用果率、病情指数的计算方法参照文献[13]。
1.4.2 芒果活体浸蘸实验 将健康七成熟的芒果用自来水冲洗干净,晾干待处理。实验分为三个处理,依次用2L、1×108cfu/mL的B2-1菌悬液、B2-1发酵液、450mg/kg的咪酰胺做浸蘸,清水浸蘸做对照,自然条件下晾干后置于28℃下恒温培养,让其自然发病,待对照炭疽病发病率达到50%后,统计各处理的发病率,可食用果率和病情指数[13],每个处理3个重复,每个重复30个芒果。
1.5 菌株鉴定
1.5.1 形态观察及部分理化特性研究 参照《常见细菌系统鉴定手册》[20]和《伯杰细菌鉴定手册》[21],进行菌落形态观察、革兰染色以及接触酶、好氧性等相关理化参数的测定。
1.5.2 16S rDNA测序 采用TIANGEN细菌基因组提取试剂盒提取菌株B2-1的基因组DNA,以基因组DNA为模板,用细菌通用引物27F/1492R进行PCR扩增16S rDNA,上游引物27F:5′-GAGAGTTTGATCCT2 GGCTCAG-3′,下游引物1492R:5′-ACGGGCGGTG2 TGTRC-3′。PCR反应条件为:94℃预变性5min;94℃变性1min、58℃退火1min、72℃延伸1.5min,共36个循环;72℃延伸10min;4℃保存。PCR扩增产物用1%琼脂糖凝胶电泳分离,PCR扩增产物经验证正确后,可以进行序列测定,序列测定由北京华大基因公司完成,然后对测序得到的16S rDNA基因序列进行Blast分析,根据Blast结果并利用MEGA4.0软件构建系统进化树[22]。
2 结果与分析
2.1 离体抑菌活性的测定
2.1.1 拮抗菌株B2-1发酵滤液对芒果炭疽菌丝的抑制作用 从表1结果得出,拮抗菌株B2-1的发酵滤液与对照相比,对芒果的炭疽菌丝的生长具有显著的抑制作用,并且发酵滤液的浓度越高抑制作用越强。当B2-1发酵滤液的浓度达到20%时,B2-1发酵滤液对芒果炭疽病菌丝的抑制率达到了84.14%,不同浓度的发酵滤液对芒果炭疽病菌丝的抑制效果差异显著(p<0.05)。

表1 拮抗细菌B2-1发酵滤液对芒果炭疽菌丝的抑制作用Table 1 Effect of antagonistic bacteria fermentation filtrates of B2-1 on mycelia growth of C.gloeosporioides
2.1.2 拮抗菌株B2-1挥发性及非挥发性代谢产物对病菌菌丝的抑制作用 从表2可以得出,无论是拮抗细菌B2-1菌株还是其发酵液的挥发性代谢产物都不同程度上对芒果炭疽病菌丝的生长具有抑制作用,其中B2-1菌株的挥发性代谢产物与对照相比对,对芒果炭疽病菌丝抑制效果明显,B2-1发酵液的挥发性代谢产物和B2-1菌株的挥发性代谢产物对芒果炭疽病菌丝生长的抑制效果差异显著(p<0.05);B2-1发酵液的非挥发性代谢产物与对照相比,对芒果炭疽病菌丝具有明显的抑制作用,抑制率达到了99.86%,具有较好的应用开发价值。

表2 拮抗细菌B2-1挥发性及非挥发性代谢产物对病菌菌丝的抑制作用Table 2 Effect of volatile metabolites or non-volatile metabolites produced by the B2-1 strain on mycelia growth of C.gloeosporioides
2.2 活体抑菌活性的测定
2.2.1 接种实验 从图1可以得出,经B2-1的发酵液和菌悬液处理的芒果与对照相比,分别使芒果的可食用果率提高了79.89%和78.31%,控制芒果发病率在32.8%和45.5%。在可食用果率这个评价指标上,B2-1发酵液处理的芒果与B2-1菌悬液处理的芒果相比,效果无显著差异。
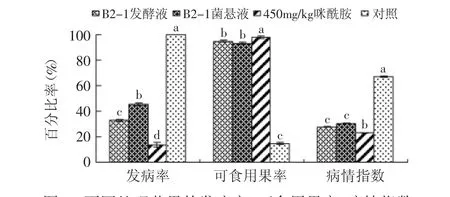
图1 不同处理芒果的发病率、可食用果率、病情指数Fig.1 Disease incidence,saleable fruit ratio and disease indexof different treatments
2.2.2 浸蘸实验 不同浸蘸处理的芒果中,发酵液浸蘸处理的芒果在各个评价指标上效果均显著优于其它处理(图2),与对照相比芒果炭疽病的发病率降低了50%。B2-1发酵液、B2-1菌悬液浸蘸处理的芒果与对照相比显著提高了芒果的可食用果率(p<0.05)。
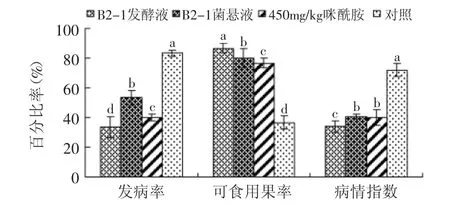
图2 不同处理芒果的发病率、可食用果率、病情指数Fig.2 Disease incidence,saleable fruit ratio and disease index of different treatments
2.3 菌种鉴定
2.3.1 B2-1菌株的形态观察及部分理化特性 B2-1菌株的菌落近似圆形,有褶皱,表面湿润,不透明。理化性状测定结果显示:B2-1菌株呈革兰氏阳性,好氧兼性厌氧菌,接触酶反应阳性,淀粉酶水解反应阳性。依据《伯杰细菌鉴定手册》,将B2-1菌株初步鉴定为芽孢杆菌属(bacillus spp.)。
2.3.2 分子鉴定 以B2-1菌株的基因组DNA为模板,用细菌通用引物进行PCR扩增,得到一条约1500bp的DNA片段,用DNA回收试剂盒回收该片段进行测序,序列长度为1424bp。序列与GenBank中16S rDNA序列进行比对,菌株B2-1的16S rDNA(1424bp)与芽孢杆菌属的枯草芽孢杆菌(bacillus subtilis)同源性高达99%。采用MEG A4.0软件,用N-J法建立系统发育树(图3),结果显示菌株B2-1与枯草芽孢杆菌在同一分支上,遗传进化距离最近。这与形态学观察以及生理特性的测定结果相一致,可确定菌株B2-1属于枯草芽孢杆菌(bacillus subtilis),命名为bacillus subtilis B2-1,B2-1的16S rDNA的序列已在Genbank中注册,序列号为JN256114。

图3 基于16S rDNA序列构建的B2-1菌株的系统进化树状图Fig.3 Phylogenetic tree of B2-1 based on sequences
3 结论与讨论
研究表明,菌株B2-1和其发酵液的挥发性代谢产物对芒果炭疽病菌菌丝有很强的抑制作用。考虑到商业应用价值,由于熏蒸操作简单,成本低,造成交叉感染的风险小,并且不会造成果实表面的物理性伤害,因此采用熏蒸的方法对采后果蔬进行保鲜处理深受欢迎,尤其在缺少浸蘸设备的发展中国家。可见,B2-1菌株的挥发性代谢产物对芒果炭疽菌菌丝的抑制作用值得进一步进行大规模的实验,确定其商业应用价值。
离体抗菌活性的测定结果表明,拮抗菌株B2-1的发酵液及其发酵液的挥发性及非挥发性代谢产物对芒果炭疽菌丝均具有明显的抑制作用,B2-1菌株发酵滤液的浓度越高抑制作用越强,发酵滤液的浓度与其对芒果炭疽菌的抑制效果在一定程度上成正相关。
拮抗菌株B2-1通过在芒果活体接种实验测试表明,经B2-1菌悬液及发酵液处理的芒果发病率明显低于对照,提高了采后芒果的可食用果率,并且B2-1发酵液浸蘸处理芒果的品质明显优于其它处理,且超过了化学试剂450mg/kg的咪酰胺的效果,这为进一步把生物防治芒果炭疽病的方法应用到实际打下了基础。
综合形态学观察和生理生化特征检测以及16S rDNA序列分析,B2-1菌株被鉴定为枯草芽孢杆菌,命名为bacillus subtilis B2-1。
本实验表明,芒果内生枯草芽孢杆菌B2-1对芒果炭疽病菌具有较强的拮抗作用,这为生物防治芒果炭疽病提供了新的资源与途径。为了保证B2-1菌株在芒果生物保鲜的过程中对人类健康不会造成危害,后续研究将进一步测定bacillus subtilis B2-1安全性,并分离纯化其抑菌组分,对其作用机制进行深入的研究和探讨。
[1]Masibo M,He Q.Major mango polyphenols and their potential significance to human health[J].Comprehensive Reviews in Food Science and Food Safety,2008,7(4):309-319.
[2]Sanders GM,Korsten L,Wehner FC.Survey of fungicide sensitivity in colletotrichum gloeosporioides from different avocado and mango production areas in south africa[J].European Journal of Plant Pathology,2000,106(8):745-752.
[3]Prusky D.Mango diseases:An overview[C].1989:279-287.
[4]Sangchote S.Postharvest diseases of mango fruits and their losses[J].Kasetsart Journal(Natural Sciences),1987(21):81-85.
[5]邓卫利,杨胜远,熊德元,等.广西芒果炭疽病菌的生物学鉴定[J].广西大学学报:自然科学版,1999,2(6):145-147.
[6]黄思良,霍秀娟,韦刚.芒果炭疽病菌Colletotrichum gloeosporioides的生物学特性[J].西南农业学报,1999,12(2):83-89.
[7]张娜,关文强,阎瑞香.芥末精油对芒果采后病原真菌抑制效果和保鲜效应的研究[J].食品工业科技,2011,32(3):349-353.
[8]弓德强,何衍彪,谷会,等.20种植物提取物对芒果炭疽病菌的抑制作用研究[J].安徽农业科学,2010(10):5149-5151.
[9]何秀娟.筛选芒果采后炭疽病和蒂腐病的生防菌研究[D].武汉:华中农业大学,2006.
[10]杨胜远,陈桂光,肖功年,等.芒果主要病原菌拮抗微生物的分离筛选[J].植物保护,2004,30(3):55-58.
[11]任建国,黄思良,晏卫红,等.拮抗微生物防治芒果炭疽病研究[J].西南农业学报,2002,15(4):82-85.
[12]Patino-Vera M,Jimenez B,Balderas K,et al.Pi-lot-scale production and liquid formulation of Rhodotorula minuta,a potential biocontrol agent of mango anthracnose[J].Applied Microbiology,2005,99(3):540-550.
[13]张诒仙.芒果炭疽病生物防治研究瓦克青霉(T-141株)的防治效果[J].世界热带农业信息,2006(4):24-25.
[14]张鲁斌,常金梅,詹儒林.芒果炭疽病拮抗菌的筛选及防治效果研究[J].热带农学,2010,30(5):12-14.
[15]张荣意,谭志琼,简日明.芒果炭疽病菌生防细菌的筛选鉴定及生防潜能的初步研究[J].热带作物学报,1998(3):21-27.
[16]胡雪芹,张洪斌,苏晓飞.西瓜枯萎病土壤拮抗茵的筛选[J].农业科学与技术,2008,9(6):132-135.
[17]黄昌华,夏文胜,郭崇明,等.B-HCH菌株的培养及代谢物的初步研究[J].中国生物防治,1996,12(1):11-14.
[18]程丽云.木霉菌(Trichoderma spp.)的种类鉴定及生防菌株的筛选[D].福州:福建农林大学,2007.
[19]何红,蔡学清,洪永聪,等.辣椒内生细菌的分离及拮抗菌的筛选[J].中国生物防治,2002,18(4):171-175.
[20]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:62-65.
[21]布坎南RE,吉本斯RE.伯杰细菌鉴定手册[M].第8版.北京:科学出版社,1984:729-731.
[22]谢洁,夏天,林立鹏,等.一株桑树内生拮抗菌的分离鉴定[J].蚕业科学,2009,35(1):121-125.
Study on antibacterial activity and identification of
an antagonistic bacterium for controlling anthracnose diseases of mango
LI Chun-ling1,WANG Qing-guo1,*,XU Li-na2,CHEN Qing-min2
(1.College of Food Science and Engineering,Shandong Agricultural University,Taian 271018,China;
2.Shandong Research Centre for Safety Engineering and Technology of Fruits and Vegetables,Jinan 251400,China)
Five antagonistic bacteria were obtained from 29 endosymbiotic bacteria.B2-1 strain was found to have the strongest antagonism to C.gloeosporioides.In vitro evaluation of antagonistic activity,whether the fermentation filtrate,volatile metabolites and non-volatile metabolites of B2-1 strain,showed a strong inhibition on the mycelia growth of C.gloeosporioides,the non-volatile metabolites of fermentation broth were able to inhibit the mycelial growth of the C.gloeosporioides by 99.86%.For further study,in vivo tests indicated that cell suspension and fermentation broth of bacteria B2-1 also significantly reduced the incidence of mango anthrax,thus showing a good potential for bio-controlling of anthracnose diseases.B2-1 was identified as bacillus subtilis by its morphological features,physiological-biochemical properties and 16S rDNA sequencing analysis.
mango;antagonisticbacteriumB2-1;Colletotrichumgloeosporioides;antibacterialactivity;identification
TS255.1
A
1002-0306(2012)11-0147-04
2011-11-21 * 通讯联系人
李春玲(1987-),女,硕士研究生,主要从事果蔬贮藏与保鲜技术。
