SNARE蛋白及其复合物在突触融合过程中的作用*
2012-10-22梁丽娟
梁丽娟,黄 薇
(天津医药集团津康制药有限公司,天津 300270)
自从SNARE蛋白被发现以后,SNAREs就作为细胞膜融合蛋白复合体的关键组分而获得普遍认同。尽管不同SNARE蛋白的基因组成序列存在差异,但是新型可设计的膜体系广泛地被应用,均涉及细胞生长、膜修复、细胞骨架动力学和突触传递等许多方面的细胞膜融合活动[1]。SNARE能够启动囊泡融合,参与蛋白质与膜转运、调节性和非调节性囊泡的胞吐活动的激活和融合过程。俄亥俄州立大学的Dennis Bong教授认为,蛋白质与膜转运等可以很好地控制化学分子释放到目标分子,可以用于与生物科技和材料科学领域[2]。SNARE蛋白具有大约60个氨基酸残基组成的细分子膜蛋白,SNARE蛋白组成了一个蛋白质超家族,在哺乳动物中超过35个。根据分布位置分为t-SNARE和v-SNARE。Rothman组和Scheller组发现syntaxin和SNAP-25具有t-SNARE的特性。而位于突触囊泡膜上的VAMPs能特异性的降解SNARE蛋白的蛋白酶[3]。VAMP、syntaxin和 SNAP-25可以分别被破伤风毒素、肉毒毒素和金属蛋白酶特异性的降解,从而不可逆地抑制突触传递。体外重构实验表明,分别含有v-SNARE和t-SNARE蛋白的脂质体能够融合。基于快速冰冻蚀刻电子显微镜技术和X-射线衍射技术证明VAMP与syntaxin和SNAP-25形成将囊泡与质膜拉近并促进囊泡融合超螺旋核心复合体。
目前认为,SNARE核心复合物是突触囊泡胞吐过程中的核心成分,而且参与几乎所有分泌细胞的胞吐过程。其由三种蛋白质组成:位于突触前膜的 t-SNARE(target-SNARE),包括syntaxin和突触小体相关蛋白(synaptosome-associated protein of 25 kD,SNAP-25);位于突触囊泡膜上的v-SNARE(vesicle-SNARE),为突触囊泡蛋白/突触囊泡相关膜蛋白vesicle-associated membrane protein,VAMP/synaptobrevin)[4]。SNARE的命名源于其最初是作为N-甲基马来酰胺敏感因子(N-ethyl-maleimide-sensitivefactor,NSF)和可溶性 NSF附着蛋白(soluble NSFattachment proteins,SNAP)的膜受体,即 SNAPs蛋白受体。Syntaxin和VAMP均通过羧基末端的跨膜区分别锚定于突触前膜和突触囊泡膜上,而SNAP-25无跨膜区,其通过其中间区4个半胱氨酸残基中的脂酰基锚定于突触前膜。目前已在哺乳动物细胞中发现30多种SNARE超家族成员,多数成员在分泌过程中都有其特异的亚细胞定位。生化研究结果显示,重组syntaxin、SNAP-25和VAMP三者结构中的仅螺旋形成区(coiled-coil domain)可形成一个稳定的核心复合物(core complex),该核心复合物可抵抗SDS的变性作用,蛋白酶的水解以及梭状芽孢杆菌神经毒素的裂解作用,其热稳定性可达到约90℃。SNARE三聚体核心复合物的亲和力很高,但核心复合物相互作用的解离常数尚未确定[5-7]。
SNARE复合物是所有膜融合过程所需的核心蛋白复合物,SNARE蛋白的作用是保证识别的特异性,并介导运输小泡与目标膜的融合。在神经系统中SNARE复合物介导神经递质囊泡在突触前膜的搭靠与融合过程,SNARE复合物的调节一直都是突触传递研究中的热点。SNAP-29被认为是一种在细胞内广泛分布的target-SNARE蛋白,参与细胞内SNARE依赖的膜的转运过程,其家族成员有 SNAP-25和SNAP-23。SNAP29在神经递质释放过程中是一个负向调节分子,其调节作用可能在于其抑制了突触囊泡(SV)融合后SNARE复合物的解聚,阻碍SNARE蛋白参与到新的囊泡融合过程中,从而减慢囊泡循环翻新效率,最终对突触传递起到抑制作用[8-10]。
1 SNARE蛋白质的结构
SNARE蛋白质的结构都具有60个氨基酸残基组成的 SNARE的模体。有 syntaxin的氨基末端域和SNAP-25的中间中榈酸酰化区域。VAMP氨基末端的富含脯氨酸域以及 syntaxin和 VAMP的跨膜区。Syntaxin的长氨基末端具有三个α-螺旋,称为Habc。Habc可以与其羧基末端SNARE模体的α-螺旋形成封闭的结构。Habc可以减少溶液中SNARE蛋白核心复合体的形成,抑制具有SNARE蛋白的脂质体的融合。Munc-18能够识别和结合 syntaxin、Habc结构域和SNARE模体α-螺旋所形成的封闭结构。当Munc-18的构象变化时,能够使 syntaxin的 Habc与其自身SNARE模体 α-螺旋解离,形成开放结构,启动SNARE蛋白的聚合物反应。因此,syntaxin的氨基末端域对囊泡激活和融合过程的调控具有重要的意义,也是SNARE蛋白之所以成为调节性胞吐过程膜融合基本分子构建的结构基础[11]。尽管SNAP-25两个α-螺旋中间的连接区域即富含半胱氨酸的中间结构域对其囊泡融合来说不是必要的,但连接区的四个半胱氨酸残基棕榈化后能够将SNAP-25结合到细胞膜上,提高了SNAP-25的局部浓度,因而形成了足够的SNARE复合物,对调节性分泌可能很重要。见图1。
2 SNARE核心复合体与囊泡激活及膜融合
囊泡胞吐过程的膜融合由SNARE蛋白质介导。在SNARE模体的介导下,各SNARE蛋白聚合形成核心复合体。溶液中游离的SNARE模体为无定型结构,当适合的SNARE模体混合在一起时就能自发地聚合形成平行排列的超螺旋束。Synaptobrevin和syntaxin具有一个SNARE模体;SNAP-25有两个SNARE模体;Synaptobrevin、syntaxin及SNAP-25按1∶1∶1的比例形成三聚体,这三类蛋白的四个SNARE模体的α-螺旋束平行排列聚合形成核心复合物。SNARE蛋白的聚合从远离膜的氨基末端开始,以闭合拉链的形式向靠近膜的羧基端发展,通过synaptobrevin及syntaxin的连接区和跨膜域的传递,是囊泡膜和靶膜变形弯曲并相互靠拢,最终促使两膜融合。此为“拉链”模型。SNARE蛋白聚合过程中,构象发生改变并且释放能量,所释放的能量用于克服囊泡膜与靶膜融合时的能量障碍。SNARE蛋白的聚合是一个可逆的过程,且存在着紧密结合和松散结合两种物理状态。紧密结合的SNARE蛋白聚合体对梭菌毒素不敏感,而结构松散结合的SNARE蛋白聚合体对梭菌毒素敏感且为可逆的结合状态。多个SNARE蛋白复合体或者SNARE蛋白多聚体与磷脂形成融合孔。然后,SNARE蛋白扩散,融合孔扩大。融合孔形成后,t-SNARE和v-SNARE插在同一膜上,成为同位 -SNARE聚合体,NSF水解cis-SNARE复合物,是各SNARE蛋白游离开来,以便SNARE蛋白的循环利用。Ca2+为囊泡融合过程的触发信号,synaptobrevin是 Ca2+感受器分子[12,13]。Ca2+、蛋白激酶、G 蛋白、Munc18 和 synaptatagmin等还可能参与对膜融合和融合孔动力学的调节。SNARE核心复合物具有15个疏水层和一个亲水层。中间层为由亲水性的3个谷氨酰胺和一个精氨酸残基组成的离子层。属于t-SNARE蛋白的 syntaxin和SNAP-25形成中间层anjisuan残基为谷氨酰胺残基,因而称为Q-SNARE;v-SNARE的synaptobrevin为精氨酸残基,也称为R-SNARE。SNARE聚合物非常稳定,能够抵抗SDS的灭活作用、蛋白酶的消化作用和神经毒素的裂解,并且有高达大约90℃的热稳定性[14-16]。因而,核心复合体的各个 SNARE模体相互作用力很强大。SNARE核心复合体的晶体结构揭示这些相互作用力,包括疏水性相互作用、氨基酸残基侧链的氢键和盐桥作用力。
3 SNARE蛋白复合体的解离
囊泡与靶膜融合后,各SNARE蛋白位于同一膜上。同位-SNARE必须解聚成为有力的单体才能用于新的囊泡激活和融合的过程,SNARE蛋白的循环利用可能是保证分泌细胞对高强度的重复刺激做出反应的重要因素之一。同位的SNARE解聚是由NSF完成。胞浆中的NSF在其适配蛋白α/β-SNAPs的协助下,水解ATP,将同位-SNARE聚合体解离。酵母的NSF/SNAPs同系物 sec18/sec17可以解聚异位 -SNARE[17,18]。
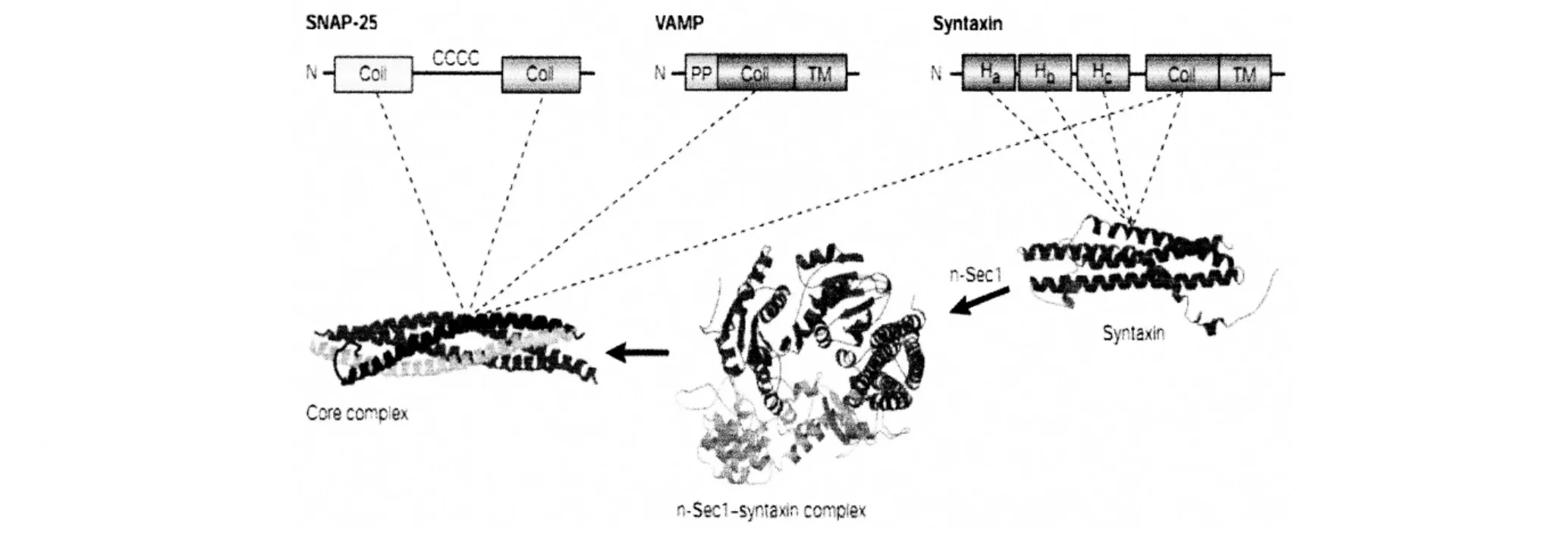
图1 SNARE主要的结构域
4 囊泡胞吐的分子机制
Syntaxin与n-sec1结合,然后形成核心复合物。Rab可能帮助Syntaxin与n-sec1的分离,便于后续的三种神经元的 SNAREs、syntaxin和 SNAP-25结合。Ca2+引发了卷曲复合物的全部拉链,这导致膜融合和囊泡的内容物释放[13]。在融合事件发生后,α-SNAP和NSF聚集,以及后续NSF水解ATP会引起SNARE的解聚。Syntaxin、VAMP和SNAP-25回收用作第二次胞吐。见图2。
5 SNARE介导的脂质融合
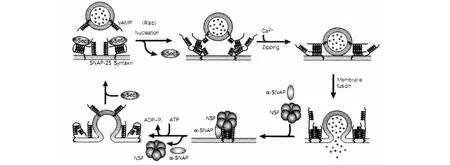
图2 囊泡胞吐的分子机制
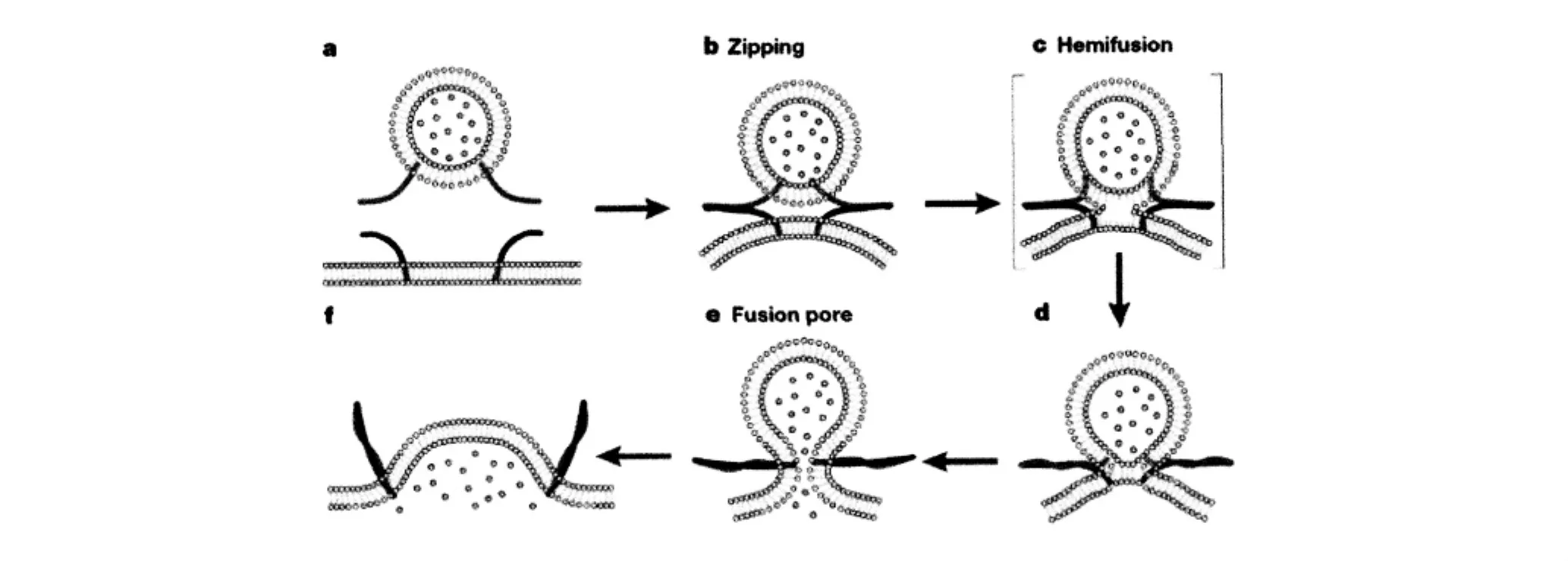
图3 SNARE介导的脂质融合
首先是囊泡膜和质膜相互靠近,但是SNARE没有接触。SNARE从氨基端启动拉链,引起两个膜靠近。拉链收紧,引膜的曲度和侧面张力增加,展现了双分子层的本质。当间距足够小时自发的半融合。侧面的张力使膜断裂,产生融合孔,融合孔扩张,膜塌陷。见图3。总之,SNARE蛋白及其复合物由其介导的运输囊泡膜与靶膜的锚靠、融合确保了各种胞内蛋白的定向运输,从而保证了细胞生命活动的正常进行;同时通过对其结构及融合解离机制的深入研究,科研工作者在生物科技、生物医药和材料科学领域会有越来越令人兴奋的发现,尤其是在现代新药研究与开发过程中,其作为靶向药物的药物靶点的探索会越来越受到科研领域的瞩目。
1 A Kashiwada,M Tsuboi,K Matsuda.Target- selective vesicle fusion induced by molecular recognition on lipid bilayers.Chem Commun,2009,6:695
2 Gong Y,Ma M,Bong D.Functional determinants of a synthetic vesicle fusion system,JAm Chem Soc,2008,130:6196
3 Sudhof,Rothman.Membrane fusion:grappling with SNARE and SM proteins.Science,2009,323:474
4 A S Lygina,K Meyenberg,R Jahn.Transmembrane Domain Peptide/Peptide Nucleic Acid Hybrid as a Model of a SNARE Protein in Vesicle Fusion.Angew Chem Int Ed,2011,50:8597
5 Karsten Meyenberg,Antonina S.SNARE derived peptide mimic inducingmembrane fusionw.Chem Commun,2011,47:9405
6 M Langer,D Langosch.Is lipid flippase activity of SNARE transmembrane domains required for membrane fusion?FEBS Letters,2011,585:1021
7 Yoon,Shin.Progress in understanding theneuronal SNARE function and its regulation.Cell Mol Life Sci,2009,66:460
8 Chen Y A,ScheUer R H.SNARE -Mediated Membrane Fusion.Nature Rev Mol Cell Biol,2001,2:98
9 Schoc h S,Deak F,Konigstorfer A.SNARE Function Analyzed in Synaptobrevin/VAMP Knockout Mice.Science,2001,294:1117
10 L V Chernomordik,M M Kozlov.Mechanics ofmembrane fusion.Nat Struct Mol Biol,2008,15:675
11 A T Brunger,K Weninger,M Bowen.Single - molecule studies of the neuronal SNARE fusion machinery.Annu Rev Biochem,2009,78:903
12 Heidelberger R,Heinemann C,Neher E.Calcium dependence of the rate of exocytosis in asynaptic terminal,Nature,1994,371:513
13 Peters C,Mayer A.Ca2+/calmodulin signals thecompletion of docking and triggers a late step of vacuolefusion.Nature,1998,396:575
14 Hu C.Fusion of cells by flipped SNAREs.Science,2003,300:1745
15 Sudhof T C,Rothman JE.Membrane fusion:Grappling with SNARE and SM proteins.Science,2009,323:474
16 Ohya T.Reconstitution of Rab-and SNARE -dependentmembrane fusionby synthetic endosomes.Nature,2009,459:1091
17 Mima J,Hickey C M,Xu H,et al.Reconstitutedmembrane fusion requiresregulatory lipids,SNAREs and synergistic SNARE chaperones.EMBO J,2008,27:203
18 Fasshauer D,Sutton R.Conserved structural features of the synaptic fusioncomplex:SNARE proteins reclassified as Q-and R-SNAREs.Proc Natl Acad,1998,95:15781
