阿魏酸酯酶和木聚糖酶协同降解麦糟
2012-10-19李夏兰程珊影杨道秀方柏山
李夏兰,程珊影,杨道秀,方柏山,2
(1华侨大学化工学院生物工程系,福建 厦门 361021;2厦门大学化学化工学院化学工程与生物工程系,福建 厦门 361005)
研究开发
阿魏酸酯酶和木聚糖酶协同降解麦糟
李夏兰1,程珊影1,杨道秀1,方柏山1,2
(1华侨大学化工学院生物工程系,福建 厦门 361021;2厦门大学化学化工学院化学工程与生物工程系,福建 厦门 361005)
橘青霉以麦糟为唯一碳源培养时,阿魏酸酯酶的最佳发酵时间为60 h,其酶活力可达40.8 mU/m L。在pH值为5.0、45 ℃、料液比1∶30(g∶m L)条件下,取47.5 U/m L的木聚糖酶粗酶液15 m L,加入1.0 g 麦糟的乙醇不溶物,反应12 h后,加入40.8 U/m L的阿魏酸酯酶粗酶液15 m L再反应12 h,阿魏酸和低聚木糖释放率分别为54.1%和161 mg/g (麦糟的乙醇不溶物)。实验结果还表明,阿魏酸酯酶与木聚糖酶存在协同作用,能极大提高麦糟中阿魏酸及低聚木糖的释放率,有利于麦糟的降解。
阿魏酸酯酶;木聚糖酶;麦糟;生物降解
已有报道表明,阿魏酸酯酶可以和其它的半纤维素酶(如木聚糖酶)协同作用使微生物对植物细胞壁进行最大程度的降解[1-3]。如Faulds等[4]报道黑曲霉分泌的阿魏酸酯酶自身也能释放FA,但同时加入木聚糖酶,其FA的释放量增加近24倍。Topakas等[5]报道,嗜热侧孢霉产生的阿魏酸酯酶StFaeC与木聚糖酶协同作用从植物纤维质中释放的FA是无木聚糖酶时的10倍。Yu等[6]报道,黑曲霉分泌的FAE单独作用燕麦壳,其FA的释放率仅为14%,但加入木聚糖酶后,FA的最高释放量可达 69%。本文报道了实验室发酵的阿魏酸酯酶(命名为PcFAE)协同木聚糖酶将麦糟中的半纤维素转化低聚木糖(xylooligosaccharide,简称 XOS),同时释放FA的结果,并初步探讨PcFAE降解麦糟(BSG)的作用机理。全面利用木质纤维素中的三大主要成分有很多报道,日前还未见有关阿魏酸酯酶和木聚糖酶协同作用降解木质纤维中的半纤维素同时产FA及XOS的报道。
1 实 验
1.1 实验器材与试剂
FA标准品、木聚糖,美国 Sigma公司;木二糖及低聚木糖标准品,日本和光纯药工业株式会社;木聚糖酶XG180,广州博士奥生化公司;其它常规试剂,均为国产或进口分析纯。BSG,福建泉州雪花啤酒厂提供。
Agilent 1100高效液相色谱仪,美国Agilent公司;SP-2000型光度计,上海光谱仪器有限公司;6890N安捷伦气相色谱仪,美国Agilent公司。
橘青霉,本实验室从土壤中筛选得到,已鉴定为橘青霉[7]。
1.2 实验方法
1.2.1 阿魏酸含量的测定
按文献[8]的方法分析。
1.2.2 酶活力的测定方法
PcFAE活力测定:以阿魏酸甲酯为底物,按文献[8]的方法测定。阿拉伯木聚糖酶活力测定:以燕麦木聚糖为底物,按文献[9]的方法测定。纤维素酶总酶活力测定:以定量滤纸为底物,按文献[10]的方法测定。阿拉伯糖糖苷酶活力测定:以对硝基苯基-α-L型阿拉伯呋喃糖为底物,按文献[11]的方法测定。
1.2.3 低聚木糖总量的测定
采用HPLC法[12]。色谱柱为Aminex HPX-42A柱,示差折光检测器。流动相为超纯水,流速 0.6 m L/min,柱温85 ℃。
1.2.4 阿魏酸释放率的测定
[13]的方法测定。阿魏酸释放率为FA的释放量占BSG中碱提取的FA总量的百分率。
1.2.5 PcFAE粗酶液的制备
PcFAE的发酵工艺见文献[8]。将产PcFAE发酵液,10 000 r/m in、4 ℃离心5 m in,得PcFAE粗酶液。
1.2.6 木聚糖酶粗酶液制备
取木聚糖酶XG180(简称XG180 )0.25 g,加入20 m L蒸馏水、40 ℃浸提1 h,过滤,稀释10倍,得木聚糖酶粗酶液。
1.2.7 麦糟的乙醇预处理
把BSG浸没在85%的乙醇中煮沸5 min冷却后过滤,重复该步骤两次。分别用无水乙醇和乙醚清洗烘干,过 50目筛,得到 BSG的乙醇不溶物(A lcohol insoluble residue of brewers’ spent grain,简称BSG-AIR)[14]。
1.2.8 预处理后BSG-AIR残渣量的测定
将酶解液10 000 r/m in、4 ℃离心5 min,蒸馏水洗涤,取残渣60 ℃干燥8 h,称重。
1.2.9 PcFAE与XG180协同酶解BSG-AIR
将1 g的BSG-AIR同时加入PcFAE粗酶液和XG180粗酶液各15 m L,在pH值5.0、45 ℃、料液比1∶30(g∶m L)条件下,酶解BSG-AIR 24 h。考察FA释放率和XOS的释放量。
1.2.10 PcFAE与XG180酶解BSG-AIR的协同方式
将PcFAE粗酶液和XG180粗酶液以不同的顺序加入,在pH值5.0、45 ℃、料液比1∶30(g∶m L)条件下酶解BSG-AIR。考察PcFAE和XG180协同方式对 FA、XOS、单糖释放量及酶解后BSG-AIR干重的影响。
1.2.11 扫描电子显微镜对 BSG-AIR纤维结构的观察
将样品烘干,均匀粘在贴有双面胶的样品台上,喷金后置于S-3500N型扫描电子显微镜下观察照相,加速电压为15 kV,放大倍数为600倍。
2 结果与讨论
2.1 发酵过程主要木质纤维降解酶的产生
橘青霉以BSG为唯一碳源,在220 r/min、28 ℃发酵5天,发酵过程中PcFAE酶、阿拉伯木聚糖酶和纤维素酶酶活力的变化情况见图1。
由图1可知,发酵液中PcFAE酶活力随时间的延长开始逐渐上升,在 60 h达到最高值,为 40.8 mU/m L,之后酶活力逐渐下降。阿拉伯木聚糖酶及纤维素酶活力与PcFAE酶活力的变化趋势一致,阿拉伯木聚糖酶在发酵24 h后酶活力逐渐上升,在96 h达到最高值,为32.0 mU/m L;纤维素酶在发酵48 h酶活力开始逐渐上升,在84 h达到最高值,为5.50 U/m L左右。

图1 PcFAE、木聚糖酶和纤维素酶活力的时间曲线
在PcFAE、阿拉伯木聚糖酶和纤维素酶这3种酶的酶活力均在达到一定值后逐渐降低,可能的原因是:一方面在发酵过程中菌体生长代谢产生甲酸、乙酸等有机酸类,抑制了酶活力;另一方面是从BSG释放得到的FA、XOS及葡萄糖等产物对酶产生反馈抑制作用,从而降低了酶活力。
日前报道的有关微生物同时分泌阿魏酸酯酶与木聚糖酶时,发酵过程中酶活力达最高的时间,阿魏酸酯酶比木聚糖酶延后一定的时间。Bartolome等[9]研究以 BSG 为唯一碳源培养除虫链霉菌(Streptomyces avermitili)时发现阿拉伯木聚糖酶的酶活力在24 h就达到最大值,而PcFAE酶活力延后24 h才到达最大值。Ferreira等[11]研究以甜菜浆为唯一碳源,培养唐德链霉菌(Streptomyces tendae)时也发现碳水化合物水解酶的酶活力在24 h达到最大值,而 PcFAE活力则在 72 h达到最大值。Panagiotou等[15]研究以BSG为唯一碳源培养巴西青霉(Penicillium brasilianum),木聚糖酶酶活力在96 h达到最高,而阿魏酸酶酶活力延后24 h。本实验结果却表明,橘青霉以 BSG为唯一碳源发酵时,PcFAE产酶最大值比阿拉伯木聚糖酶的产酶最大值提前36 h。这与文献报道的不一致。PcFAE的产酶诱导机制需深入研究。
各菌株产PcFAE的能力见文献[16-18],由于发酵培养基中使用的木质纤维不同,测定PcFAE的底物不同,很难一一比较。在所报道的43种产PcFAE的菌株,酶活力最高的是菌株黄柄曲霉(Aspergillus flavipes),其以1%玉米麸皮为碳源、28 ℃、发酵5天,其酶活力最高可达33 180 mU/m L(以阿魏酸甲酯为底物测定酶活力)[19]。最低的为Streptomyces avermitili,其以1%燕麦木聚糖为碳源,37 ℃、发酵4天,其酶活力只有1.55m U/m L(以去淀粉麦麸为底物测定酶活力)[20]。能与本文工作直接比较的,都以阿魏酸甲酯为底物测定酶活力,Bartolome等[9]研究的Streptomyces avermitili,其以1%BSG为碳源、37 ℃、发酵2天,其酶活力为82 mU/m L。Panagiotou等[21]研究以BSG为唯一碳源培养Penicillium brasilianum,其以2% BSG为碳源、30 ℃、发酵 4 天,其酶活力为 64 mU/m L)。Mandalari等[22]研究以 BSG 为唯一碳源培养Talaromyces stipitatus,其以2% BSG为碳源、37 ℃、发酵10天,其酶活力为140 mU/m L。本实验的橘青霉最高产酶酶活力为40.8 mU/m L。
2.2 粗酶液中各种木质纤维降解酶的酶活力测定结果
测定PcFAE粗酶液及XG180粗酶液中木质纤维降解酶的酶活力,结果见表1。
从表1可知,PcFAE粗酶液及XG180粗酶液中还含有一定酶活力的纤维素酶和阿拉伯糖苷酶。
2.3 PcFAE与XG180协同酶解BSG-AIR的结果
将表1中的PcFAE粗酶液及XG180粗酶液按1.2.9节步骤操作,FA及XOS的释放情况见表2。
当加入的是 PcFAE纯酶时,在 40.8 mU PcFAE/g(BSG-AIR)溶液中,不加XG180时其FA的释放量为8.30%,当同时添加47.5 U/m L XG180时,FA释放量可达20.5%,说明XG180和阿魏酯酶对FA的释放有协同作用。当加入的是PcFAE粗酶液时,在40.8 mU PcFAE/g(BSG-AIR)溶液中,加入了47.5 U/m L XG180,其FA释放率最高可达50.3%,与PcFAE纯酶相比,相应的FA释放量至少提高了1.5倍以上。这是因为PcFAE粗酶还含有其它木质纤维降解酶,加强了PcFAE的协同作用。实验还发现,若仅加XG180酶解BSG-AIR,而不添加PcFAE纯酶或PcFAE粗酶液,其FA释放率仅为1.45%,这表明,PcFAE是降解BSG-AIR释放FA的关键酶。

表1 粗酶液中各种木质纤维降解酶的酶活力

表2 PcFAE添加或不添加XG180酶解BSG-AIR时FA及XOS释放
Faulds等[23-24]报道了阿魏酸低聚糖中 FA释放率与FA与单糖的连结方式、单糖的种类及阿魏酸低聚糖长度大小有关,因此选择合适的阿魏酸酯酶种类及木聚糖酶种类是提高木质纤维降解率的关键。Faulds等报道3种不同类型的阿魏酸酯酶(分别属于A、B、C类)与不同家族的木聚糖酶作用,结果表明不同种类的阿魏酸酯酶、不同家族的木聚糖酶及细胞壁材料(麸皮、BSG)不同、FA释放率不同;经纯化的阿魏酸酯酶与木聚糖酶协同作用时,BSG的FA释放率最高为26%;其实验结果还表明,与阿魏酸酯酶作用时,11家族的木聚糖酶更倾向于释放FA,而10家族的木聚糖酶更倾向于释放双阿魏酸[25]。从表2可知,本实验经纯化的阿魏酸酯酶与木聚糖酶协同作用时,FA的释放率最高为20.5%,与Faulds等[25]研究结果相比,其FA释放率相对较小。这是因为阿魏酸酯酶种类不同,作用的底物不同,阿魏酸酯酶表现出的活性就不同,如阿魏酸酯酶A类,不能作用于与阿拉伯糖2-O连接的阿魏酸酯键,而阿魏酸酯酶B类,却有效地作用于与阿拉伯糖2-O连接的阿魏酸酯键[26-27]。本研究中所用的木聚糖酶为11家族,PcFAE也初步推定为A类[8],麦糟中的阿拉伯糖2-O连接的阿魏酸酯酶存在较多[25],因此其FA的释放率相对较低。
从表2可知,当加入的是PcFAE纯酶时,若不添加 XG180,释放的 XOS量很小,为 1.2 mg/g(BSG-AIR)。说明PcFAE不是释放XOS的关键酶;当添加XG180,XOS增加到22.3 mg/g(BSG-AIR),说明木聚糖酶与PcFAE有协同作用,有利于XOS的释放。当加入的是PcFAE粗酶液时,释放的XOS量为12.9 mg/g(BSG-AIR),与仅加PcFAE纯酶相比较大,这是因为pcFAE粗酶液已含有一定酶活力的木聚糖。当同时添加XG180,释放的XOS量为158 mg/g(BSG-AIR)。
XOS的释放量与所采用的木质纤维降解酶种类、阿拉伯木聚糖主链上的取代基团及取代密度,尤其是FA在阿拉伯木聚糖主链上的取代位置及密度有关[28-30]。因为 FA在木聚糖上的取代,使得木聚糖形成有柔性而不是刚性的结构,易于木质纤维降解酶的进攻[31]。但有关木质纤维结构与木质纤维降解酶的相互关系的生物信息学的报道非常少。
2.4 木聚糖酶添加方式对FA和XOS释放量的影响效果
在pH值5.0、45 ℃、料液比1∶30(g∶m L)条件下,将40.8 mU/m L的PcFAE粗酶液和47.5 U/m L的XG180粗酶液(各酶活力见表1)以不同的方式加入,探讨木聚糖酶与PcFAE的加入方式对BSG-AIR中FA和XOS释放量的影响,实验结果见图2~图7。
图2~图7横坐标的数字代表了下面不同的具体实验方案。
(1)方案1 取PcFAE粗酶液15 m L,加入1.0 g BSG-AIR,反应12 h后,加入15 m L pH值为5.0的缓冲液再反应12 h。

图2 协同作用方式对FA释放量的影响
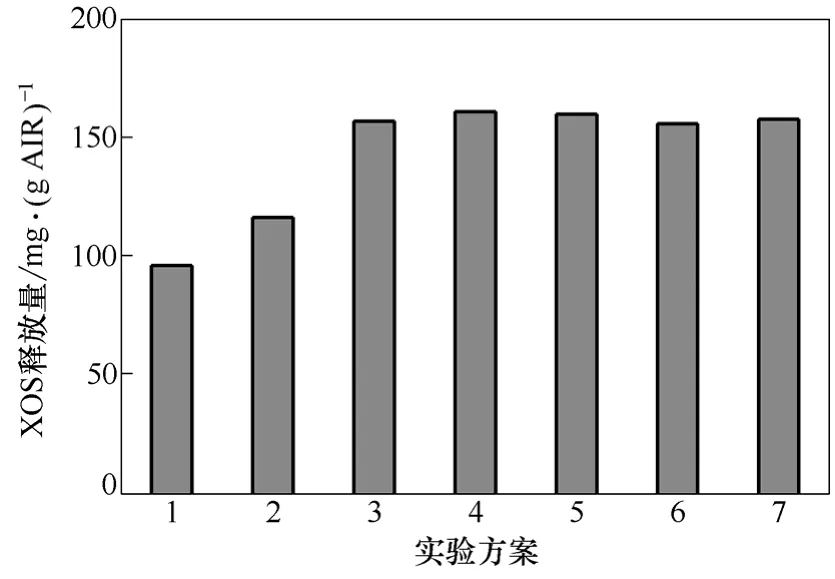
图3 协同作用方式对XOS释放量的影响

图4 协同作用方式对木糖释放量的影响

图5 协同作用方式对阿拉伯糖释放量的影响

图6 协同作用方式对葡萄糖释放量的影响
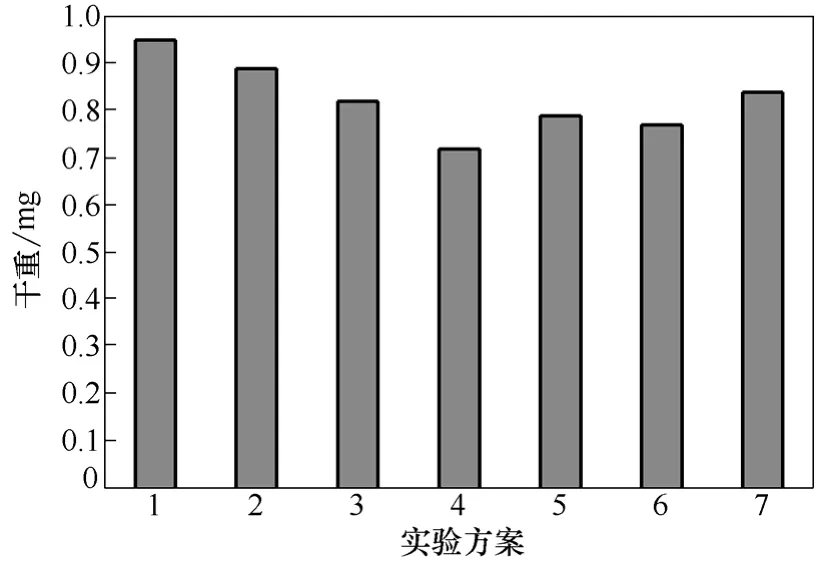
图7 协同作用方式对酶解后BSG-AIR干重的影响
(2)方案2 取XG180粗酶液15 m L,加入1.0 g BSG-AIR,反应12 h后,加入15 m L pH值为5.0的缓冲液再反应12 h。
(3)方案3 取PcFAE粗酶液15 m L,加入1.0 g BSG-AIR,反应12 h后,加入XG180粗酶液15 m L再反应12 h。
(4)方案4 取XG180粗酶液15 m L,加入1.0 g BSG-AIR,反应12 h后,加入PcFAE粗酶液15 m L再反应12 h。
(5)方案5 取PcFAE粗酶液7.5 m L,加入1.0 g BSG-AIR反应6 h,加入XG180粗酶液7.5 m L反应6 h,再加入PcFAE液7.5 m L反应6 h,最后加XG180液7.5m L反应6 h。
(6)方案6 取XG180粗酶液7.5 m L,加入1.0 g BSG-AIR反应6 h,加入PcFAE粗酶液7.5 m L反应6 h,再加入XG180粗酶液7.5 m L反应6 h,最后加PcFAE粗酶液7.5 m L再反应6 h。
(7)方案7 取PcFAE粗酶液15 m L,同时加入XG180粗酶液15 m L,加入1.0 g BSG-AIR,反应24 h。
从图2可知,只要加入PcFAE,就有FA释放。方案2未加入PcFAE,FA释放量为0。酶的添加顺序以方案4降解BSG-AIR释放FA的量最多,可达0.97 mg/g(BSG-AIR),对应的FA释放量为54.1%,方案6次之,说明在协同作用过程中先加入XG180,反应一定时间后再加入PcFAE时,BSG-AIR释放FA和XOS的协同效果相对较好。通过木糖和阿拉伯糖的释放情况(图4、图5)也进一步说明BSG-AIR中的半纤维素在第4组的协同作用方式下得到了较好的降解。
从图3可知,未加PcFAE的第1组XOS的释放量最小,尽管第 1组没有添加 XG180,但是因PcFAE粗酶液中存在木聚糖酶,仍有少量的的XOS的释放,其它组的XOS释放量几乎相同,第4组XOS释放量相对最大,为161 mg/g(BSG-AIR)。说明PcFAE可增强XOS的释放量,有利于BSG-AIR中半纤维素的降解,加入顺序对 XOS释放量影响较小。从图4、图5可知,6种酶加入方式,都有阿拉伯糖及木糖的释放,也进一步说明 PcFAE及XG180含有阿拉伯糖苷酶和木糖苷酶,能降解半纤维素中木聚糖的糖苷键或与木聚糖连结的阿拉伯糖苷键。第4组加入方式,木糖及阿拉伯糖释放量相对最大,这是因为第4组加入方式是先加入木聚糖酶,半纤维素已有一定的初步降解,酶的空间位阻相对最小。比较第4组和第6组的加入方式,其FA、单糖和 XOS的释放量都几乎相同,这说明影响木质纤维降解的是其空间结构,而非酶的失活,这与Faulds等[32]的研究结果一致。
从图6可知,6种酶的加入方式,葡萄糖的释放量都极小,说明木质素、半纤维素对纤维素的保护作用还未完全解除。
比较6种添加酶的方式,都表明先加入XG180而后加入PcFAE更有利于BSG-AIR的降解。图7表明第4组加入方式所得的酶解后的BSG-AIR残渣的干重最小,间接说明 BSG-AIR木质纤维降解程度最大。本实验结果可推测,木聚糖酶是先水解半纤维素中的木聚糖主链断裂成小分子的片断,降低了PcFAE的空间位阻,PcFAE才进行酯解。
Bartolome等[4,33]研究表明,从复杂的植物细胞壁中释放出FA可能有两步骤:第一步为特定的细胞壁降解酶(如木聚糖酶)将细胞壁中的半纤维素降解为分子量相对较小的阿魏酸寡聚多糖,改变细胞壁的物理化学性质;第二步为PcFAE作用于在阿魏酸寡聚多糖,使FA释放。本实验的结果也证明这一结论。

图8 BSG-AIR结构的扫描电镜图(×600)
从图2和图3可知,在pH值为5.0、45 ℃下,取47.5 U/m L的XG180粗酶液15 m L,加入1.0 g BSG-AIR,反应12 h后,加入40.8 mU/m L的PcFAE粗酶液15 m L再反应12 h,酶解BSG-AIR的效果最好,FA释放量为0.97 mg/g(BSG-AIR)(FA释放率为 54.1%),XOS的释放量为 161 mg/g(BSG-AIR)。Faulds等[34]将1 kg的去淀粉麦麸加入10 L的水,加入总单位为105U木聚糖酶,37 ℃反应16 h,再加入PcFAE17 U,37 ℃再反应16 h,得到5.7 g的FA,麦麸的FA释放率为57%。本实验结果与之相近。
2.5 BSG-AIR酶解前后结构的变化
BSG-AIR酶解前后显微结构图,见图8。
由图8可见,未经过酶降解的BSG-AIR表面比较光滑,质地紧密[图8(a)];经过PcFAE液降解后的BSG-AIR表面出现较深的凹痕[图8(b)];经过XG180降解后的 BSG-AIR 与未经酶处理的BSG-AIR相比,表面得多一些破坏但效果不明显[图8(c)];而经过PcFAE液和XG180协同降解后的 BSG-AIR横断面均出现了明显的断裂和破损[图8(d)]。实验表明BSG-AIR的三维网状结构在PcFAE粗酶液和XG180酶液的协同作用下得到了一定程度的破坏。
3 结 论
(1)橘青霉以BSG为唯一碳源培养时,PcFAE最佳发酵时间为60 h,其酶活力为40.8 mU/m L,而阿拉伯木聚糖酶最佳发酵时间为96 h,其酶活力为32 mU/m L。PcFAE产酶最大值比阿拉伯木聚糖酶的产酶最大值提前36 h。
(2)在pH值为5.0、45 ℃、料液比1∶30(g∶m L)条件下,取47.5 U/m L的XG180粗酶液15 m L,加入1.0 g BSG-AIR,反应12 h后,加入40.8 U/m L的PcFAE粗酶液15 m L再反应12 h,酶解BSG-AIR的效果最好,FA的释放量为0.97 mg/g(BSG-AIR)(FA的释放量为54.1%),XOS的释放量为161 mg/g(BSG-AIR)。
参 考 文 献
[1] Shin H,Chen R. Production and characterization of a type B feruloyl esterase fromFusarium proliferatum NRRL26517[J].Enzyme.Microb. Technol.,2006,38(3-4):478-485.
[2] Moure A,Gullon P,Dom inguez H,et al. Advances in the manufacture,purification and applications of xylo-oligosaccharides as food additives and nutraceuticals[J].Process Biochem.,2006,41(9):1913-1923.
[3] Faulds C B,Sancho A,Bartolom B. Mono-and dimeric ferulic acid release from brewer’s spent grain by fungal feruloyl esterases[J].Appl. Microbiol. Biot.,2002,60(4):489-494.
[4] Faulds C B,Williamson G. Release of ferulic acid from wheat bran by a ferulic acid esterase(FAE-III)fromAspergillus niger[J].Appl. Microbiol. Biot.,1995,43(6):1082-1087.
[5] Topakas E,Vafiadi C,Stamatis H,et al.Sporotrichum thermophiletype C feruloyl esterase(StFaeC):Purification,characterization,and its use for phenolic acid(sugar)ester synthesis[J].Enzyme. Microb. Tech.,2005,36(5-6):729-736.
[6] Yu P,Maenz D,M cKinnon J,et al. Enzym ic release of ferulic acid from oat hulls byAspergillusferulic acid esterase[J].Can. J. Anim. Sci.,2000,80:776-777.
[7] 李夏兰,胡雪松,范韵敏,等. 一株产阿魏酸酯酶青霉菌株的筛选、鉴定及生长特征[J]. 微生物学通报,2010,37(11):1588-1593.
[8] 李夏兰,范韵敏,方柏山. 来自桔青霉的阿魏酸酯酶的分离纯化、理化性质[J]. 微生物学报,2010,50(8):1058-1064.
[9] Bartolome B,Gomes-sordoves C,Sancho A I,et al. Grow th and release of hydroxycinnam ic acids from Brewer's spent grain byStreptomyces avermitilis CECT3339[J].Enzyme. Microb. Tech.,2003,32(1):140-144.
[10] 刘德海,杨玉华,安明理. 纤维素酶酶活的测定方法[J]. 中国饲料,2002,17:27-28.
[11] Ferreira P,Diez N,Faulds C B,et al. Release of ferulic acid and feruloylated oligosaccharides from sugar beet pulp byStreptomyces tendae[J].Bioresource Technol.,2007,98(8):1522-1528.
[12] 张晓萍. 低聚木糖各组分高效液相分析方程的建立及应用[D]. 南京:南京林业大学,2006.
[13] Bartolome B, Santos M,Jimenez J,et al. Pentoses and hydroxycinnam ic acids in brewer’s spent grain[J].J. Cereal. Sci.,2002,36(1):51-58.
[14] Waldron K,Selvendran R. Composition of the cell walls of different asparagus(Asparagus officinalis)tissues[J].Physiol Plantarum,1990,80(4):568-575.
[15] Panagiotou G,Olavarria R,Olsson L. Penicillium brasilianum as an enzyme factory;The essential role of feruloyl esterases for the hydrolysis of the plant cell wall[J].J. Biotechnol.,2007,130(3):219-228.
[16] Benoit I,Danchin E,Bleichrodt R,et al. Biotechnological applications and potential of fungal feruloyl esterases based on prevalence,classification and biochem ical diversity[J].Biotechnol. Lett.,2008,30(3):387-396.
[17] Wong D W. Feru loy l esterase:A key enzym e in biomass degradation[J].Appl. Biochem. Biotechnol.,2006,133(2):87-112.
[18] Fazary A,Ju Y. Feruloyl esterases as biotechnological tools:Current and future perspectives[J].Acta Bioch. Bioph. Sin.,2007,39(11):811-828.
[19] Mathew S,Abraham T. Studies on the production of feruloyl esterase from cereal brans and sugar cane bagasse by m icrobial fermentation[J].Enzyme.Microb.Tech.,2005,36(4):565-570.
[20] Garcia B,Ball A,Rodriguez J,et al. Induction of ferulic acid esterase and xylanase activities inStreptomyces avermitilisUAH30[J].Fems.Microbiol. Lett.,1998,158(1):95-99.
[21] M cAuley K,Svendsen A,Patkar S,et al. Structure of a feruloyl esterase fromAspergillus niger[J].Acta Crystallogr D,2004,60(5):878-887.
[22] Mandalari G,Bisignano G,Lo Curto R,et al. Production of feruloyl esterases and xylanases byTalaromyces stipitatusandHumicola grisea var. thermoideaon industrial food processing by-products[J].Bioresource Technol.,2008,99(11):5130-5133.
[23] Faulds C B,Kroon P,Saulnier L,et al. Release of ferulic acid from maize bran and derived oligosaccharides byAspergillus nigeresterases[J].Carbohyd.Polym.,1995,27(3):187-190.
[24] Faulds C B,Ralet M,Williamson G,et al. Specificity of an esterase(XYLD)fromPseudomonas fluorescenssubsp. cellulosa[J].Bba-Gen.Subjects,1995,1243(2):265-269.
[25] Faulds C B,Zanichelli D,Crepin V F,et al. Specificity of feruloyl esterases for water-extractable and water-unextractable feruloylated polysaccharides:Influence of xylanase[J].J. Cereal. Sci.,2003,38(3):281-288.
[26] Topakas E,Vafiadi C,Christakopoulos P. M icrobial production,characterization and applications of feruloyl esterases[J].Process Biochem.,2007,42(4):497-509.
[27] Williamson G,Kroon P,Faulds C B. Hairy plant polysaccharides:A close shave w ith m icrobial esterases[J].Microbiology,1998,144(8):2011-2023.
[28] Debeire P,Priem B,Strecker G,et al. Purification and properties of an endo-1,4-xy lanase excreted by a hydrolytic thermophilic anaerobe,clostridium thermolacticum——A proposal for its action mechanism on larchw ood 4-O-methy lg lucuronoxy lan[J].Eur.J.Biochem.,1990,187(3):573-580.
[29] Liab K,Azadi P,Collins R,et al. Relationships between activities of xylanases and xylan structures[J].Enzyme.M icrob.Tech.,2000,27(1-2):89-94.
[30] Beaugrand J,Cronier D,Debeire P,et al. Arabinoxylan and hydroxycinnamate content of wheat bran in relation to endoxylanase susceptibility[J].J. Cereal. Sci.,2004,40(3):223-230.
[31] Dervilly-Pinel G,Thibault J,Saulnier L. Experimental evidence for a sem i-flexible conformation for arabinoxylans[J].Carbohyd. Res.,2001,330(3):365-372.
[32] Faulds C B,Mandalari G,LoCurto R,et al. Arabinoxylan and mono-and dimeric ferulic acid release from brewery’s grain and wheat bran by feruloyl esterases and glycosyl hydrolases fromHumicola insolens[J].Appl. Microbiol. Biotechnol.,2004,64(5):644-650.
[33] Bartolome B,Faulds C B,Tuohy M,et al. Influence of different xylanases on the activity of ferulic acid esterase on wheat bran[J].Biotechnol. Appl. Bioc.,1995,22(1):65-73.
[34] Faulds C B,Bartolome B,W illiamson G. Novel biotransformations of agro-industrial cereal waste by ferulic acid esterases[J].Ind. Crop. Prod.,1997,6(3-4):367-374.
Utilization of feruloyl esterase and xylanase for the degradation of brewers’spent grain
LI Xialan1,CHENG Shanying1,YANG Daoxiu1,FANG Baishan1,2(1Department of Chemical and Biochemical Engineering,Institute of Chemical Technology,Huaqiao University,Xiamen 362021,Fujian,China;2Department of Chem ical and Biochem ical Engineering,College of Chem istry and Chem ical Engineering,Xiamen University,Xiamen 361005,Fujian,China)
The optimal fermentation time ofPenicillium citrinumferuloyl esterase(PcFAE)was 60 h and its activity was 40.8 mU/m L when the Brewers’ Spent Grain(BSG)was used as the sole carbon source forPenicillium citrinum. One gram of alcohol-insoluble residue(AIR)of Brewers’spent grain(BSG)was processed by the solution of crude xylanase(XG180)(47.5 U/m L,15 m L)for 12 hours at the condition of the material-liquid ratio 1∶30(W/V),pH 5.0 and 45 ℃,respectively. And then the solution of crude PcFAE(40.8 mU/m L)was added and the sample was processed for another 12 h. The maximum release rate of Ferulic acid(FA)was 54.1% and the release amount of xylooligosaccharide(XOS)was 161 mg/g(BSG-AIR),respectively. The results of our experiments showed that the release rate of FA and XOS from BSG-AIR increased significantly as the PcFAE could coordinate w ith the xylanase and enzymolysis process was also conducive to the degradation of BSG.
feruloyl esterases;xylanase;brewers’ spent grain;biodegradation
TQ 353.9
A
1000–6613(2012)05–1096–08
2011-11-16;修改稿日期:2011-12-15。
华侨大学人才启动基金(11BS221)及福建省科技重点项目(2011N0020)。
李夏兰(1965—),女,博士,研究方向为生物化工。E-mail xialan@hqu.edu.cn。联系人:方柏山,教授,博士生导师。E-mail fbs@xmu.edu.cn。
