日本薯蓣的组培快繁及块茎诱导
2012-10-17李飞飞黄佳斌鲍思伟
李飞飞,黄佳斌,陈 珍,陈 彤,鲍思伟
(台州学院 生命科学学院,浙江 台州 318000)
日本薯蓣(Dioscorea japonica Thunb.)别名尖叶薯蓣,又名野山药,根茎中提取的薯蓣皂甙元(通称薯蓣皂素)是合成性激素和甾体类激素的重要原料,广泛用于治疗癌症、心脑血管疾病、呼吸道疾病等,也可作为避孕药物等[1,2]。日本薯蓣生长于向阳山坡的灌丛中或林下,分布于西南、华南、华中、华东各地。由于薯蓣属植物的药用价值高,在医药生产过程中原料需求量大而导致过度采挖,以致野生资源濒临枯竭。薯蓣地下根茎的自然恢复需要3~5年,且其种子的萌发比较困难,在自然状况下仅1%左右的种子能够成苗,生产原料的供需矛盾十分突出[3-5]。利用植物组织培养技术实现日本薯蓣的快速繁殖,有望解决上述问题。作者调查发现,日本薯蓣在浙江台州的天台、临海等县市的山区有广泛分布。为开发利用本地中药材资源,我们开展了日本薯蓣的组培快繁研究。
1 材料与方法
1.1 试验材料
日本薯蓣(Dioscorea japonica Thunb.)采自浙江省天台县华顶山。
1.2 实验方法
1.2.1 材料的消毒
春季,剪取日本薯蓣当年生植株,用洗洁精清洗后流水冲洗约30 min。转置超净工作台进行植株表面消毒,75%酒精漂洗30 s,无菌水冲洗3~4次,再投入到0.1%升汞溶液中浸泡10 min,无菌水冲洗4~5次,切取带节茎段为外植体,接种至各种固体培养基上(添加活性炭0.15%,蔗糖3%)(表1)。
1.2.2 块茎诱导
切取单个芽接种至附加细胞分裂素6-苄氨基腺嘌呤 (6-BA)1.0 mg/L和生长素α-萘乙酸(NAA)0.1 mg/L及活性炭(AC)0.15%与蔗糖3%的MS基本培养基中,观察根和块茎的诱导情况。
2 结果与分析
2.1 不同激素组合对日本薯蓣不定芽诱导和增殖的影响
将日本薯蓣的无菌带节茎段接种于表1所列的培养基中,5~6 d后能看到芽点萌动,10 d后能明显看出所选培养基均可诱导腋芽的萌发,14 d后在不同培养基中的外植体长势逐渐出现差异,20 d后外植体在含有激素的培养基中形成丛生芽(图1)。统计结果表明,细胞分裂素6-BA浓度在1.0~2.0 mg/L,生长素NAA浓度在0.2~1.0 mg/L时,均能诱导丛生芽,叶片颜色浓绿,苗健壮。当NAA浓度相同时,芽萌发数随着6-BA浓度的升高而增多,但芽萌动时间相对较迟;当6-BA浓度都为2.0 mg/L时,NAA为0.5 mg/L芽的诱导率和增殖率都最高。因此可选用MS+6-BA 2.0 mg/L+NAA 0.5 mg/L+AC 0.15%为日本薯蓣不定芽诱导和增殖培养基。
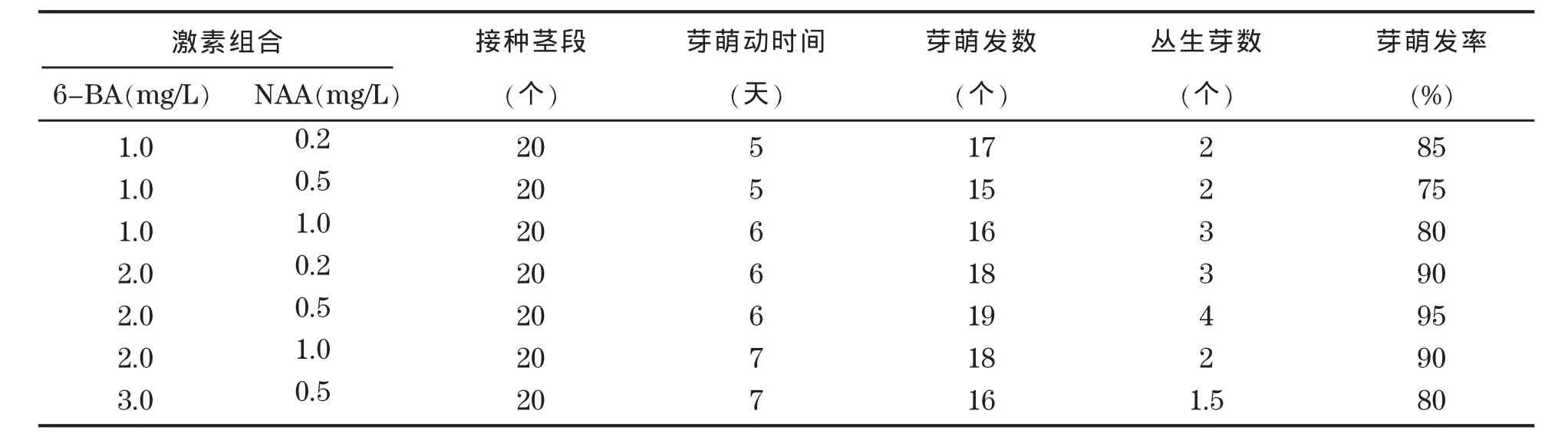
表1 不同浓度6-BA和NAA对日本薯蓣不定芽诱导和增殖的影响Table 1 Effects of different concentrations of 6-BA and NAA on the induction and multiplication of bud of Dioscorea japonica

图2 日本薯蓣的生根培养Fig.2 Formation of adventitious root of Dioscorea japonica
2.2 日本薯蓣根和块茎的诱导
切取丛生芽接种至MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+AC0.15%的培养基中,半个月后可诱导生根(图2)。继续培养至2~3个月,靠近培养基的节间也生出不定根,同时在基部诱导形成块茎(图3和图4)。

图3 日本薯蓣的生长和块茎的诱导Fig.3 Growth and tuber induction of Dioscorea japonica
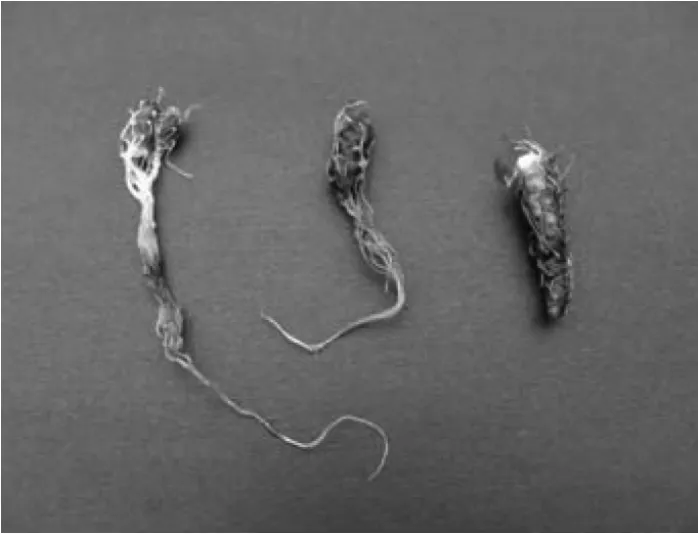
图4 日本薯蓣组培条件下诱导的块茎Fig.4 Tuber of Dioscorea japonica from tissue culture
3 小结与讨论
薯蓣是重要的经济植物,所含薯蓣皂甙元具有较高的开发利用价值,被广泛用于医药、食品和卫生保健等方面。随着甾体激素类药物的广泛应用,国内外市场对薯蓣皂素的需求量不断增加,薯蓣市场的供需矛盾十分突出。一些重要薯蓣,如穿龙薯蓣、菊叶薯蓣、盾叶薯蓣等,通过叶片、叶柄、茎段、胚乳等外植体进行的组织培养已经繁殖成功[6-10],但日本薯蓣的离体快繁及微块茎的诱导还有待研究。为更好地开发利用本地中药材,本研究小组选择日本薯蓣的叶片和叶柄成功诱导了愈伤组织,不定芽的分化还在继续研究中。
茎段外植体较易诱导腋芽的萌发和不定芽的增殖。黄凤翔等[11]的研究结果表明,与6-BA相比,6-糠氨基嘌呤(激动素,KT)对菊叶薯蓣外植体诱导效果较差。因此本文以细胞分裂素6-BA和生长素NAA的组合来试验其对日本薯蓣不定芽形成与增殖的影响,结果表明低浓度的6-BA能启动不定芽的形成,但增殖系数不高;随着其浓度的增加,丛生芽系数增加;但浓度过高则又抑制芽的增殖和茎叶的生长。这与李光明和刘文海[5]、黄凤翔等[11]和陈凤清等[12]在盾叶薯蓣、菊叶薯蓣和穿龙薯蓣等的组培快繁优化研究时的发现均一致。生长素浓度过高容易导致细胞和液泡较大而不利再生苗的诱导[12]。本实验也观察到中低浓度的NAA更适合日本薯蓣丛生芽的生长。活性炭能吸附培养基中的有害物质,包括琼脂中的杂质、培养物分泌的酚、醌类物质以及蔗糖在高压消毒时产生的5-羟甲基糠醛等,从而有利于外植体的生长。我们在研究中发现活性炭的添加有利于薯蓣不定芽的增殖和块茎的诱导。
同时我们首次在实验中获得了微块茎,为实验室内大量繁殖日本薯蓣块茎奠定了基础。研究表明调节激素种类和比例、提高蔗糖含量、改变光照、添加矮壮素(CCC)或者多效唑(PP333)等均可提高薯蓣、半夏等块茎或试管姜及试管薯的产量[13-16]。进一步试验日本薯蓣块茎诱导的最佳条件,可缩短诱导时间和提高产量和质量。
[1]蒋玉宝,于元杰.薯蓣植物组织培养的研究进展[J].生物技术,2006,16(4):93-97.
[2]龙雯虹,郭华春,高星,等.3种薯蓣属植物珠芽糖类含量变化与茎叶生长的关系[J].西北植物学报,2009,29(6):1187-1192.
[3]王军,张金莲,李少峰等.盾叶薯蓣组培诱导分化实验研究[J].云南农业科技,2006,3:23-24.
[4]黄涛,张友德,张君芝等.温度、光照和几种药剂对黄姜种子萌发的影响[J].华中农业大学学报,1999,18:83-83.
[5]李光明,刘文海.盾叶薯蓣组织培养快速繁殖技术的优化研究[J].湘潭师范学院学报,2005,27(4):45-48.
[6]Alizadeh S, Mantell S H, Viana A M.In vitro shoot culture and microtuber induction in the steroid yam Dioscorea composita Hemsl[J].Plant Cell,Tissue and Organ Culture, 1998, 53:107-112.
[7]Ozel C A, Khawar K M, Mirici S, et al.Factors affecting in vitro plant regeneration of the critically endangered Mediterranean knapweed (Centaurea tchihatcheffii Fisch et.Mey) [J].Naturwissenschaften,2006, 93(10):511-517.
[8]罗凤霞,祝朋芳,周广柱,等.穿龙薯蓣的组织培养与快速繁殖[J].植物生理学通讯,2004,40(3):329.
[9]李国林,杜晓英,付艳华,等.菊叶薯蓣的快速繁殖研究[J].氨基酸和生物资源,2004,26(4):20-22.
[10]郭永兵,江道菊,李特林.盾叶薯蓣胚乳的组织培养[J].北方园艺,2007,(10):175-177.
[11]黄凤翔,管艳,梁国平,等.不同植物激素用量对菊叶薯蓣组织培养的影响[J].热带农业科技,2007,30(2):21-23.
[12]陈凤清,付杨,孙冬雪,等.穿龙薯蓣的微块茎离体诱导及再生植株的建立[J].东北师范大学报自然科学版,2005,37(4):90-93.
[13]张宗勤,撒文清,刘建才.叉蕊薯蓣的微繁殖及微型薯蓣的离体诱导[J].生物技术,1998,8(1):18-20.
[14]张爱民,杨生玉,薛建平,等.多种因素对半夏外植体直接诱导形成试管小块茎的影响[J].中国中药杂志,2005,30(8):576-578.
[15]薛建平,黄月琴,张爱民. 怀姜试管姜诱导技术的研究[J].中国中药杂志,2007,32(16):1621-1624.
[16]宁志珩,吕国华,贾晓鹰. 脱毒马铃薯试管薯诱导技术探索[J].中国马铃薯,2007,21(1):33-38.
