Tau蛋白表达与ER阳性乳腺癌紫杉类化疗敏感性的临床分析
2012-10-17李志华涂剑宏雷秋模魏文嵩罗永辉
李志华 涂剑宏 龚 宇 雷秋模 魏文嵩 罗永辉
1.南昌市第三医院乳腺疾病诊疗中心,江西南昌 330009;2.南昌市第三医院病理科,江西南昌 330009
紫杉醇是一种新型化疗药物,其通过干扰有丝分裂和分裂间期细胞功能所必需的微管网络而起到抗肿瘤作用。90年代以后,紫杉类化疗药物逐步在临床应用于乳腺癌的全身化疗,取得较好疗效,但仍存在部分乳腺癌的紫杉类化疗耐药,影响肿瘤患者的总体疗效。本研究选择我院2007年4月~2010年10月200例采用紫杉类联合新辅助化疗的乳腺癌患者,分析乳腺癌组织Tau蛋白表达与新辅助化疗疗效的关系,探讨Tau蛋白对乳腺癌紫杉醇类化疗疗效的预测价值,为科学选择紫杉醇类化疗方案治疗乳腺癌提供依据,提高乳腺癌患者的整体治疗疗效。现报道如下:
1 资料与方法
1.1 一般资料
2007年4月~2010年10月南昌市第三医院共收治采用紫杉醇类方案进行新辅助化疗方案(NAC)的乳腺癌女性患者 200 例,年龄 24~76 岁,平均(46.8±8.82)岁;TNM 分期:Ⅱb期112例,Ⅲa期53例,Ⅲb期20例,Ⅲc期13例;病理类型:浸润性导管癌163例,浸润性小叶癌11例,混合病理类型10例,其他类型12例;手术方式:保乳术13例,改良根治术Auchincloss 48例,Patey 111例,传统根治术28例。
1.2 新辅助化疗方案NAC
所有患者经系统检查均未发现有远处转移。化疗前均经粗针穿刺活检确诊为乳腺浸润性癌。所有乳腺癌患者NAC均为3个周期,NAC方案包括:CET方案(179例):环磷酰胺(CTX)500 mg/m2+表阿霉素(EPI)75 mg/m2+多西他赛(DOC)75 mg/m2,静点,第 1 天,21 d/周期;CEP 方案(21 例):环磷酰胺(CTX)500 mg/m2+表阿霉素(EPI)75 mg/m2+紫杉醇脂质体(P)150 mg/m2,静点,第 1 天,21 d/周期;化疗药物:环磷酰胺(CTX,江苏恒瑞医药公司),表阿霉素(法玛新,辉瑞制药无锡公司),多西他赛(希存,深圳万乐药业),紫杉醇脂质体(力朴素,南京思科药业有限公司)。
1.3 临床疗效评判
NAC前后采用临床体检和彩超评判肿块最大径的变化,疗效按WHO制订的统一标准划分。完全缓解(CR):可见的病变完全消失,包括腋窝淋巴结;部分缓解(PR):肿块缩小50%以上;稳定(SD):肿块缩小不及50%或增大未超过25%;进展(PD):一个或多个病变增大25%以上或出现新病变。以CR+PR为有效,SD+PD为无效。
1.4 病理疗效评价
根据Miller-Payne病理反应性分级标准[1],将术后病理切片和化疗前穿刺组织学切片对比,比较镜下肿瘤细胞的退缩情况,病理学反应性分5级。G1级:肿瘤细胞较前无变化;G2级:肿瘤细胞密度减少小于30%;G3级:肿瘤细胞密度减少31%~90%;G4级:大量肿瘤细胞减少91%以上;G5级:肿瘤完全消失,镜下未见浸润癌残留(可含有原位癌)。G5级为病理完全缓解(PCR)。
1.5 Tau蛋白及ER的检测及评价标准
采用Elivison二步法免疫组化检测Tau蛋白(兔多克隆抗体,编号ZA-0247),ER蛋白(兔单克隆抗体,编号ZK-3003)及相关试剂盒均购自北京中杉生物技术有限公司。所有穿刺标本经10%甲醛固定,常规石蜡包埋,连续4 μm切片,经脱蜡、水化,微波修复20 min和3%过氧化氢孵育5 min,PBS冲洗;滴加一抗Tau兔抗人单克隆抗体(1∶50稀释),室温孵育85 min,PBS冲洗,滴加二抗,室温孵育 60 min,DAB显色,常规复染封片。阴性对照用PBS代替一抗,用正常乳腺上皮组织作阳性对照。
Tau蛋白阳性评分以正常乳腺上皮细胞和血管的Tau蛋白表达被视为阳性对照参考,肿瘤细胞胞质和/或胞膜没有着色为0,弱于正常乳腺上皮细胞为(1+),和正常乳腺上皮细胞相同为(2+),着色强于正常乳腺上皮细胞为(3+)。规定(0,1+)为阴性,(2+,3+)为阳性[2]。ER 蛋白的表达以细胞核内出现棕黄色颗粒为阳性染色,参照ASCO/CAP乳腺癌激素受体IHC检测指南[3],规定ER阳性细胞比例>1%即为阳性。
1.6 统计学方法
数据处理采用SPSS 13.0统计软件。计数资料采用χ2检验或Fisher确切概率法,相关性分析用Spearman检验,以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌组织Tau蛋白的表达及其与ER的相关性
200例乳腺癌患者,肿瘤组织Tau蛋白表达阳性88例,阳性率为44%,ER阳性124例,阳性率为62%,见图1;Spearman等级资料相关分析,结果显示Tau蛋白表达与ER表达呈正相关(r=0.32,P < 0.000 1)。
2.2 乳腺癌组织Tau蛋白的表达与乳腺癌含紫杉类新辅助化疗疗效的关系
Tau 蛋白阳性乳腺癌患者,有病理反应 G1~2级 53 例,G3~5级 33 例,病理完全缓解(PCR)4 例,化疗有效(CR+PR)71例,疗效不明显或进展(SD+PD)17例,与Tau蛋白阴性组比较,临床疗效、Miller-Payne病理反应分级和PCR均存在统计学差异(P=0.002,P < 0.000 1,P < 0.000 1)。 见表1。
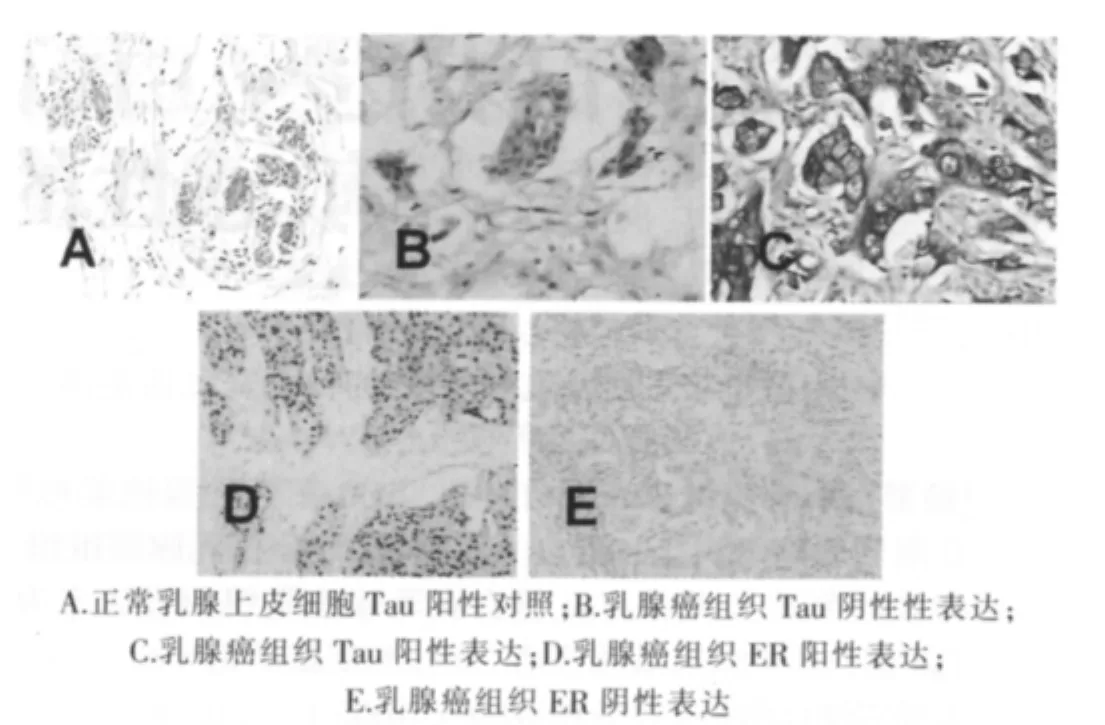
图1 乳腺癌组织Tau蛋白与ER的表达(SP×200)

表1 乳腺癌组织tau蛋白的表达与乳腺癌新辅助化疗疗效的关系
2.3 Tau蛋白表达与ER阳性或ER阴性乳腺癌患者新辅助化疗疗效关系
ER阳性乳腺癌患者124例,阴性76例,阳性率为62%;分层分析发现,在ER阳性的乳腺癌患者中,Tau蛋白阴性表达组的乳腺癌紫杉类新辅助化疗疗效、病理化疗反应分级和病理完全缓解率均高于Tau蛋白阳性表达组,差异有统计学意义(P=0.008,P < 0.000 1,P < 0.000 1),但在 ER 阴性的乳腺癌患者中,Tau蛋白不同表达的乳腺癌患者对紫杉类新辅助化疗的疗效、病理化疗反应分级和病理完全缓解率的差异无统计学意义(P=1.000、0.623、0.119)。 见表2。
3 讨论
紫杉醇最初是从植物红豆杉树皮中分离提取的,它是一种细胞微管稳定剂,同时具有强大的细胞毒性作用,是一种高效的抗肿瘤药物。20世纪90年代中后期,联合紫杉醇的化疗方案逐步应用于乳腺癌的综合治疗,并取得较好疗效,国内外研究表明,以紫杉醇为基础的联合化疗总反应率(ORR)约为70%[4-5]。目前,紫杉类的化疗药物价格相对昂贵,并具有较大的毒副反应,筛选一些有效的紫杉醇化疗疗效预测因子,将有利于节略医疗资源,减少患者不必要的化疗损害。
Tau蛋白由位于17号染色体上的MART基因编码,是一种微管相关蛋白,最早是发现在中枢神经系统神经元内高度表达,在正常乳腺上皮细胞和乳腺癌组织中有表达。由于微管内表面Tau与紫杉醇具有相同的结构域,Tau会干扰紫杉醇与微管的结合能力,从而可能与乳腺癌紫杉醇化疗耐药有关[6]。细胞实验发现,荧光紫杉醇在Tau蛋白低表达的细胞中与微管的结合力更强,而放射标记3H的紫杉醇在经过Tau预处理后与微管的结合力减弱,Tau的缺失可能使紫杉醇更容易破坏微管[2]。在紫杉醇化疗不敏感的乳腺癌细胞株中Tau蛋白阳性表达,下调Tau蛋白的表达,可增加对紫杉醇化疗不敏感的乳腺癌细胞株的化疗敏感性[7-9]。同年,Wagner等[10]在乳腺癌的荷瘤鼠上也得出了相同的结论。临床研究发现,Tau蛋白表达阴性与乳腺癌紫杉醇类方案新辅助化疗的化疗有效率及病理完全缓解率均相关(P<0.05),乳腺癌tau蛋白表达状态可作为乳腺癌患者临床选择紫杉类化疗方案的标记[11]。本研究回顾分析了200例采用紫杉类(CET/CEP,环磷酰胺+表阿霉素+多西他赛或紫杉醇脂质体)新辅助化疗的乳腺癌患者,发现Tau蛋白阳性表达率为44%,和Lajos等[11]的研究相似,Tau蛋白阴性与新辅助化疗疗效,包括临床有效率、病理化疗反应率及病理完全缓解率均有关(P < 0.000 1,P=0.03,P < 0.000 1),和上述的研究[2,7-9,11]和国内王坤[12]的结论相同。

表2 P53蛋白和Tau蛋白表达与ER阴性或阳性乳腺癌患者新辅助化疗疗效的关系
NSABP-B 28大型临床研究分析了1 942例乳腺癌Tau蛋白的表达,发现ER阳性肿瘤更容易出现Tau蛋白阳性结果,两者具有相关性,Tau蛋白表达与较长时期乳腺癌患者的无瘤生存率和总生存率相关,但与紫杉类的化疗效果无关,并反对将Tau蛋白作为乳腺癌患者临床选择紫杉类化疗方案的标记[11],得出同样反对意见还有最近的几项临床研究[13-14]。而Andre等[15]则认为,在ER阳性的乳腺癌患者Tau蛋白阳性表达可同时作为内分泌治疗敏感和化疗耐药的指标。本研究200例乳腺癌患者,有ER(雌激素受体)阳性124例,其中包括Tau蛋白表达阳性70例,Tau蛋白表达与ER呈正相关(r=0.32,P<0.000 1),分析发现,在雌激素受体阳性的乳腺癌患者,Tau蛋白表达阴性的患者紫杉类新辅助化疗疗效更好,病理完全缓解率更高,而在激素受体阴性的乳腺癌患者并不存在这种近期疗效获益,和Andre等[15]的结论相符。当然,由于Tau检测方法的不同和检测试剂和评判的标准差异,Tau蛋白作为乳腺癌紫杉类化疗疗效的预测指标还存在争议,需要进行更大样本的随机对照研究。
总之,本研究认为,乳腺癌组织Tau蛋白表达与ER正相关,检测Tau蛋白表达可作为ER阳性乳腺癌患者选择紫杉类化疗药物的临床依据。
[1]Ogston KN,Miller ID,Payne S,et al.A new histological grading system to assess response of breast cancers to primary chemotherapy:prognostic significance and survival[J].Breast,2003,12(5):320-327.
[2]Rouzier R,Rajan R,Wagner P,et al.Microtubule-associated protein tau:a marker of paclitaxel sensitivity in breast cancer[J].Proc Natl A-cad Sci USA,2005,102(23):8315-8320.
[3]Hammond ME,Hayes DF,Dowsett M,et al.American society of clinical oncology/college of American pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer[J].J Clin Oncol,2010,28(16):2784-2795.
[4]Sledge GW,Neuberg D,Bernardo P,et al.Phase Ⅲ trial of doxorubicin,paclitaxel,and the combination of doxorubicin and paclitaxel as frontline chemotherapy for metastatic breast cancer: an intergroup trial(E1193)[J].J Clin Oncol,2003,21(4):588-592.
[5]Gajria D,Seidman A,Dang C.Adjuvant taxanes:more to the story[J].Clin Breast Cancer,2010,10(Suppl 2):41-49.
[6]邓权通,王坤,郑登云.Tau与乳腺癌紫杉类化疗敏感性关系的研究进展[J].中华乳腺病杂志:电子版,2011,5(3):330-336.
[7]Roman Rouzier,Radhika Rajan,Peter Wagner,et al.Microtubule-associated protein tau:a marker of paclitaxel sensitivity in breast cancer[J].Proc Natl Acad Sci USA,2005,102(23):8315-8320.
[8]Tatiana Spicakova,Maureen M,O'Brien,et al.Expression and silencing of microtubule-associated protein Tau in breast cancer cells [J].Mol Cancer Ther,2010,9(11):2970-2981.
[9]Ikeda H,Taira N,Hara F,et al.The estrogen receptor influences microtubule-associated protein tau(MAPT)expression and the selective estrogen receptor inhibitor fulvestrant downregulates MAPT and increases the sensitivity to taxane in breast cancer cells [J].Breast Cancer Res,2010,12(3):43.
[10]Wagner P,Wang B,Clark E,et al.Microtubule Associated Protein(MAP)-Tau:a novel mediator of paclitaxel sensitivity in vitro and in vivo[J].Cell Cycle,2005,4(9):1149-1152.
[11]Lajos Pusztai,Jong-Hyeon Jeong,Yun Gong,et al.Evaluation of microtubule-associated protein-tau expression as a prognostic and predictive marker in the NSABP-B 28 randomized clinical tyrial[J].J Clin Oncol,2009,27(26):4287-4292.
[12]王坤,邓权通,廖宁,等.蛋白tau表达与乳腺癌紫杉类新辅助化疗敏感性的关系[J].中华肿瘤防治杂志,2011,18(3):187-190.
[13]Rodya A,Karna T,Gatje R,et al.Gene expression profiling of breast cancer patients treated with docetaxel,doxorubicin,and cyclophosphamide within the GEPARTRIO trial:HER-2,but not topoisomeraseⅡ alpha and microtubule-associated protein tau,is highly predictive of tumor response[J].The Breast,2007,16:86-93.
[14]Baquero MT,Lostritto K,Gustavson MD,et al.Evaluation of prognostic and predictive value of microtubule associated protein tau in two independent cohorts[J].Breast Cancer Res,2011,13(5):85.
[15]Andre F,Hatzis C,Anderson K,et al.Microtubule-associated proteintau is a bifunctional predictor of endocrine sensitivity and chemotherapy resistance in estrogen receptor-positive breast cancer[J].Clin Cancer Res,2007,13(7):2061-2067.
