烟酸抑制血管紧张素Ⅱ诱导的内皮细胞C反应蛋白的表达
2012-10-17刘宏斌
张 波 刘宏斌
解放军总医院心内科,北京 100853
作为一种调脂药物,烟酸已用于预防和治疗动脉粥样硬化达数十年之久。烟酸可有效降低血清甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)以及脂蛋白(a)[Lp(a)],同时有升高高密度脂蛋白(HDL)的作用[1]。临床研究证实烟酸单独或与其他调脂药物联合应用,可延缓甚至逆转动脉粥样硬化的进展,降低高脂血症患者及冠心病患者的心血管事件发生率和总死亡率[2]。过去公认这些效应是烟酸降脂作用的结果,但近年来一些基础研究表明烟酸具有不依赖其调脂效应的抗动脉粥样硬化和抗炎症作用[3]。
C反应蛋白(CRP)是急性炎症反应敏感但并非特异性的标记物,许多临床研究和Meta分析认为血清CRP水平与多种心血管危险因子相关,能独立预测未来心血管事件[4]。另一方面,多个可靠实验的结果表明CRP不仅仅是动脉粥样硬化的预测者,其大量的存在于动脉粥样病变中,启动多个致动脉粥样硬化信号通路,直接参与了动脉粥样斑块的形成与进展[5]。
有研究证实,3个月的烟酸治疗能显著降低血清CRP水平(15%)[6],但没有直接的证据描述烟酸对内皮细胞CRP表达的影响。我们拟设计实验探讨烟酸对血管紧张素Ⅱ(AngⅡ)诱导的内皮细胞CRP表达的影响及其作用机制。本研究将促进对烟酸药理作用认识的进一步深入,为烟酸的临床使用提供新的思路。
1 材料与方法
1.1 材料
1.1.1 细胞株人脐静脉内皮细胞株为川北医学院风湿免疫研究所提供。
1.1.2 血管紧张素Ⅱ、烟酸(美国Sigma公司),DMEM培养基(Gibco BRL公司);胎牛血清(HyClone北京生物化学制品有限公司);定量 PCR 试剂盒(ABGAB);CRP、β-actin 引物由上海生工合成;CRP、NF-κB p65、β-actin 抗体购于 Santa Cruz公司。其余试剂均为进口分装或国产分析纯。荧光定量PCR仪(ABI 7900TH)。
1.2 方法
1.2.1 细胞培养 人脐静脉内皮细胞株用含10%的胎牛血清的DMEM培养基加100 U/mL青霉素和100 μg/mL链霉素,于37℃、5%CO2的孵箱中孵育。在70%~80%融合后,置于无血清培养基中孵育12 h备用。实验分为对照组(NC组)、
AngⅡ组和AngⅡ+Niacin组,NC组HUVECs不做任何处理;AngⅡ组用血管紧张素Ⅱ(1 μmol/L)孵育 12 h,然后行 PCR和Western Blot;AngⅡ+Niacin组 HUVECs在血管紧张素Ⅱ(1 μmol/L) 孵育 12 h 前先用烟酸 1 mM 分别处理 1、2、6、12及24 h,用血管紧张素Ⅱ(1 μmol/L)孵育 12 h后行 PCR 和Western Blot,确定CRP蛋白和mRNA表达量最小的时间,然后以此时间点用不同浓度烟酸(0.25、0.5、1.0 mmol/L)预处理HUVECs,再用血管紧张素Ⅱ(1 μmol/L)孵育 12 h,然后行 PCR和Western Blot。
1.2.2 Realtime RT-PCR总RNA的提取采用TRI Reagent法,按照说明书所示规程提取总RNA,使用分光光度计测定RNA的浓度和纯度。RNA提取后依照逆转录试剂盒说明书操作合成cDNA。以β-actin为内参扩增CRP基因。β-actin上游引物(产物 194 dp):5'-AGGACTGTGTTGGCGTACAG-3',下游引物:5'-TCCCTGGAGAAGAGCTACGA-3'。CRP 上游引物(产物 133 dp):5'-ACTTCCTATGTATCCCTCAAAG-3',下游引物:5'-CTCATTGTCTTGTCTCTTGGT-3'。 用 2-ΔΔCt方法处理实时定量数据,计算CRP mRNA的表达。实验重复3次,取平均值。
1.2.3 Western Blot analysis CRP蛋白提取 用RIPA裂解液收集细胞,BCA蛋白定量试剂盒测定蛋白浓度;核蛋白提取:用细胞刮将细胞从培养瓶中刮取下来后,再用PBS洗涤3次,1 000 r/min 5 min离心,收集沉淀后按照核蛋白提取试剂盒提取核蛋白;利用10%的SDS-PAGE胶进行分离等量蛋白,然后转膜、封闭,加入的兔抗人CRP抗体(1∶1 000稀释)或 NF-κB p65 抗体(1∶200 稀释)4℃孵育 12 h,洗膜后加入辣根过氧化物酶标记的二抗(1∶5 000稀释),室温孵育1 h,洗膜后采用电化学显影,X线片曝光,并对显影条带进行灰度扫描做相对定量分析。以β-actin为内参照。
1.3 统计学方法
采用SPSS 17.0统计软件进行处理数据,计量资料采用均数±标准差(±s)表示,组间比较采用t检验,计数资料采用百分率表示,组间对比采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
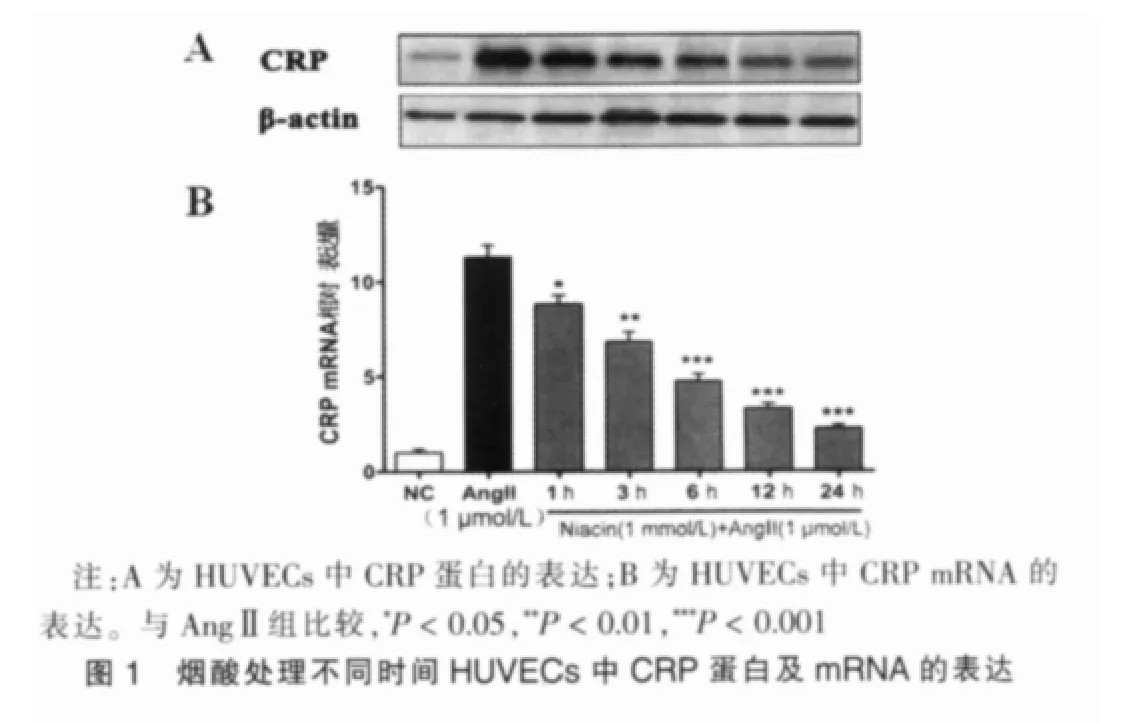
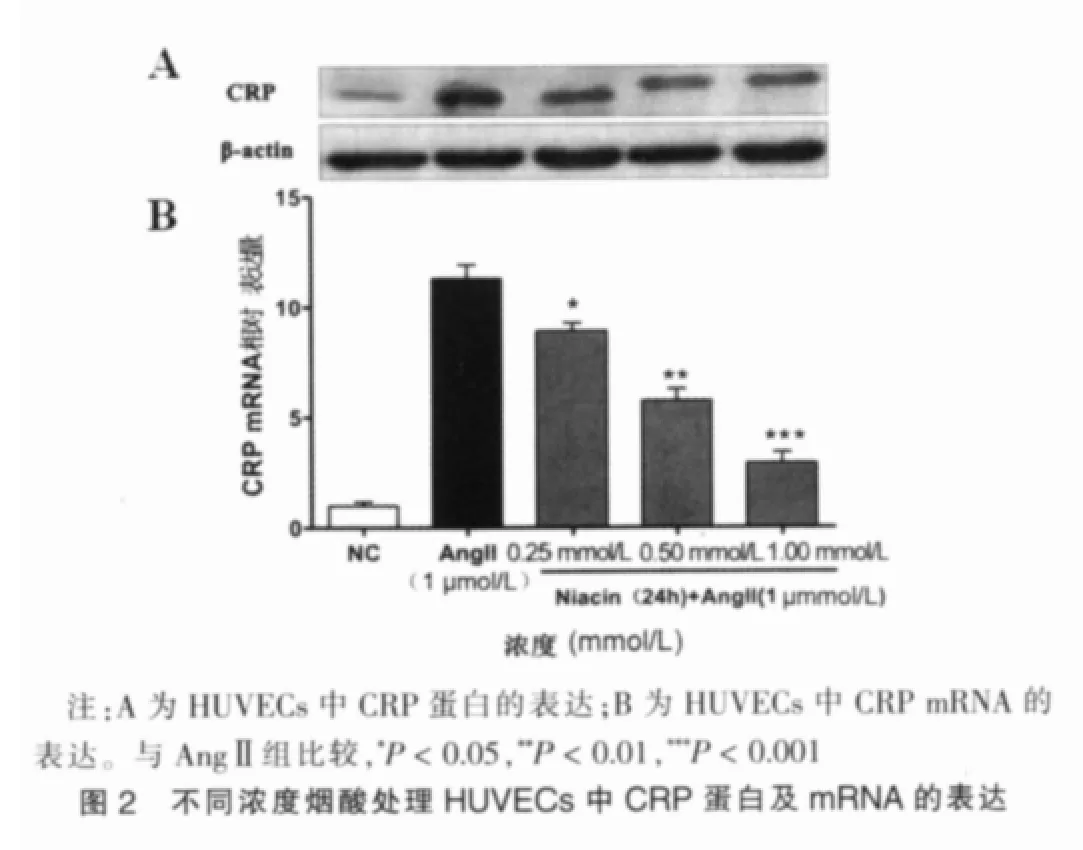
烟酸抑制血管紧张素诱导的HUVECs中CRP mRNA及蛋白的表达以NC组作为对照,AngⅡ组CRP mRNA相对表达量为(11.31±0.63);在烟酸(1 mmol/L)处理 1、3、6、12 及 24 h后再加入 AngⅡ孵育 12 h,AngⅡ+Niacin组 CRPmRNA较NC 组 的 相 对 表达 量 分 别 为(8.83±0.45)、(6.81±0.52)、(4.74±0.37)、(3.30±0.25)、(2.25±0.17)。 1、3、6、12 和 24 h AngⅡ+Niacin组CRP mRNA表达较AngⅡ组均有显著降低,差异有统计学意义(P=0.033 0、P=0.005 3、P=0.000 8、P=0.000 3、P=0.000 2),且mRNA表达随时间延长有降低趋势。AngⅡ+Niacin组CRP蛋白表达较AngⅡ组也随着时间延长明显降低(图1)。以 NC组作为对照,当 HUVECs分别用0.25、0.50及 1.0 mmol/L的烟酸预处理 24 h后,AngⅡ+Niacin 组的CRP mRNA 相对表达量分别为(8.92±0.37)、(5.75±0.53)、(2.91±0.48)。 与 AngⅡ组相比,0.25、0.5 和 1.0 mmol/L AngⅡ+Niacin组CRP mRNA表达显著降低,差异有统计学意义(P=0.030 8、P=0.002 5、P=0.000 5),且 mRNA 表达随浓度增加有降低趋势。AngⅡ+Niacin组CRP蛋白表达较AngⅡ组也随着浓度增加明显降低(图2)。
烟酸抑制AngⅡ诱导的NF-κB蛋白表达AngⅡ为血管紧张素Ⅱ1 μmol/L处理 12 h后 HUVECs中 CRP和 NF-κB p65蛋白的表达;Niacin+AngⅡ为1 mmol/L烟酸预处理24 h,再用血管紧张素Ⅱ1 μmol/L处理12 h后HUVECs中 CRP和NF-κB p65蛋白的表达。根据Western Blot结果显示,AngⅡ+Niacin组与AngⅡ组相比,NF-κB蛋白表达有明显下降,同时CRP蛋白表达呈同步下降趋势(图3)。
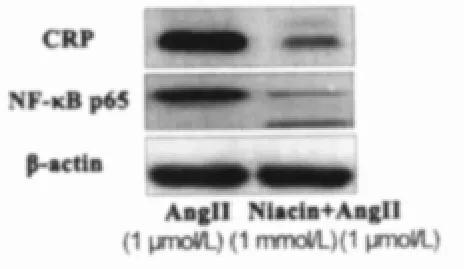
图3 烟酸抑制血管紧张素II诱导内皮细胞CRP和NF-κB p65蛋白表达
3 讨论
目前,动脉粥样硬化是一种炎症性疾病的观点已得到研究者公认,炎症贯穿了动脉粥样斑块的形成、进展和破裂的全过程。在炎性标志物中,C反应蛋白是最具代表性的一种。近来的研究发现,除了其炎症标志物的功能外,CRP存在于动脉粥样斑块以及血管内皮细胞等诸多细胞中[7-8],可诱导参与动脉粥样硬化的多种细胞的炎症[9-10],直接参与了动脉粥样硬化的进程[5]。
烟酸是最早应用于临床的调脂药物,但众多副作用限制了其临床应用,随着剂型的改进特别是缓释剂型的应用,烟酸类药物又重新获得了研究者的关注。近年来的研究发现许多研究提示烟酸具有独立于降脂效应的抗动脉粥样硬化作用。在内皮细胞中,烟酸通过降低氧自由基产物、氧化的低密度脂蛋白以及炎症因子能抑制血管炎症[11]。动物实验中,在血脂水平不变的条件下,烟酸能抑制血管炎症和内皮细胞功能失调[12]。在一个随机、双盲、安慰剂对照的临床实验中,缓释型烟酸能改善冠状动脉疾病患者的内皮功能失调[13]。本研究探讨了烟酸对血管紧张素Ⅱ诱导的人颈静脉内皮细胞中CRP表达的影响,发现烟酸能抑制AngⅡ诱导的HUVECs中CRP mRNA和蛋白的表达,而且这种抑制呈时间和浓度依赖性。
有多个实验的结果提示烟酸抑制血管炎症的能力可能与抑制NF-κB活性有关[11,14],而也有研究证实AngⅡ诱导内皮细胞CRP表达的机制可能是激活NF-κB。因而本研究探讨了烟酸对血管紧张素诱导的NF-κB活性的影响,发现烟酸能抑制AngⅡ诱导NF-κB p65蛋白的表达,且CRP蛋白表达也同步降低,提示抑制NF-κB可能是烟酸抑制AngⅡ诱导的HUVECs中CRP表达的分子机制之一。
综上所述,本研究发现烟酸通过抑制NF-κB减少了AngⅡ诱导人颈静脉内皮细胞CRP的表达,促进了我们对烟酸抗动脉粥样硬化和抗炎症作用机制理解的进一步深入,为烟酸的临床使用方面提供了新的实验依据。
[1]Meyers CD,Kamanna VS,Kashyap ML.Niacin therapy in atherosclerosis[J].Curr Opin Lipidol,2004,15:659-65.
[2]Kamanna VS,Kashyap ML.Nicotinic Acid(Niacin) Receptor Agonists:Will They Be Useful Therapeutic Agents?[J].The American journal of cardiology, 2007,100:53-61.
[3]Holzhauser E,Albrecht C,Zhou Q,et al.Nicotinic acid has anti-atherogenic and anti-inflammatory properties on advanced atherosclerotic lesions independent of its lipid-modifying capabilities [J].J Cardiovasc Pharmacol,2011,57:447-454.
[4]Kaptoge S,Di AE,Lowe G,et al.C-reactive protein concentration and risk of coronary heart disease,stroke,and mortality:an individual participant meta-analysis[J].Lancet,2010,375:132-140.
[5]Bisoendial RJ,Boekholdt SM,Vergeer M,et al.C-reactive protein is a mediator of cardiovascular disease[J].European Heart Journal,2010,31:2087-2091.
[6]Kuvin JT,Dave DM,Sliney KA,et al.Effects of Extended-Release Niacin on Lipoprotein Particle Size,Distribution,and Inflammatory Markers in Patients With Coronary Artery Disease[J].The American journal of cardiology,2006,98: 743-745.
[7]Singh P,Hoffmann M,Wolk R,et al.Leptin induces C-reactive protein expression in vascular endothelial cells [J].Arterioscler Thromb Vasc Biol,2007,27: 302-307.
[8]Yasojima K,Schwab C,Mcgeer EG,et al.Generation of C-reactive protein and complement components in atherosclerotic plaques [J].Am J Pathol,2001,158: 1039-1051.
[9]Mineo C,Gormley AK,Yuhanna IS,et al.FcγRIIB Mediates C-Reactive Protein Inhibition of Endothelial NO Synthase[J].Circulation Research,2005,97: 1124-1131.
[10]Lim MY,Wang H,Kapoun AM,et al.p38 Inhibition attenuates the pro-inflammatory response to C-reactive protein by human peripheral blood mononuclear cells[J].J Mol Cell Cardiol,2004,37:1111-1114.
[11]Ganji SH,Qin S,Zhang L,et al.Niacin i nhibits vascular oxidative stress,redox-sensitive genes,and monocyte adhesion to human aortic endothelial cells[J].Atherosclerosis,2009,202:68-75.
[12]Wu BJ,Yan L,Charlton F,et al.Evidence That Niacin Inhibits Acute Vascular Inflammation and Improves Endothelial Dysfunction Independent of Changes in Plasma Lipids[J].Arteriosclerosis,Thrombosis,and Vascular Biology,2010,30:968-975.
[13]Warnholtz A,Wild P,Ostad MA,et al.Effects of oral niacin on endothelial dysfunction in patients with coronary artery disease:results of the randomized, double-blind,placebo-controlled INEF study[J].Atherosclerosis,2009,204: 216-221.
[14]Tavintharan S,Lim SC,Sum CF.Effects of niacin on cell adhesion and early atherogenesis:biochemical and functional findings in endothelial cells[J].Basic Clin Pharmacol Toxicol,2009,104:206-210.
