Bcl2-siRNA增加人肺腺癌细胞化疗敏感性的研究
2012-10-17张学林余秉翔
张学林 余秉翔
1.解放军总医院呼吸科,北京 100853;2.解放军总医院国际医学中心,北京 100853
siRNA(small interfering RNA)是一种双链小 RNA分子(长 21~25 bp),是 RNA 干涉(RNAi)途径中的中间产物,是RNAi发挥效应所必需的因子,它通过与一系列特异性蛋白质结合形成RNA诱导的沉默复合物(RISC),激发与之互补的目标mRNA的降解。siRNA对靶序列的作用具有高效性,在细胞内,siRNA能在低于反义核苷酸几个数量级的浓度下,使靶基因表达水平降低[1]。肺癌是目前全世界范围内死亡率最高的恶性肿瘤[2],按组织学分为小细胞肺癌(small-cell lung cancer,SCLC)和非小细胞肺癌(non-small-cell lung cancer,NSCLC),其中NSCLC占80%以上,我国肺癌五年生存率仅为8%~10%,65%的肺癌患者在诊断明确时已发展至晚期,失去手术机会[3]。化疗在肺癌治疗中具有极为重要的作用,铂类药物联合其他化疗药物目前仍是治疗NSCLC的主要方案。据统计,在我国以顺铂为主或含有顺铂联合用药的化疗方案占所有抗肿瘤化疗方案的70%~80%[4]。但是其严重的肾毒性、耳毒性及消化道损伤等药物蓄积性毒副反应制约着该药的临床应用[5]。为减少铂类药物的副作用,到目前已研发了许多铂类药物,但至今仍未找到一种满意的产品。为解决这一问题,本研究期望通过提高肿瘤对化疗药物的敏感性,在相同疗效甚至提高疗效的前提下减少化疗药物的用量,从而将毒副反应控制在较低水平。有研究表明,Bcl-2基因能抑制诸如抗肿瘤药等凋亡信号引起的细胞凋亡[6]。该基因的高表达与人肺腺癌细胞顺铂耐药关系密切[7]。本研究拟以人肺腺癌细胞A549为模型,通过siRNA技术降低肿瘤细胞中Bcl-2基因的表达,进而增加A549细胞对顺铂的敏感性,为减少顺铂剂量限制性毒副反应提供理论依据。
1 材料与方法
1.1 细胞株
人肺腺癌细胞株A549(ATCC)购于中国医学科学院肿瘤研究所,用含10%的胎牛血清(Hyclone)的RPMI-1640培养液加100 U/mL青霉素和100 μg/mL链霉素,于37℃、5%CO2的孵箱中孵育。
1.2 试剂与仪器
注射用顺铂(冻干型)为齐鲁制药产品;jetPRIME转染试剂购于 PolyPlus-transfection 公司;Cell Counting Kit-8(CCK-8)购自DOJINDO公司;TRI Reagent购自Sigma公司;反转录试剂盒购于Promega公司;荧光PCR试剂购于TaKaRa公司;Bcl-2、GAPDH抗体购于Santa Cruz公司。siRNA由上海吉玛公司合成(Negative Control RNA序列为 :5'-UUCUCCGAACGUGUCACGUTT -3',5'-ACGUGACACGUUCGGAGAATT-3'。 Bcl2-siRNA 序 列[8]为 :5'-UGUGGAUGACUGAGUACCUGAdTdT-3',5'-UCAGGUACUCAGUCAUCCACAdTdT-3');其余试剂均为进口分装或国产分析纯。Mx3000p荧光实时定量PCR仪由Stratagene生产;MS酶标仪由芬兰Labsystems生产。
1.3 转染
取对数生长期细胞接种于6孔板,每孔1.0×105个细胞,接种16 h后采用jetPRIME转染试剂,按说明书进行转染。每孔转染双链RNA终浓度为20 nM。转染24 h后换为正常培养液。实验分为阴性对照组(转染Negative Control RNA)和试验组(转染Bcl2-RNA)。
1.4 Real time RT-PCR
总RNA的提取采用TRI Reagent法,按照说明书进行。RNA提取后逆转录为cDNA,按说明书操作。以GAPDH为内参照扩增Bcl2基因。GAPDH上游引物:5'-TCAGTGGTG GACCTGACCTG-3', 下游 引物 :5'-TGCTGTAGCCAAATTCG TTG-3'。Bcl-2 上游引物:5'-GGATGCCTTTGTGGAACTGT-3',下游引物:5'-AGCCTGCAGCTTTGTTTCAT-3'。 用 2-ΔΔCt方法处理实时定量数据,计算Bcl-2 mRNA的表达差异。实验重复3次,取平均值。
1.5 CCK-8 assay
细胞转染32 h后,接种于96孔板,每孔2.0×103个细胞,接种16 h后换为新鲜配置的含不同浓度顺铂的培养液(0、0.5、1、2、3 μg/mL), 每个浓度 5 个复孔。 药物作用 48 h后,换为新鲜配置的含10%CCK-8液的培养液100 μL,置孵箱继续培养,1 h后用多功能酶标仪于450 nm波长下检测每孔吸光度值(A)。按公式计算每个浓度的顺铂对细胞生长的抑制率(IR):IR(%)=(1-Ai/A0)×100%(注:Ai为各浓度顺铂组的平均吸光值,A0为不加顺铂组的平均吸光值),并计算顺铂对阴性对照组和实验组中A549细胞的半数抑制浓度(IC50)。实验重复3次,取平均值。
1.6 Western Blot analysis
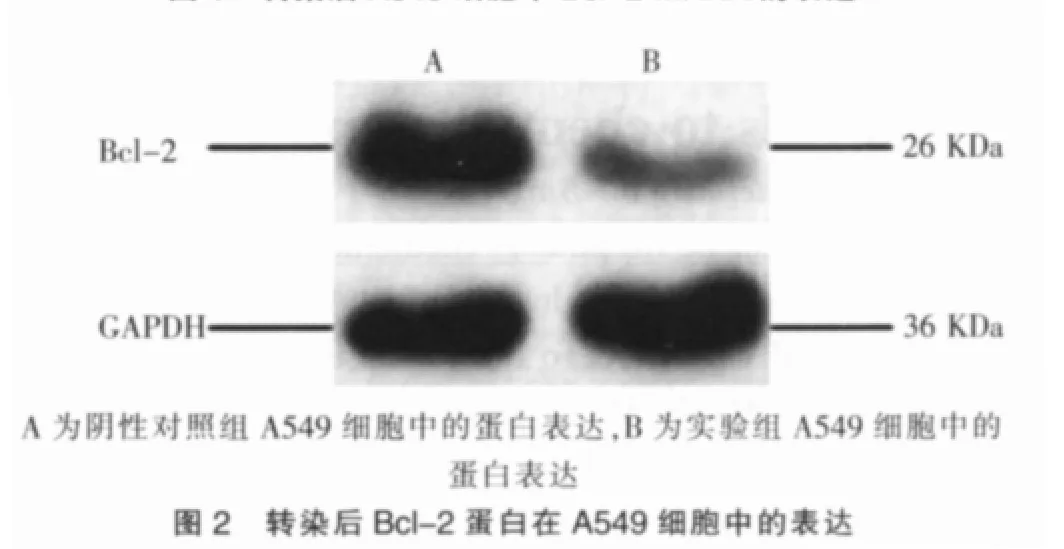
用RIPA裂解液收集转染后细胞,BCA蛋白定量试剂盒测定蛋白浓度后,利用10%的SDS-PAGE胶进行分离等量蛋白,然后转膜、封闭,加入1∶1 000稀释的兔抗人Bcl-2单克隆抗体,以及1∶5 000稀释的二抗。最后加入发光试剂,曝光、显影。以GAPDH为内参照。
1.7 统计学方法
采用SPSS 17.0统计软件进行处理数据,计量资料采用均数±标准差(±s)表示,两组独立样本采用t检验,计数资料采用百分率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 Bcl-2 mRNA及蛋白在A549细胞中转染siBcl-2后的差异表达
在A549细胞中转染双链RNA 48 h后,实验组同阴性对照组相比,Bcl-2 mRNA表达水平降低了 93.2%(P=0.037)(图1),其蛋白表达也明显降低(图2),几乎达到“敲出”该基因的效果。
2.2 A549细胞转染siBcl-2后对顺铂的敏感性增强

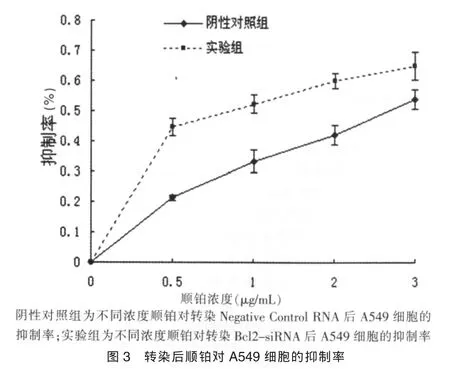
根据CCK-8结果显示,顺铂对两组A549细胞的增殖均有抑制作用(图3)。转染Negative Control后顺铂对A549细胞的 IC50值为(2.68±0.37)μg/mL,转染 Bcl2-siRNA 后的 IC50值为(0.81±0.24)μg/mL,转染 Bcl2-siRNA 后 A549 细胞对顺铂的敏感性提高了 69.8%(P=0.024)(图4)。
3 讨论

顺铂是一种经典的肿瘤化疗药物,该药疗效具有剂量依赖性,但是随着给药量的增加,其对机体的毒副作用也相应增加,这就使得顺铂的使用具有一定的限制性[9]。顺铂的毒副作用包括骨髓、肾、耳、胃肠道毒性及过敏反应等[10-14]。在临床应用中,严重的肾毒性是限制治疗的常见因素[10],其肾毒性具有剂量限制性,主要损伤近曲小管,较少累及远曲小管和肾小球[11],可以引起肾小管的萎缩及肾脏纤维化[10]。其耳毒性表现为顺铂治疗过程中可出现累及性、不可逆的听力受损[12-13],顺铂导致的过敏反应,随着用药疗程和剂量的增加而随之增加,严重者甚至可出现生命危险[14]。探索一种能提高肿瘤对化疗药物顺铂敏感性的方法显得至关重要。
本研究以人肺腺癌细胞A549为模型,将Bcl2-siRNA转染进入细胞,使得A549细胞中Bcl-2 mRNA表达水平降低了93.2%,而且Bcl-2蛋白表达量也明显降低。本研究进一步通过CCK-8法测得细胞在转染Bcl2-siRNA后,对顺铂的敏感性提高了 69.8%,IC50值由(2.68±0.37)μg/mL 下降至(0.81±0.24)μg/mL。据此,可以相信将此方法应用于临床,将极大地降低顺铂的治疗剂量,从而能够将顺铂的毒副反应控制在较低水平。
Bcl-2(B-cell lymphoma/leukemia-2,B 细胞淋巴瘤/白血病)基因,是1984年从B细胞滤泡性淋巴瘤中分离出来的一种原癌基因。该基因定位于染色体18q1.3上,大小约230 kb,编码26×103 kDa大小的蛋白。Bcl-2基因在肿瘤的发生发展中起重要的作用[15]。其表达水平与多种肿瘤对化疗药物敏感性有关[16]。Bcl-2蛋白过度表达时,可以抑制活性氧对细胞诱发的凋亡,也可以拮抗细胞内因还原型谷胱甘肽含量的下降所诱发的凋亡[17],同时它还能影响细胞内钙内流而抑制凋亡[18]。Bcl-2基因低表达的卵巢癌对化疗反应良好[19]。人肺腺癌细胞对紫杉醇的敏感性也与Bcl-2基因的表达有关[20]。
本实验将siRNA同顺铂结合起来,极大程度提高了A549细胞对顺铂的敏感性。这一方面应证了Bcl-2基因与人肺腺癌细胞对顺铂敏感性具有密切的关系,另一方面也为临床治疗中如何减轻顺铂毒副作用的程度,或者减少顺铂毒副作用的发生提供了一种新的思路及理论依据。
[1]Brummelkamp TR,Bernards R,Aqami R.A system for stable expression of short interfering RNAs in mammalian cells [J].science,2002,296(5567):550-553.
[2]Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer Clin,2005,55(2):74-108.
[3]马春燕,宋勇.EGFR-TKI治疗非小细胞肺癌的问题与对策[J].药学与临床研究,2010,18(2):112-117.
[4]张伦.铂类抗癌药物的应用及市场状况[J].中国制药信息,2001,17(3):7-10.
[5]Robson H,Meyer S,Shalet SM,et al.Platinum agents in the treatment of osteosarcoma:efficacy of Cisplatin vs.Carboplatin in human osteosarcoma cell lines[J].Med Pediatr Oncol,2002,39(6):573-580.
[6]刘畅,张杰.BcL2与妇科肿瘤的关系[J].中国冶金工业医学杂志,2006,23(5):552-554.
[7]Huang ZX,Lei XY,Zhong M,et al.Bcl-2 small interfering RNA sensitizes Cisplatin-resistant human lung adenocarcinoma A549/DDP cell to Cisplatin and Diallyl Disulfide[J].Acta Biochimica et Biophysica Sinica,2007,39(11):835-843.
[8]Cao N,Cheng D,Zou S,et al.The synergistic effect of hierarchical assemblies of siRNA and chemotherapeutic drugs co-delivered into hepatic cancer cells[J].Biomaterials,2011,32(8):2222-2232.
[9]Robson H,Meyer S,Shalet SM,et al.Platinum agents in the treatment of osteosarcoma:efficacy of cisplatin vs.carboplatin in human osteosarcoma cell lines[J].Med Pediatr Onco1,2002,39(6):573-580.
[10]Sato S,Yamate J,Saito T,et al.Protective effect of taurine against renal interstitial fibrosis of rats induced by ci splatin [J].Naunyn Schmiedebergs Arch Pharmacol,2002,365(4):277-283.
[11]Rajeswaran A,Trojan A,Burnand B,et al.Eficacy and side effects of cisplatin and carboplatin-based doublet chemotherapeutic regimens as first line treatment of metastatic non-small cell lung carcinoma:a systematic review of randomized controlled trials [J].Lung Cancer,2008,59(1):1-11.
[12]Thomas JP,Lautermann J,Liedert B,et al.High accumulation of platinum-DNA adducts in stria]marginal cells of the cochlea is an early event in cisplatin but not carboplatin ototoxicity [J].Mol Pharmacol,2006,70(1):23-29.
[13]廖英俊,汤浩,金亚平.抗癌药顺铂对小鼠的耳、肾和肝毒性及其机制的研究[J].中国药理学通报,2004,20(1):82-85.
[14]刘静,白欧.铂药致过敏反应10例临床分析[J].中国实验诊断学,2009,8(13):1105-1106.
[15]Stravrovskaya AA.Cellular mechanisms of multidrug resistance of tumor cells[J].Biochemistry,2000,65(1):95-106.
[16]Dive C.Avoidance of apoptosis as a mechanism of drug resistance[J].J Intern Med Suppl,1997,740:139-145.
[17]Kane DJ,Sarafian TA,Anton R,et al.Bcl-2 inhibition of neural death:decreased generation of reactive oxygen species [J].Science,1993,262(5137):1274-1277.
[18]Baffy G,Miyashita T,Williamson JR,et al.Apoptosis induced by withdrawal of interleukin-3(IL-3)from an IL-3-dependent hematopoietic cell line is associated with repartitioning of intracellular calcium and is blocked by enforced Bcl-2 oncoprotein production [J].J Biol Chem,1993,268(9):6511-6519.
[19]钟雪云,陈运贤.卵巢上皮癌bcl-2,p53基因与多药耐药的相关研究[J].实用肿瘤学杂志,2000,14(2):82-84.
[20]戴明,罗荣城,钟华成,等.紫杉醇耐药人肺腺癌细胞系的建立及生物学活性[J].实用医学杂志,2007,23(18):2826-2829.
