聚乙二醇干扰素α-2a联合阿德福韦酯治疗慢性乙型肝炎的Meta分析
2012-10-16吴发玲窦晓光
吴发玲,丁 洋,窦晓光*
慢性乙型肝炎(Chronic hepatitis B,CHB)是全球性公共卫生问题[1-3],是由乙型肝炎病毒(Hepatitis B virus,HBV)感染引起的慢性进展性疾病,抗病毒治疗是关键。初始治疗为干扰素(IFN)或核苷(酸)类似物(Nucleotide analogue,NUC)单药治疗,但IFN单药治疗往往应答率低,NUC长期用药易发生病毒变异,产生耐药,造成病毒反弹[4-7],影响疗效。近年来,初始或治疗中联合治疗成为CHB抗病毒治疗的热点及难点[8],其中IFN和NUC作用机制不同,具有互补性,理论上二者联合治疗可早期抑制病毒复制,减少病毒变异,缩短疗程。然而聚乙二醇干扰素 α-2a(Peginterferon α-2a、Peg-IFN α-2a)的Ⅲ期注册临床试验发现,Peg-IFN α-2a联合拉米夫定与Peg-IFN α-2a 单药治疗的短期疗效相同[9];Peg-IFN α-2a联合替比夫定可能出现周围神经病变[10]。因此,在抗病毒治疗的不同时机应当选择不同种类的药物进行联合治疗。笔者查阅Peg-IFN α-2a联合阿德福韦酯(adefovir dipivoxil,ADV)治疗CHB的临床试验发现[11-17],其疗效和安全性各方评价不一。为此,本研究检索了有关Peg-IFN α-2a联合ADV治疗CHB有效性和安全性的随机对照试验,进行系统评价,以期为临床用药提供参考。
1 资料与方法
1.1 纳入和排除标准 纳入标准:①研究设计:随机对照试验(RCT),无论是否采用旨法;②研究对象:慢性乙型肝炎患者,诊断及临床分期均符合我国《慢性乙型肝炎防治指南(2010年版)》[18]制定的诊断标准;③干预措施:试验组为Peg-IFN α-2a联合ADV治疗,对照组为单用Peg-IFN α-2a治疗;④两组在年龄、性别、生化等方面具有均衡可比性;⑤国内外公开发表的文献且均为全文。
排除标准:①合并感染甲、丙、丁、戊型肝炎病毒、EB病毒、巨细胞病毒、人类免疫缺陷病毒(HIV)等;②合并有药物性肝损害、自身免疫性肝病、酒精性肝病、遗传代谢性肝病等;③伴有恶性肿瘤、严重血液系统疾病、未控制的糖尿病、甲状腺疾病等;④既往有精神病史、肌酐>1.5 ULN,中性粒细胞数<1.5 E3/mm3,血小板<9 E4/mm3等用药禁忌情况;⑤6个月内接受过抗病毒治疗。
1.2 检索策略 计算机检索Cochrane Library、PubMed和EMbase,以及中国生物医学文献数据库、中国科技期刊全文数据库,其中英文检索词为“peginteferon α-2a、adefovir、chronic hepatitis B、CHB、Placebo、Randomized controlled trial”,中文检索词为“长效干扰素α-2a、阿德福韦酯、慢性乙型肝炎、慢性乙肝、安慰剂、随机对照试验、双盲”,各数据库检索年限均从建库截至2011年8月。RCT检索遵循Cochrane系统评价手册RCT检索策略,其他检索采用主题词与自由词相结合的方式。所有检索策略通过多次预检索后确定。另外,用Google、ISI web of science等搜索引擎在互联网上查找相关的文献。追查已纳入文献的参考文献,与本领域的专家、通信作者等联系,以获取以上检索未发现的相关信息。
1.3 评价指标 比较Peg-IFN α-2a联合ADV治疗组和Peg-IFN α-2a单药治疗组患者病程12周、24周、48周、72周和96周HBV DNA阴转率、HB-sAg阴转率、HBeAg阴转率、ALT复常率、肝组织学改善率之间的差异,作为 Peg-IFN α-2a联合ADV疗效的评价指标。同时,观察不同时期两组治疗的不良反应。
1.4 纳入文献的方法学质量评价 由两名评价员独立选择试验、提取资料,并致电原文献作者确定试验的具体实施过程。如有不同意见,通过相互讨论达成一致或与第三位评价员协商解决。采用Cochrane Reviewer’Handbook 4.2.3随机对照试验的质量评价标准。由两位研究者对每一篇符合纳入标准的文献进行方法学质量评价。原文如未叙述清楚,尽量与作者联系予以补充后决定是否纳入。
本研究质量评价主要从随机方法是否正确、是否做到分配隐藏、是否采用盲法、不完整数据报告、选择结果报告、其他偏倚6个方面进行。资料提取包括提取文献一般信息如文献题目、作者、发表时间、文献来源等;研究特征如研究对象的一般情况、各组患者的基线、干预措施;结局指标如HBVDNA阴转率、eAg阴转率或血清转换率、sAg阴转率或血清转换率、ALT复常率、肝组织学改善率、安全性等。
1.5 统计分析 统计软件采用Cochrane协作网提供的RevMan 4.2软件,并采用意向治疗分析的方法处理数据。计数资料用OR及其95%CI,计量资料连续变量用WMD及其95%CI为疗效分析统计量。若合并研究间存在异质性,寻找异质性原因,如疗程、剂量、研究质量等,并采用哑组分析和敏感性分析进行处理。若未找到异质性的原因,则采用随机效应模型进行Meta分析;反之则采用固定效应模型。潜在的发表偏倚采用“倒漏斗图”分析。
2 结果
2.1 纳入研究的一般情况 初检相关文献805篇。阅读文题和摘要后,788篇文献因重复、属于非临床试验或研究目的与本系统评价不符而被排除,12篇文献因不符合本系统评价的干预措施标准被排除。最终纳入5篇文献[13-17],纳入文献包括328例慢性乙型肝炎患者,分配到试验组(Peg-IFN α-2a 联合 ADV)和对照组(Peg-IFN α-2a)。纳入文献基本特征见表1。
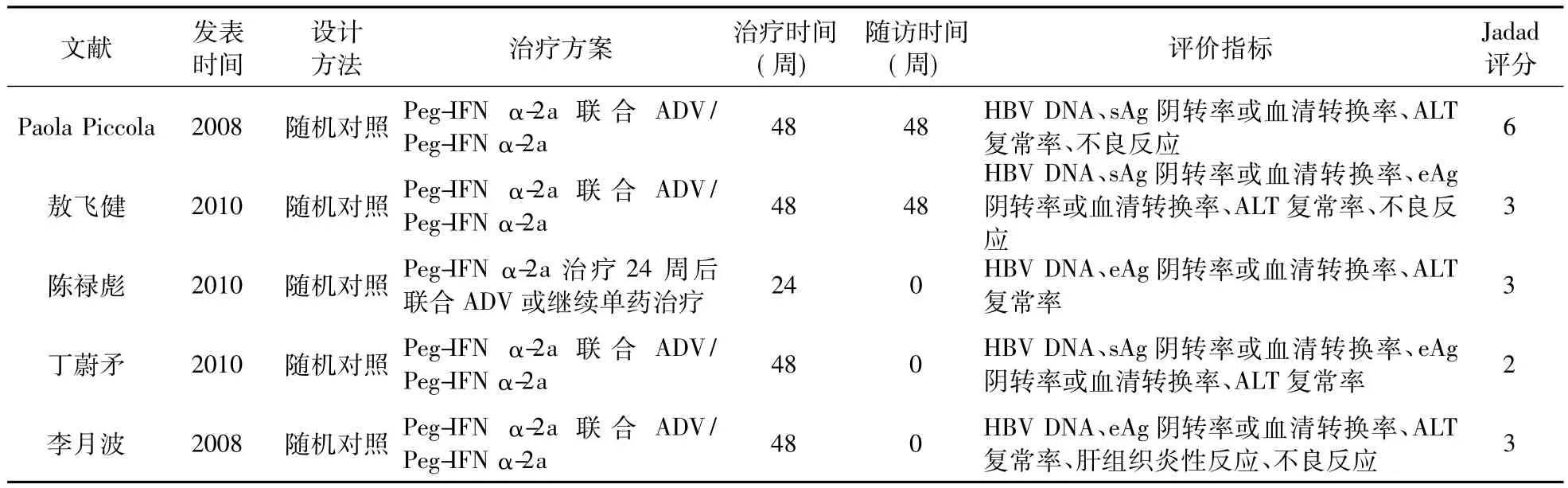
表1 纳入文献基本特征
2.2 纳入研究方法的质量学评价 5篇纳入文献均为完全随机对照设计,均未注明随机分配方法。本次纳入的5个研究均具有基线可比性,有3篇文献详细报道了观察组和对照组的基线情况[13-15],其余2篇仅注明两组患者在性别、年龄、病程、病情程度方面的差异无统计学意义。纳入文献中仅有3篇文献作者注明失访、丢失、脱落病例数[13-14,17]。所有纳入文献均未报道随机分配方案隐藏的方法,具有选择偏倚的中度可能性及测量偏倚的高度可能性。此外,没有试验报道病死率、生命质量或肝癌发生率。对纳入试验中的文献绘制漏斗图(图1),分析表明,纳入的研究以真值为中心呈对称性分布,提示纳入文献的发表偏倚较小;为进一步考查Meta分析的可靠性,对研究结果进行敏感性分析,对明显偏离真值、权重过大或过小的研究给予剔除后再次行Meta分析,均未发现发表偏倚。
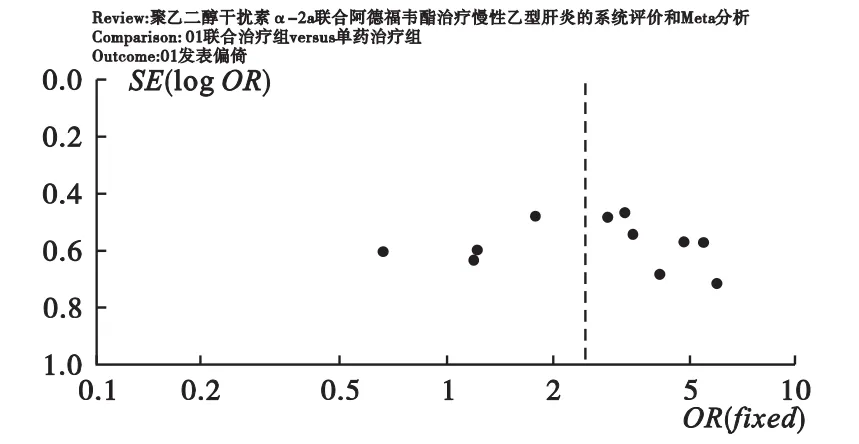
图1 漏斗图发表偏倚分析
3 Meta分析结果
3.1 HBV DNA阴转率 Peg-IFN α-2a联合ADV与Peg-IFN α-2a治疗CHB的HBV DNA阴转率比较见图2。治疗 12周:共纳入2个研究[13,17],研究间无统计学异质性(P=0.09,F=65.3%),采用固定效应模型分析,合并分析结果显示,治疗组优于对照组,差异有统计学意义[OR=2.50,95%CI(1.06,5.92)]。治疗 24 周:共纳入4 个研究[13-15,17],研究间无统计学异质性(P=0.06,F=59.6%),采用固定效应模型分析,合并分析结果显示,治疗组优于对照组,差异有统计学意义[OR=2.28,95%CI(1.39,3.76)]。治疗 48 周:共纳入 4 个研究[13,15-17],研究间无统计学异质性(P=0.92,F=0%),采用固定效应模型分析,合并分析结果显示,治疗组优于对照组,差异有统计学意义[OR=3.66,95%CI(2.13,6.30)]。治疗72周:仅纳入1个研究[13],结果显示,两组差异无统计学意义[OR=1.22,95%CI(0.36,4.17)]。治疗96周:仅纳入1个研究[14],结果显示,两组差异无统计学意义[OR=1.82,95%CI(0.71,4.66)]。将所有上述不同治疗时间研究结果汇总,结果显示,研究间无统计学异质性(P=0.21,F=24.2%),采用固定效应模型分析,合并分析结果显示,治疗组优于对照组,差异有统计学意义[OR=2.53,95%Cl(1.86,3.43)]。
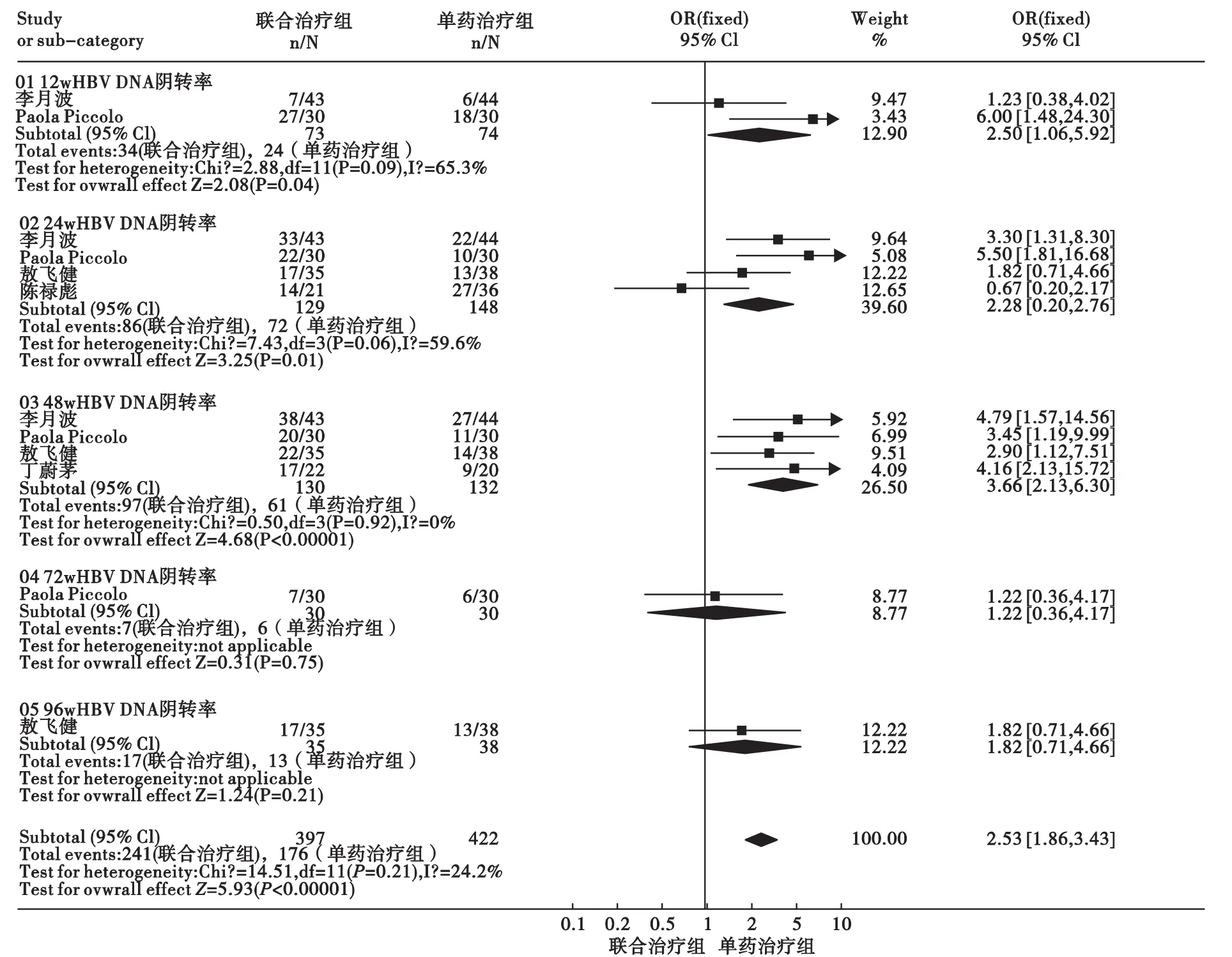
图2 Peg-IFN α-2a联合ADV与Peg-IFN α-2a治疗CHB的HBV DNA转阴率比较Meta分析结果
3.2 eAg阴转率或血清转换率 Peg-IFN α-2a联合ADV与Peg-IFN α-2a治疗CHB的eAg阴转率或血清转换率比较见图3。治疗12周:仅纳入1个研究[17],结果显示两组差异无统计学意义[OR=1.15,95%CI(0.46,2.86)]。治疗 24 周:共纳入3 个研究[14-15,17],研究间无统计学异质性(P=0.07,F=61.8%),采用固定效应模型分析,合并分析结果显示,治疗组优于对照组,差异有统计学意义[OR=1.03,95%CI(0.60,1.76)]。治疗48 周:共纳入3 个研究[14,16-17],研究间无统计学异质性(P=0.22,F=34.9%),差异有统计学意义[OR=2.38,95%CI(1.34,4.23)]。治疗 96 周:仅纳入1个研究[14],结果显示,两组差异无统计学意义[OR=1.30,95%CI(0.52,3.27)]。将所有上述不同治疗时间研究结果汇总,结果显示,研究间无统计学异质性(P=0.08,F=44.4%),采用固定效应模型分析,合并分析结果显示,治疗组优于对照组,差异有统计学意义[OR=1.44,95%CI(1.03,2.01)]。
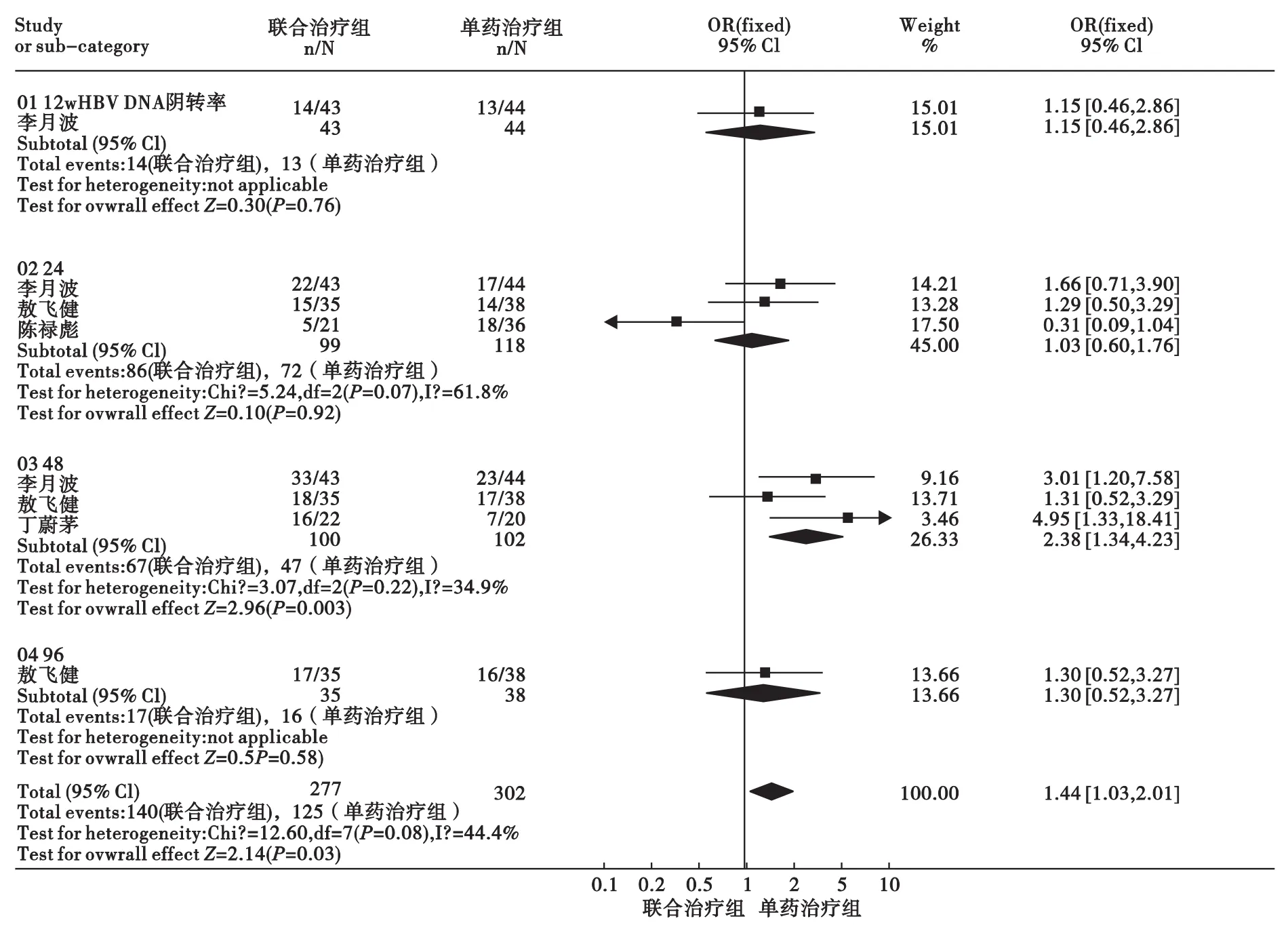
图3 Peg-IFN α-2a联合ADV与Peg-IFN α-2a治疗CHB的HBeAg转阴率比较Meta分析结果
3.3 sAg阴转率或血清转换率 Peg-IFN α-2a联合ADV与Peg-IFN α-2a治疗CHB的sAg阴转率或血清转换率比较见图4。治疗48周:仅纳入1个研究[14],结果显示,两组差异无统计学意义[OR=0.53,95%CI(0.05,6.11)]。治疗 72 周:仅纳入1个研究[13],结果显示,两组差异无统计学意义[OR=3.10,95%CI(0.12,79.23)]。将所有上述不同治疗时间研究结果汇总,结果显示,研究间无统计学异质性(P=0.39,F=0%),采用固定效应模型分析,合并分析结果显示,两组差异无统计学意义[OR=1.05,95%CI(0.18,6.30)]。
3.4 ALT复常率 Peg-IFN α-2a联合 ADV与Peg-IFN α-2a治疗CHB的HBV DNA阴转率比较见图5。治疗24周:共纳入3个研究[13-15],研究间无统计学异质性(P=0.19,F=40.4%),采用固定效应模型分析,合并分析结果显示,治疗组优于对照组,差异有统计学意义[OR=2.03,95%CI(1.12,3.69)]。治疗 48周:共纳入 3个研究[13-14,16],研究间无统计学异质性(P=0.74,F=0%),采用固定效应模型分析,合并分析结果显示,治疗组优于对照组,差异有统计学意义[OR=2.23,95%CI(1.16,4.27)]。治疗72 周:仅纳入 1个研究[13],结果显示,两组差异无统计学意义[OR=1.00,95%CI(0.34,2.93)]。治疗 96 周:仅纳入1个研究[14],结果显示,两组差异无统计学意义[OR=0.98,95%CI(0.38,2.50)]。将所有上述不同治疗时间研究结果汇总,结果显示,研究间无统计学异质性(P=0.41,F=2.9%),采用固定效应模型分析,合并分析结果显示,治疗组优于对照组,差异有统计学意义[OR=1.71,95%Cl(1.18,2.48)]。
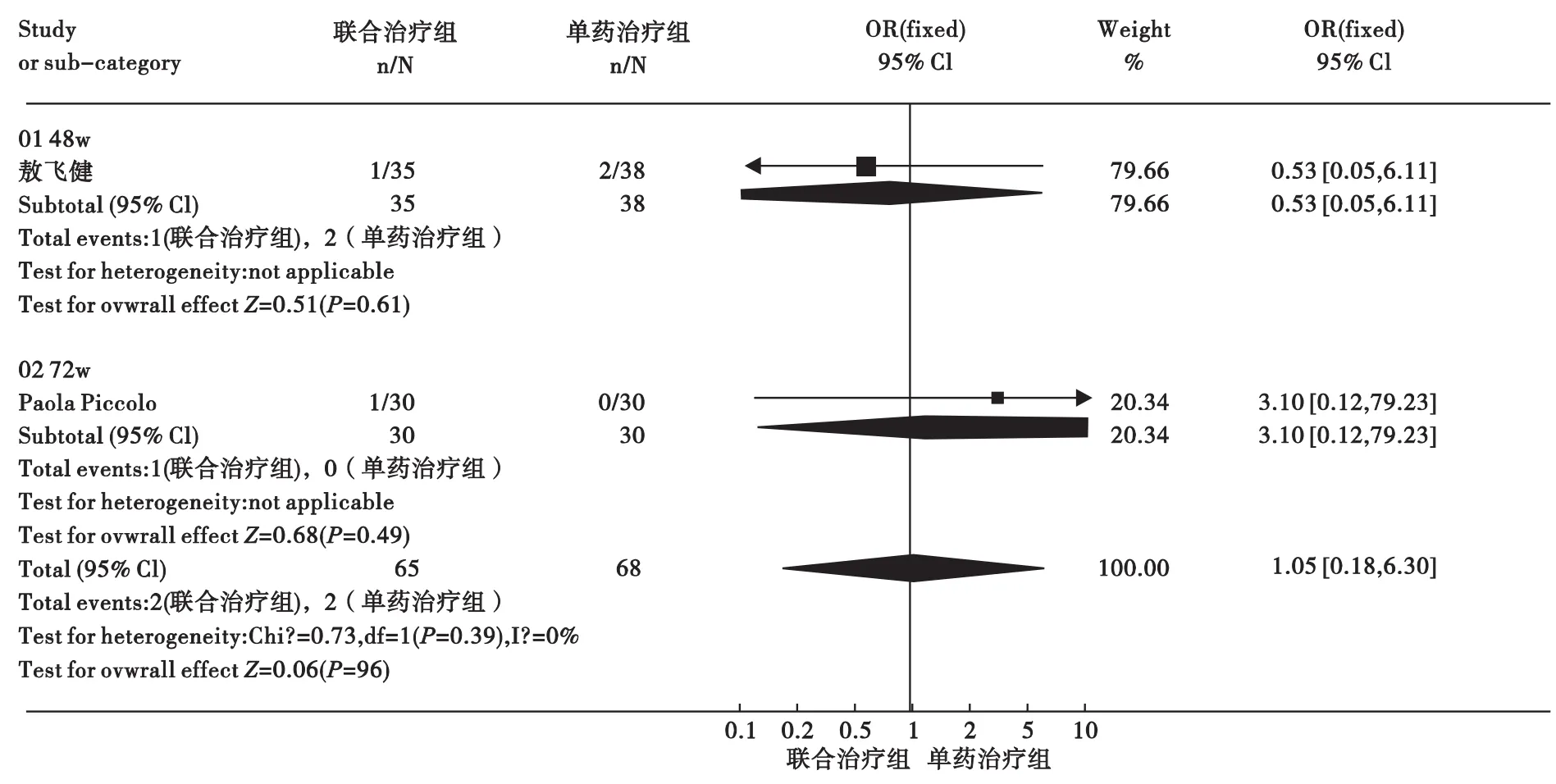
图4 Peg-IFN α-2a联合ADV与Peg-IFN α-2a治疗CHB的sAg阴转率或血清转换率比较Meta分析结果

图5 Peg-IFN α-2a联合ADV与Peg-IFN α-2a治疗CHB的ALT复常率比较Meta分析结果
3.5 肝组织学改善率 Peg-IFN α-2a联合ADV与Peg-IFN α-2a治疗CHB的肝组织学改善率见图6。该比较仅纳入1个研究[17],结果显示两组差异有统计学意义[WMD=-4.10,95%CI(-6.73,-1.47)]。
3.6 安全性 Peg-IFN α-2a联合ADV与Peg-IFN α-2a治疗CHB的安全性比较见图7。实验室指标异常:共纳入 3 个研究[13-14,17],研究间无统计学异质性(P=0.76,F=0%),采用固定效应模型分析,合并分析结果显示,两组差异无统计学意义[OR=0.95,95%CI(0.42,2.15)]。临床不适症状:共纳入 3 个研究[13-14,17],研究间无统计学异质性(P=0.90,F=0%),采用固定效应模型分析,合并分析结果显示,治疗组优于对照组,差异有统计学意义[OR=1.21,95%CI(0.69,2.10)]。因副作用严重而停药或失访率:共纳入 3 个研究[13-14,17],研究间无统计学异质性(P=0.65,F=0%),采用固定效应模型分析,合并分析结果显示,治疗组多于对照组,差异有统计学意义[OR=1.31,95%CI(0.44,3.90)]。药物剂量调整率:共纳入2个研究[13-14],研究间无统计学异质性(P=0.93,F=0%),采用固定效应模型分析,合并分析结果显示,两组差异无统计学意义[OR=0.74,95%CI(0.27,2.00)]。将所有上述不同治疗时间研究结果汇总结果分析湿示,研究间无统计学异质性(P=0.99,F=0%),采用固定效应模型分析,合并分析结果显示,两组差异无统计学意义[OR=1.07,95%CI(0.73,1.58)]。
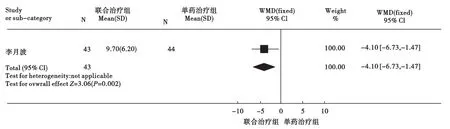
图6 Peg-IFN α-2a联合ADV与Peg-IFN α-2a治疗CHB的肝组织学改善率比较Meta分析结果

图7 Peg-IFN α-2a联合ADV与Peg-IFN α-2a治疗CHB的安全性比较Meta分析结果
4 讨论
在慢性乙型肝炎抗病毒治疗中,根据药物作用机制不同、作用位点不同和机体的免疫状态联合用药,以协同发挥多种药物的特点和优势,达到提高疗效的目的,是目前诸多临床工作者探索的理想方法之一[19-20]。研究表明[21],Peg-IFN α-2a联合ADV抗CHB治疗正是通过从RNA、DNA不同水平同时抗病毒,并调节机体免疫功能,使ADV降低HBV DNA的速度与Peg-IFN α-2a激发的体内免疫的程度相匹配,从而最大限度抑制病毒复制,减少病毒基因变异和多重耐药的机会,提高机体抗病毒的特异性免疫,加强肝脏细胞的抗病毒能力,争取彻底消除体内残留HBV,防止复发。本研究遵循循证医学相关研究原则,采用荟萃分析,对收集到的2011年8月以前Peg-IFN α-2a联合ADV治疗CHB的临床随机对照实验的有效性和安全性进行合并定量分析,提高了统计检验效能,为临床实践和决策提供了比单个研究更为可靠的证据。
本研究基于共包括328例患者的5个随机对照试验进行Meta分析。结果显示,与单药Peg-IFN α-2a治疗CHB相比,Peg-IFN α-2a联合ADV可明显提高HBV DNA的阴转率、eAg阴转率或血清转换率、ALT复常率、肝组织学改善率,具有较高的病毒抑制作用,且安全性好,但两者均不能达到满意的sAg阴转率或血清转换率。
本研究的不足之处在于纳入文献数量相对少,部分研究纳入的RCT样本量较少,无明确样本量计算依据,多中心、大规模的随机试验较为少见。有些研究仅限于早期疗效的评价,未深入随访;有些虽然进行了随访,但随访时间范围差别较大,大多没有描述失访和脱落人数及原因,有可能导致失访偏倚。在纳入的5篇文献中,4项研究未具体描述随机化方法,使判断试验方法学是否充分、分配方案隐藏是否完善更困难。分配方案隐藏不完善则无法确定该试验中选择性偏倚的情况,有可能导致夸大治疗效果。所有研究在与对照组的比较中,均未报道是否使用盲法,因此可能存在相应的测量偏倚。此外,本评价未检索到除中文、英语外其他语种的随机对照研究,可能造成分布偏倚。该研究的结局指标HBV DNA阴转率、eAg阴转率或血清转换率、sAg阴转率或血清转换率、ALT复常率、肝组织学改善率等客观实验室检测指标,因而存在测量性偏移的可能性较小。
综上所述,Peg-IFN α-2a联合ADV治疗CHB对改善病毒学应答、生化学应答及组织学可能有效,且无严重的不良反应,并且耐药变异率低,可作为慢性乙型肝炎的治疗选择之一。但由于本系统评价纳入文献用药时间不同,更长期的疗效及安全性还不明确,因此,无法进行总体的效应合并分析。对整体效果还需要更为大量的文献支持,同时,因纳入文献存在选择性偏倚和测量性偏倚的可能,势必影响结果的强度,因此还需多中心、长期随访、更严格实施的RCT进一步深入研究。
[1]Lok AS,McMahon BJ.Chronic hepatitis B:update of recommendations[J].Hepatology,2004,39(3):857-861.
[2]Lai CL,Ratziu V,Yuen MF,et al.Viral hepatitis B[J].Lancet,2003,362(9401):2089-2094.
[3]陈炎,陈亚蓓,陶荣芳.慢性乙型肝炎的研究进展[J].中国医药,2011,6(4):500-502.
[4]Manesis EK,Hadziyannis SJ.Interferon alpha treatment and retreatment of hepatitis B e antigen-negative chronic B hepatitis[J].Gastroenterology,2001,121:101-109.
[5]Marcellin P.Bonino F,Lau GK,et a1.Sustained of response of hepatitis B e antigen-negative patients 3 years after treatment with peginterferon alpha-2a[J].Gastroenterology,2009,136:2169-2179.
[6]Marcellin P,Chang TT,Lim SG,et a1.Long-term efficacy and safety of adefovir dipivoxil for the treatment of hepatitis B e antigen-posrive chronic hepatitis B[J].Hepatology,2008,48:750-758.
[7]Hadziyanllis SJ,Tassopoulos NC,Heathcote EJ,et a1.Longterm therapy with adefovir dipivoxil for HBeAg-negative chronic hepatitis B[J].N Engl J Med,2005,352:2673-268.
[8]万谟彬,翁心华.干扰素治疗慢性乙型肝炎专家建议(2010年更新)[J].中华传染病杂志,2010,28(4):193-200.
[9]Lau GK,Piratvisuth T,Luo KX,et a1.Peginterferon Alfa-2a,lamivudine,and the combination for HBeAg-positive chronic hepatitis B[J].N Engl J Med,2005,352:2682-2695.
[10]Canada H.Risk of peripheral neuropathy in patients treated with telbivudine(SEBIVO)and interferon-For Health Professionals.http://www.hc-sc.gc.ca/dhp-mps/medeff/advisories-avis/prof/-2008/sebivo-hpc-cps-eng.php.
[11]Ingiliz P,Valantin MA,Thibault V,et a1.Efficacy and safety of adefovir dipivoxil plus pegylated interferon-alpha2a for the treatment of lamivudine-resistant hepatitis B virus infection in HIV-infected patients[J].Antivir Ther,2008,13(7):895-900.
[12]Bart T,Valeska T,Hans Z,et a1.Intrahepatic response markers in chronic hepatitis B patients treated with peginterferon alpha-2a and adefovir[J].Journal of Gastroenterology and Hepatology,2011,26:1527-1535.
[13]Piccolo P,Lenci I,Demelia L,et al.A randomized controlled trial of pegylated interferon-alpha2a plus adefovir dipivoxil for hepatitis B e antigen-negative chronic hepatitis B[J].Antivir Ther,2009,14(8):1165-1174.
[14]敖飞健,马为民,周伯平.聚乙二醇干扰素 α-2 a、阿德福韦酯酯单用及联合应用治疗HBeAg阳性慢性乙型肝炎患者的疗效及安全性比较[J].中华传染病杂志,2010,28(4):214-217.
[15]陈禄彪,舒欣,揭育胜,等.聚乙二醇干扰素α-2a加用阿德福韦酯酯治疗HBeAg阳性慢性乙肝的短期疗效观察[J].中华实验和临床病毒学杂志,2010,24(1):39-41.
[16]丁蔚茅.长效干扰素联合阿德福韦酯治疗慢性乙型肝炎22例疗效观察[J].中国现代药物应用,2010,11:164-165.
[17]李月波,马桂芹,许蕾,等.PegIFNα-2a联合阿德福韦酯治疗HBeAg阳性慢性乙型肝炎的临床疗效观察[J].中华临床感染病杂志,2008,1(3):168-170.
[18]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].中华肝脏病学杂志,2011,19(1):13-24.
[19]Wursthorn K,Lutgehetmann M,Dandri M,et al.Peginterferon alpha-2b plus adefovir induce strong cccDNA decline and HbsAg reduction in patients with chronic hepatitis B[J].Hepatology,2006,44(3):675-684.
[20]孙海霞,曾红,张卡,等.HBV抗原定量对干扰素联合阿德福韦酯治疗HBeAg阳性慢乙肝的疗效预测[J].中华实验与临床病毒学杂志,2011,25(2):132-134.
[21]窦晓光,徐道振,翁心华.当前聚乙二醇干扰素治疗慢性乙型肝炎的热点与难点[J].中华传染病杂志,2010,28(4):201-203.
