大黄鱼选育群体与普通养殖群体部分免疫指标的比较
2012-10-13杨启莲姚翠鸾王志勇
杨启莲, 姚翠鸾, 王志勇
(集美大学 水产学院, 农业部东海海水健康养殖重点实验室, 福建 厦门 361021)
大黄鱼(Larimichthys crocea)在分类上属鲈形目(Perciformes)、石首鱼科(Sciaenidae)、黄鱼属(Larimichthys), 为暖水性近距离洄游鱼类, 是中国特有的海水养殖鱼类之一。20世纪80年代中期, 大黄鱼人工繁殖在福建省首获成功, 90年代初开始进行全人工养殖, 从90年代中期开始迅速发展成为中国养殖量最大的海水鱼和最具优势出口养殖水产品之一。但是经过多代的人工养殖, 由于近亲繁殖、种质退化, 人工繁殖和育苗过程中不科学的操作等原因, 导致了苗种质量下降, 大黄鱼养殖群体普遍出现了生物学性状退化现象, 表现在抗病力/抗逆性下降、生长速度变慢等方面[1-2]。另外, 由于养殖密度过高、养殖环境恶化, 导致近年来频发养殖大黄鱼大规模病害, 且其程度呈逐年加重趋势, 严重制约着大黄鱼养殖产业的发展[3-4]。
培育高产、抗病优良品种在海水经济鱼类养殖业的可持续发展中具有重要意义, 也得到了科学工作者的广泛关注。陈松林等[5-6]采用人工感染鳗弧菌(Vibrio anguillarum)的策略结合家系选育, 筛选出牙鲆(Paralichthys olivaceus)和半滑舌鳎(Cynoglossus semilaevis)的抗病家系, 在鳗弧菌感染后的成活率均大幅度提高, 为后续优良品种的选育奠定了良好的基础。针对大黄鱼养殖中出现的种质退化问题, 本课题组从2001年开始进行大黄鱼品种选育研究, 以从福建省宁德市官井洋海区采捕驯养的闽粤东族大黄鱼原种为亲本, 采用群体选择的方法、结合人工雌核发育促进基因纯合技术进行大黄鱼遗传改良, 经连续5代选育, 培育出“闽优1号”大黄鱼新品种, 具有生长快、抗逆性较强、养殖成活率高的优良特点。但是, 对于培育的大黄鱼抗病免疫的详细机制尚不清楚。
因此, 本研究选取白细胞吞噬活性、血清溶菌酶活性、血清杀菌活力、血清和血细胞SOD活力及白蛋白等鱼类的重要免疫指标, 对“闽优1号”和普通养殖大黄鱼群体进行比较分析, 以期了解大黄鱼的抗病免疫特性, 为大黄鱼优良品种的进一步选育提供参考资料和理论依据。
1 材料和方法
1.1 非特异性免疫指标检测分析
1.1.1 试验用鱼
试验于2010年夏季在福建省宁德市横屿岛水产有限公司育苗场进行。“闽优1号”大黄鱼取自该公司渔排, 系本研究团队2010年春季繁育的F5, 在海区养殖4个月, 平均体质量为7.53 g±1.67 g, 体长为7.15 cm±0.66 cm。对照组为在同样日龄和同样环境下养殖而成的未经选育的大黄鱼, 平均体质量 6.67 g±1.8 g, 体长7.33 cm±0.69 cm, 在室内暂养3 d后进行实验。暂养期间, 24 h不间断充气, 温度29±1℃,盐度为 21~22, pH 为 8.1~8.2, 光照为 500~1500 lx,每天换水1/2。
1.1.2 样品制备
随机选取“闽优 1号”和非选育组的实验大黄鱼各10尾, 以丁香酚麻醉。用无菌注射器从尾静脉取血, 将其血液混合, 置于灭菌的EP管中作为1个样品组。一部分抗凝全血处理后用于大黄鱼白细胞吞噬活力的分析; 另一部分不加抗凝剂的全血置于4℃冰箱中静置4 h, 待其凝血后于4℃离心, 分离血清和血细胞, 备用于后续实验分析。实验设3个平行组。
1.1.3 总蛋白含量测定
蛋白浓度的测定采用Bradford[7]法。以牛血清白蛋白为标准品, 绘制标准曲线, 根据标准曲线测得样品的蛋白质含量。
1.1.4 白细胞吞噬活性检测
白细胞的吞噬能力从吞噬细胞率和吞噬指数两个方面进行测定和比较, 具体参照 Martello[8]方法测定。在EP管中加入2 mL51%Percoll细胞分离液(包有乙烯吡咯烷酮的硅胶颗粒混悬液 GE Healthcare,17-5445-02), 轻轻滴入1 mL含抗凝剂的血样, 4℃、320g离心30 min。然后吸取Percoll液面上的白细胞层, 以HBSS缓冲液离心洗涤3次, 并将所得白细胞以HBSS稀释至2×107个/mL。然后使用台盼蓝检测活细胞数目的百分比, 确保活细胞数在90%以上。取100 μL浓度为1×107个/mL白细胞悬液滴片, 放入湿盒中, 于25 ℃下静置20 min, 滴加100 μL浓度约为 1×108个/mL的酵母细胞悬液(浓度约为白细胞浓度的10倍), 置于25℃湿盒中孵育。45 min后取出玻片用灭菌生理盐水冲洗后自然风干, 用甲醇固定5 min, 待甲醇全部挥发后用Gimsa染液染色15~20 min, 再用灭菌生理盐水反复冲洗, 风干后置于光镜下观察, 记录吞噬细胞率及吞噬指数。
吞噬细胞率=参与吞噬的细胞数/计数细胞总数×100%
吞噬指数=平均每个细胞吞噬的细菌数
1.1.5 血清溶菌酶的活性的检测
采用 Wilson[9]的方法稍加修改: 溶壁微球菌溶于50 mmoL/L pH为6.2的PBS溶液, 终浓度为1×108个/mL; 在96孔板中各加入待测的大黄鱼血清10 μL,然后加入200 μL的PBS新鲜稀释好的菌悬液, 迅速混匀, 30 s后, 于25℃, 570 nm下分别测定其在0.5 min 时的光吸收值(A0)和 4.5 min时的光吸收值(A),每个样品重复 3次, 酶活力以每毫克血清蛋白每分钟A570值下降0.001为一个活力单位。
1.1.6 血清杀菌活性检测
以大肠杆菌(Escherichia coli)为底物, 参照王雷等[10]使用的方法进行测定。将底物用 50 mmoL/L pH6.2的PBS稀释大肠杆菌至A570为0.3~0.5; 取3.0 mL该菌悬液与50 μL待测血清于试管中混匀, 测定其在570 nm处的光密度值A0, 然后将试管置于37℃水浴保温30 min, 然后取出立即置于冰浴中10 min以终止反应, 测定其保温后的A值。抗菌活力Ua按下式计算:Ua= [(A0–A)/A]1/2。
1.1.7 SOD酶活检测
大黄鱼血清和红细胞中的SOD活力测定采用黄嘌呤氧化酶法。实验采用超氧化物歧化酶测定试剂盒(南京建成生物工程研究所), 具体操作按照说明书进行。
血清中总 SOD酶活力定义: 每毫升反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U)。计算公式: 总 SOD 活力(U/mg蛋白质)=(对照管吸光度–测定管吸光度)÷对照管吸光度÷50%×反应体系稀释倍数×样本测试前的稀释倍数。
红细胞中SOD酶活力定义: 全血中每克血红蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U)。计算公式: 红细胞中SOD酶活力(U/gHb)=(对照管吸光度–测定管吸光度)÷对照管吸光度÷50%×反应液体积×(抽提液总量/测定抽提液量)×(1 mL/采血量)÷血红蛋白含量(gHb/mL)
1.1.8 免疫球蛋白和白蛋白含量测定
血清中免疫球蛋白含量的测定参考 László的方法[11]。100 μL血浆加入 100 μL 12%的PEG(聚乙二醇),室温23~25℃, 振荡孵育2 h, 然后 3 000g离心15 min, 去上清后检测蛋白含量。血清白蛋白含量采用溴甲酚绿法, 实验使用南京建成生物工程研究所生产的白蛋白测试盒按照产品说明书的步骤进行测定。
1.2 攻毒实验
1.2.1 实验用副溶血弧菌
攻毒实验所用的副溶血弧菌(V. parahaemolyticus)为从发病大黄鱼体内分离鉴定出的病原菌。菌株接种于含2%NaCl的琼脂培养基, 28℃培养24 h, 用灭菌的0.85%生理盐水洗脱菌落, 经比浊法计数, 调整浓度至1×108个/mL, 用于攻毒实验。
1.2.2 攻毒实验
随机抽取课题组选育的“闽优 1号”和非选育群体大黄鱼各120尾, 置于0.5 t养殖桶中在室内进行攻毒实验; 对每尾实验鱼腹腔注射200 μL(浓度为1×108个/mL)的副溶血弧菌进行感染[12], 并记录攻毒8 d时两个群体大黄鱼的死亡情况, 对照组注射同等剂量的生理盐水。
1.3 数据统计与处理
试验数据用 SPSS(15.0)数据分析软件处理, 采用Excel作图和t-检验差异分析方法, 结果以平均值±标准差(x±s)表示。
2 结果
2.1 白细胞吞噬活性
白细胞吞噬活性检测结果表明, 非选育群体大黄鱼的吞噬细胞的百分数为(42±2.488)%, 吞噬指数为 1.13±0.21; 选育群体大黄鱼吞噬细胞的吞噬百分数为(49±2.67)%, 吞噬指数为 1.27±0.33; 选育群体的白细胞吞噬活性及吞噬细胞百分数略高于非选育群体(图 1)。
2.2 血清溶菌酶活性及血清杀菌活性测定
选育群体大黄鱼的血清溶菌酶活性为(3.197±0.793)U, 非选育群体大黄鱼的血清溶菌酶活性为(0.504±0.065)U, 分析表明选育组大黄鱼的血清溶菌酶活性显著高于非选育组(P<0.05), 如图 2A所示。对两组大黄鱼的血清杀菌活性检测结果如图2B所示, 选育群体大黄鱼的血清杀菌活性为(0.40±0.04)U, 非选育组大黄鱼的血清杀菌活性为(0.32±0.03)U, 选育组血清杀菌活性高于对照组。
2.3 SOD酶活性的差异

图1 选育群体与非选育群体大黄鱼白细胞吞噬活性Fig. 1 The phagocytosis of leukocytes from large yellow croaker

图2 选育群体与非选育群体大黄鱼血清中溶菌酶及杀菌活性A. 血清溶菌酶活性; B. 血清杀菌活性; *. 选育群体与非选育群体之间存在显著性差异(P<0.05)Fig. 2 The lysozyme and bactericidal activity in serum of large yellow croakerA. The lysozyme activity in serum; B. The bactericidal activity in serum; *. Significant difference between two groups (P < 0.05)
选育群体和非选育群体血清与血细胞中SOD酶活性测定值分别见图3A和图3B。选育群体大黄鱼血清中的 SOD 活力为(25.6±0.78)U, 血细胞中的SOD 活力为(1.23±0.6442)×107U; 非选育群体大黄鱼血清中的 SOD 活力为(22.9±1.6)U, 血细胞中的SOD 活力为(6.72±0.371)×106U。分析显示, 选育群体血清SOD活力高于非选育群体, 但是未达到显著性水平(P>0.05); 选育群体大黄鱼血细胞中 SOD 活力(1.23×107U)显著高于对照组(6.72×106U)(P<0.05)。

图3 选育群体与非选育群体大黄鱼血清及血细胞中SOD活力Fig. 3 The SOD activities in serum and blood cells of large yellow croaker
2.4 免疫球蛋白和白蛋白的含量
两组大黄鱼血清免疫球蛋白和白蛋白含量检测结果如图 4所示。选育组大黄鱼的血清白蛋白含量为(1.53±0.01)g/L, 血清免疫球蛋白含量为(0.28±0.01)g/L; 非选育组大黄鱼血清白蛋白含量为(1.32±0.011)g/L, 血清中免疫球蛋白含量为(0.40±0.015)g/L; 选育组血清白蛋白含量高于对照组, 但是免疫球蛋白含量略低于对照组。
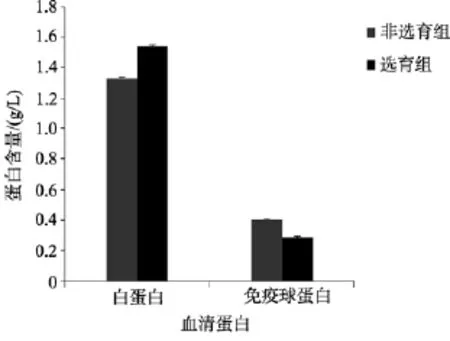
图4 选育群体与非选育群体大黄鱼血清中免疫球蛋白和白蛋白含量Fig. 4 The immunoglobulin and albumin levels in serum of large yellow croaker
2.5 攻毒后大黄鱼的累积死亡率
注射生理盐水的对照组大黄鱼在 8 d之内未出现死亡; 采用副溶血弧菌攻毒后, 选育组与非选育组大黄鱼都不同程度地出现了红斑溃疡、腐烂等症状, 到第8天, 非选育组大黄鱼累积死亡数为43尾,累积死亡率为 35.6%, 选育组大黄鱼累积死亡数为37尾, 累积死亡率为30.8%, 选育群体大黄鱼存活率高于非选育群体。
3 讨论
鱼类的免疫系统由免疫器官、免疫细胞和体液免疫因子组成, 是鱼体抵抗病原入侵的机构, 同时也是产生免疫应答的物质基础[13]。近年来, 由于非特异性免疫系统在应对病原侵袭过程中的快速反应,而引起了研究者的重视。鱼类作为低等脊椎动物, 在抵抗入侵病原微生物的过程中, 非特异性免疫防御系统扮演着重要角色, 该系统主要由参与免疫反应的血液和体液因子组成, 在众多的免疫因子中, 白细胞吞噬活性、溶菌酶、血清杀菌活性、SOD活力等指标的高低常被用作衡量鱼类免疫力高低的参照指标[14-15]。
鱼类的白细胞是非特异性防御系统的重要组成部分, 在宿主防御抵抗微生物感染的各个阶段发挥重要作用[16]。在鱼类抵御外界病原侵袭的过程中, 它们能被病原微生物的有害产物激活, 并产生更多有效的抗异源微生物因子[13]。迄今, 吞噬细胞的吞噬或杀伤功能得到了广泛研究, Chung等[17]研究表明, 鱼类的巨噬细胞具有杀伤细菌和寄生虫幼虫的作用。本研究发现选育的闽优 1号大黄鱼群体白细胞吞噬率及吞噬指数略高于非选育组, 但是差异不显著(P>0.05), 需要对其与抗病力的相关关系进一步研究并验证, 进而指导选育工作。
溶菌酶是一种水解酶, 主要存在于血清和巨噬细胞中, 它通过水解革兰氏阳性细菌细胞壁的 β-1,4糖苷键而杀灭病原菌, 使鱼类获得相应的保护[18]。因此, 溶菌酶活力与机体的免疫水平密切相关。血清中存在多种活性的抗菌肽等杀菌因子, 它们具有抗菌谱广的特性, 可以杀灭多种病原菌, 特别是在抵御革兰氏阴性细菌的感染中具有重要作用。本研究表明, 选育组大黄鱼血清溶菌酶活性高于普通选育群体, 推测溶菌酶杀菌系统在选育组中具有更强的活力。
SOD是机体内非常重要的抗氧化酶, 在清除自由基、防治生物分子损伤等方面有十分重要的作用[19]; 研究还表明, SOD活力与生物机体的免疫水平密切相关[20]。实验结果显示, 选育群体大黄鱼血细胞SOD活力显著高于普通养殖群体, 而血清中SOD活力在2个群体中没有显著差异。迄今, 在真核生物体中发现的 SOD主要有 3个类型, 即细胞型CuZnSOD, 线粒体型MnSOD和胞外SOD[21]。本研究结果提示可能选育群体血细胞中存在的细胞型SOD高于非选育群体, 而血清中的胞外SOD活力差异不明显, 但是具体机制还有待于深入研究。
白蛋白由肝脏合成, 其生理功能包括营养作用、排除体内的有毒物质和游离脂肪酸的运输等, 因而在维持机体健康中起着重要作用[22]。鱼类已经具备了初级特异性免疫系统, 其中, 免疫球蛋白由淋巴细胞产生, 在鱼类疾病防御方面尤其是特异性免疫过程中有重要作用。Siwicki等[23]首次将血清中免疫球蛋白含量作为评价鱼类免疫功能的指标。另外,Adham等[24]以血清蛋白、白蛋白和免疫球蛋白的含量变化作为检测环境对鱼类健康影响的免疫指标。Rehulka等[25]研究表明, 血浆白蛋白的含量水平在一定程度上可以作为健康鱼体的良好生理状态的一个很好的指标。本研究显示, 无论是选育组还是非选育组, 白蛋白都是血清总蛋白的主要成分, 与金头鲷(Sparus aurata)中的研究结果类似[26]。推测在正常状态下, 白蛋白对于大黄鱼维持健康状态可能起着非常重要的作用。另外, 本研究发现选育组大黄鱼免疫球蛋白含量低于普通养殖群体, 由于免疫球蛋白的形成通常是机体感病几周后才能形成, 本研究结果是否暗示对照组在试验之前曾经受到病原体感染导致?还需要进一步研究证实。
副溶血弧菌攻毒后, 对选育大黄鱼和普通养殖群体的死亡率观察表明, 选育组在8 d内的累积死亡率明显低于非选育群体。同时, 选育群体较高的血清溶菌酶活性及血细胞SOD活力同样支持攻毒实验的累积死亡率的结果。所以, 作者推测选育组较低的累积死亡率与机体的非特异性免疫力可能更为密切, 这也与Anderson[27]的研究结果相似。推测非特异性免疫力在鱼类的抗病免疫的初期发挥着更重要的作用。
本研究通过对选育群体及普通养殖群体大黄鱼部分重要免疫因子进行比较与分析, 结果表明, 选育大黄鱼的非特异性免疫力普遍高于普通养殖群体,病原菌感染后短期内的死亡率低于对照组, 而特异性免疫指标低于对照组, 提示与特异性免疫相比,非特异性免疫在鱼类防病、抗病的初期可能起着重要作用, 为鱼类育种工作的深入开展提供了一定理论依据, 但是人工感染后大黄鱼的死亡率与免疫指标之间的相关关系还需要进一步研究。
[1]李明云, 赵明忠, 林允闯. 闽-粤东族大黄鱼象山港养殖群数量与质量性状的研究[J].现代渔业信息,2011, 16(12): 6-9.
[2]王清印. 海水养殖业的可持续发展: 挑战与对策[M].北京: 海洋出版社, 2007: 242-245.
[3]王小平. 闽东大黄鱼养殖业现状及其发展对策[J].福建水产, 2000, 2: 52-57.
[4]谢书秋, 刘振勇. 闽东大黄鱼养殖现状分析与发展对策[J]. 福建水产, 2006, 3: 95-97.
[5]陈松林, 田永胜, 徐田军, 等. 牙鲆抗病群体和家系的建立及其生长和抗病性能初步测定[J].水产学报,2008, 32(5): 665-673.
[6]陈松林, 杜民, 杨景峰, 等. 半滑舌鳎家系建立及其生长和抗病性能测定[J]. 水产学报, 2010, 34(12):1789-1794.
[7]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72 (1-2): 248-254.
[8]Martello L B, Friedman C S, Tjeerdema R S. Combined effects of pentachlorophenol and salinity stress on phagocytic and chemotactic function in two species of abalone[J]. Aquatic Toxicology, 2000, 49: 213-225.
[9]Wilson R, Ratcliffe N A. Effect of lysozyme on the lectin-mediated phagocytosis ofBacillus cereusby haemocytes of the cockroach,Blaberus discoidalis[J].Journal of Insect Physiology, 2000, 46: 663-667.
[10]王雷, 李光友, 毛远兴, 等. 口服免疫型药物对养殖中国对虾病害防治作用的研究[J].海洋与湖沼, 1994,25(5): 486-492.
[11]László A, Guojun Y, Pao X,et al. Chinese herbs (Astragalus membranaceusandLonicera japonica)and boron enhance the non-specific immune response of Nile tilapia(Oreochromis niloticus)and resistance againstAeromonas hydrophila[J]. Aquaculture, 2008, 275: 26-33.
[12]Yao C L, Kong P, Wang Z Y, et al.Cloning and expression analysis of two alternative splicing toll-like receptor 9 isoforms A and B in large yellow croaker,Pseudosciaena crocea[J]. Fish & Shellfish Immunology, 2008, 25(5): 648-656.
[13]唐玫, 马广智, 徐军. 鱼类免疫学研究进展[J].免疫学杂志, 2002, 18(3): 112-116.
[14]Ai Q H, Mai K S, Tan B P. Effects of dietary vitamin C on survival, growth, and immunity of large yellow croaker,Pseudosciaena crocea[J]. Aquaculture, 2006,261: 327–336.
[15]Jian J C, Wu Z H. Effects of traditional Chinese medicine on nonspecific immunity and disease resistance of large yellow croaker,Pseudosciaena crocea(Richardson)[J]. Aquaculture, 2003, 218: 1-9.
[16]Olivier G., Eaton C A, Campbell N. Interaction betweenAeromonas salmonicidaand peritoneal macrophages of brook trout (Salvelinus fontinalis)[J]. Vet Immunol Immunopathol, 1986, 12: 223-234.
[17]Chung C, Secombes C J. Activation of rainbow trout macrophages [J]. J Fish Bio, 1987, 31: 51-56.
[18]Bayne C J, Gerwick L. The acute phase response and innate immunity of fish[J]. Dev Comp Immunol, 2001.25: 725-743.
[19]魏俊发, 俞贤达, 金道森. 锰超氧化物歧化酶及其化学模拟研究[J]. 化学进展, 1997, 9: 14-21.
[20]Chiu S H, Tsai R T, Hsu J P, et al. Dietary sodium alginate administration to enhance the non-specific immune responses, and disease resistance of the juvenile grouperEpinephelus fuscoguttatus[J]. Aquaculture, 2008,227: 66-72.
[21]李益新. 超氧化物歧化酶的结构与功能[J]. 生物化学与生物物理进展, 1985, 63(3): 15-21.
[22]Gras J. Proteinas plasmaticas: Fisicoquimica. metabolismo. fisiopatologia y clinica de las proteinas extracelulares[M]. Barcelona: Jims, 1967: 137-386.
[23]Siwicki A K, Anderson D P, Waluga J. Fish Disease Diagnosis and Prevention Methods [M]. Poland:Olsztyn, 1993: 105-112.
[24]Adham K G, Kheirallah A, Abou-Shabana A N, et al.Environmental stress in Lake Maryut and physiological response ofTilapia zilliiGerv.[J]. Environ Sci Health(Part A), 1997, 32:2585-2598.
[25]Rehulka J. Erythrodermatitis of carp (Cyprinus carpio):An electrophoretic study of blood serum protein fraction levels[J]. Acta Vet Brno, 1993, 62(3-4): 187-197.
[26]Sala-Rabanal M, Sanchez J, Ibarz A, et al. Effects of low temperatures and fasting on hematology and plasma composition of gilthead seabream (Sparus aurata)[J]. Fish Physiol Biochem, 2003, 29: 105-115.
[27]Anderson D P. Immunostimulants, adjuvants and vaccine carrier in fish: application to aquaculture[J]. Annu Rev Fish Dis, 1992, 2: 281-307.
