一株底栖硅藻——双眉藻的优化培养
2012-10-13周一春胡超群彭鹏飞张吕平
周一春, 胡超群, 彭鹏飞, 罗 鹏, 张吕平
(1. 中国科学院 南海海洋研究所, 广东 广州 510301; 2. 中国科学院 研究生院, 北京100049)
海洋底栖硅藻是鲍、海参和海胆等名贵水产动物苗种生产中的重要饵料, 是影响幼苗成活率和质量的关键因素之一[1-2]。与鲍的人工育苗相似, 在海参人工育苗中, 底栖硅藻影响海参幼虫的附着与变态, 并且海参育苗成功与否、产量的高低与底栖硅藻的数量与质量有着直接的关系。目前, 北方仿刺参(Apostichopusjaponicus)的繁育及养殖技术已经成熟,但热带海参人工繁殖和养殖才则刚刚起步, 热带海参的营养需要及繁育中适合的饵料种类研究均处于空白状态, 制约了热带海参养殖业的发展[3-4]。
在硅藻的大规模培养中, 氮、磷、硅营养元素质量浓度和配比以及盐度、光照、温度等物理因子被认为是影响硅藻生长的重要因子, 不同的培养条件对底栖硅藻的种群结构及其生物量影响显著[5-6]。同时有研究表明营养元素比例的微小变动会导致原环境代表种类相对丰度的显著改变[7-8]。此外, 底栖硅藻种类丰富多样, 分布广泛, 生存环境差异甚大, 一种固定的标准化培养液(如传统的“f/2”培养液)并不能满足众多单种底栖硅藻的快速生长的营养需求[9]。因此研究底栖硅藻的最适培养条件对底栖硅藻的规模培养, 获得优质饵料具有重要的指导意义和应用价值。
作者从西沙永兴岛附近海域分离到一株底栖硅藻—双眉藻(Amphorasp.), 经海参养殖实践证实该种硅藻是糙刺参(Stichopus horrens)喜食的优良饵料。本文首先探讨温度、盐度、光照和不同质量浓度的氮、磷、硅盐对Amphorasp.生长的影响, 并进一步研究氮、磷、硅三种营养盐多因子组合对其生长的影响, 以期确定Amphorasp.最佳培养条件, 为热带海参的底栖硅藻饵料的进一步研究及应用提供了理论依据。
1 材料与方法
1.1 藻种来源
实验所用藻种采自西沙永兴岛附近海域, 通过富集培养, 分离并纯化得到。借助光镜和电镜技术,研究了该藻的形态学特征, 并通过18S rDNA和5.8S rDNA-ITS序列, 对这株藻进行了多相分类鉴定, 判定该藻属于桥弯藻科(Cymbellaceae)、双眉藻属(Amphora), 定名为Amphorasp.。
1.2 藻种培养
藻种的初期维持培养采用添加有 Na2SiO3的 f/2培养基, 培养温度为(30±0.5)℃, 光照强度为 85~93µmol/(m2·s), 光照周期为 12L:12D, 每天定时进行摇瓶。实验培养液为天然海水配制, 盐度为 35, 所用药品为分析纯。实验器皿为1L玻璃缸、50~1 000mL三角锥瓶和 10 mL离心管, 所有实验器皿均先经过121℃、20 min高压灭菌, 冷却后使用。
1.3 藻生长的测定方法
1.3.1 光密度法
在上述培养条件下, 玻璃缸内倾斜放置有若干面积相等的附着基, 每天定时随机取出3片, 刮取附着基上的藻细胞, 稀释到适当的质量浓度, 充分混匀后用于生长的测定。光密度法参照文献[10-11]进行测定, 每次测样前摇匀, 每次取样测 8~10个值,从中去除最大值和最小值, 然后求平均代表该样值。
比生长速率计算公式为:K=(lgAt2-lgAt1)/0.301(t2-t1), 其中,K为相对生长常数;t1为指数生长期开始时的天数;t2为指数生长期结束时的天数;At1为指数生长期开始的藻液光密度值;At2为指数生长期结束的藻液光密度值。
1.3.2 细胞计数法
细胞计数采用血球计数板, 每次取样重复计数3次。
1.4 单因子试验设计
1.4.1 营养盐单因子试验
本组实验的物理因子为: 盐度 35, 温度 30℃,光照强度(85±7)µmol/(m2·s), 光照周期为 12L:12D,培养时间为8 d。
N、P、Si的质量浓度梯度设置及实验方案如下:
以添有Na2SiO3的f/2培养液的N、P、Si为基础, 固定 N、Si质量浓度, 改变 P质量浓度进行试验; 同理, 固定 P、Si质量浓度, 改变 N质量浓度和固定N、P质量浓度改变Si进行试验, 分别设置6 个梯度: 0、1/100、1/10、1、10、100(表 1)。每组设置 3个平行, 选取指数期的藻种加入各个质量浓度的培养液中, 并使每种单因子的初始培养液的A680nm值基本相同。

表1 实验N、P、Si的质量浓度梯度设置Tab. 1 The gradient concentrations of N, P, Si
1.4.2 环境因子实验
本组实验培养液采用添加Na2SiO3的f/2培养液,光照周期为12L:12D, 培养时间为8d。每个物理因子梯度设置如表2, 每组设置3个平行, 选取指数期的藻种加入各个质量浓度梯度的培养液中, 并使每种单因子的初始培养液的A680nm值基本相同。

表2 物理因子梯度设置Tab. 2 The gradients of Physical factors
1.5 数据的处理
实验数据采用 SPSS11.0软件进行统计学分析,依据不同的实验需要做相关性分析、方差分析和LSD多重比较, 显著性水平为P<0.05。
2 结果
2.1 光密度法和细胞计数法检测 Amphora sp.生长的相关性
由图1可知, 不同的接种密度培养Amphorasp.,光密度法和细胞计数法显示很好的相关性, 两种方法反映该藻生长趋势基本一致, 通过Pearson相关性检测, A图和B图的相关系数为0.997和0.996, 显著性相关(P=0.01)。

图1 Amphora sp.在不同接种密度下的光密度和细胞计数法的相关性Fig. 1 Correlation between the values of OD680 and their cell counts per area of Amphora sp. under different inoculations
2.2 光照强度对Amphora sp.生长的影响
不同光照强度对底栖硅藻Amphorasp.生长的影响如图2所示。单因素方差分析表明, 该藻的相对生长常数差异显著(P=0.000), 说明光照强度对Amphorasp.的生长影响显著, 多重比较得知,Amphorasp.最适生长光照强度为 56~99 µmol/(m2·s)。

图2 不同光照强度对Amphora sp.生长的影响Fig. 2 Effect of light intensity on growth of Amphora sp.
2.3 温度对Amphora sp.生长的影响
不同的温度对Amphorasp.生长的影响如图 3所示。单因素方差分析表明, 该藻的相对生长常数差异显著(P=0.000), 说明不同温度对Amphorasp.的生长影响显著。当温度很低时, 该藻只能极缓慢地生长, 在20~30℃时, 随着温度的升高, 比增长速率K增大, 通过LSD多重比较得知, 该藻的最适温度在25~30℃。
2.4 盐度对Amphora sp.生长的影响
不同的盐度对Amphorasp.生长的影响如图4所示, 单因素方差分析表明, 该藻的相对生长常数差异显著(P=0.003), 说明不同盐度对Amphorasp.的生长影响显著, LSD多重比较得知, 该藻的最适盐度30~35, 盐度过高或过低都会抑制该藻的生长, 且高盐比低盐抑制明显。
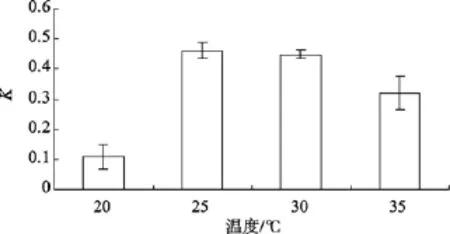
图3 不同温度对Amphora sp.生长的影响Fig. 3 Effect of temperature on growth of Amphora sp.

图4 不同盐度对Amphora sp.生长的影响Fig. 4 Effect of salinity on growth of Amphora sp.
2.5 氮质量浓度对Amphora sp.生长的影响
不同氮的质量浓度对Amphorasp.生长的影响如图5所示, 单因素方差分析表明, 该藻的相对生长常数差异显著(P=0.000), 说明不同氮质量浓度对Amphorasp.的生长影响显著, LSD多重比较得知, 在氮质量浓度0~750 mg/L范围内, 随着氮质量浓度的增加, 该藻的相对生长速率也逐渐增大, 且表明该藻在质量浓度为750 mg/L和7 500 mg/L时, 该藻的相对生长速率K没有差别(P>0.05)。

图5 不同氮质量浓度对Amphora sp.生长的影响Fig. 5 Effect of NaNO3-N concentration on growth of Amphora sp.
2.6 磷质量浓度对Amphora sp.生长的影响
不同磷质量浓度对Amphorasp.生长的影响如图6所示, 在一定范围内, 随着磷质量浓度的增加, 该藻的生长也加快, 单因素方差分析表明, 该藻的相对生长常数差异显著(P=0.000), 说明不同磷质量浓度对Amphorasp.的生长影响显著。多重比较得知, 44 mg/L时相对生长常数达到最大。

图6 不同磷质量浓度对Amphora sp.生长的影响Fig. 6 Effect of NaH2PO4-P concentration on growth of Amphora sp.
2.7 硅质量浓度对Amphora sp.生长的影响
不同硅质量浓度对Amphorasp.生长的影响如图7所示, 该种底栖硅藻的生长速率在硅盐质量浓度为零时非常低, 随着硅盐质量浓度的升高而迅速增加。单因素方差分析, 表明该藻的比生长速率差异极显著(P=0.000), 说明不同硅质量浓度对Amphorasp.的生长影响显著, 多重比较得知,该藻的最适硅质量浓度为150 mg/L。

图7 不同硅质量浓度对Amphora sp.生长的影响Fig. 7 Effect of Na2SiO3-Si concentration on growth of Amphora sp.
2.8 氮、磷、硅的正交实验
2.8.1 正交试验设计
选择NaNO3-N、Na2SiO3-Si、NaH2PO4-P三因子对Amphorasp.进行了生长速率的影响试验, 均取三水平(表 3), 各因子水平的确定主要根据本实验中单因子试验结果。正交试验表4选用L9(34)。
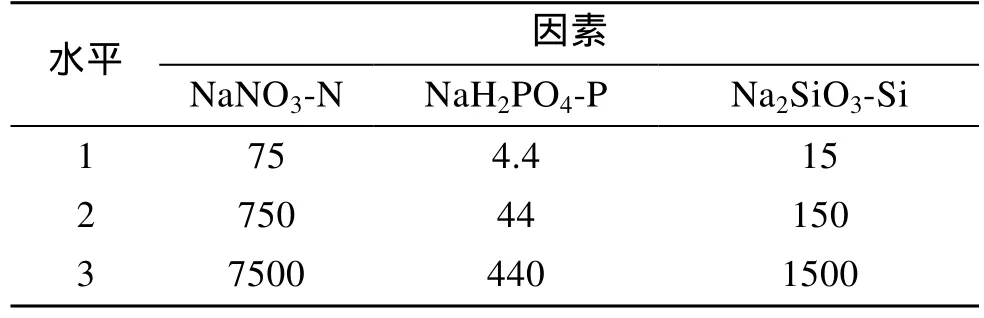
表3 正交试验因素及水平Tab. 3 Factors and levels of orthogonal tests mg/L
表4是Amphorasp.营养盐L9(34)正交试验结果,由极差数值R可见, 三种营养盐的质量浓度对该藻的影响作用由强到弱依次是: NaH2PO4-P>NaNO3-N>Na2SiO3-Si。正交实验方差分析(表 5)表明 3种营养盐对Amphorasp.的生长都有显著影响, 其中磷酸二氢钠、硝酸钠的作用极其显著, 综合分析得出培养Amphorasp.的氮、磷、硅的最适质量浓度配比是N:P:Si=2.4:1:3.4, 即本实验的2号实验。
3 讨论
由图1可知, 不同的接种密度培养Amphorasp.,两种方法反映该藻生长趋势基本一致。Pearson相关性检测A图和B图的相关系数为0.997和0.996, 呈显著性相关(P=0.01), 光密度法和细胞计数法显示很好的相关性。在生长对数期末期到稳定期, 可能由于该藻分泌胞外分泌物, 较之细胞计数,A680nm值会略高, 但两种方法在反映藻细胞生长状态上显示较好的相关性, 这与之前的研究一致[10], 随着培养时间的延长, 细胞生长经稳定期进入衰亡期, 细胞数会减少, 但细胞的胞外分泌物并不会立即停止, 二者数据的显示就会出现很大的差异, 相关性较低[12]。光密度法检测该藻生长率选用A680nm, 研究表明在该波长是, 分光光度计的灵敏度最高, 结果较为可靠。作者认为, 在进行A值检测操作时尽量保证数据的稳定性, 进行多次测量, 避免数据的偶然性会得出准确的结果。该方法在检测各项指标的优劣性上是可行的, 尤其在检测的指标较多时, 该方法较为便捷,也能在一定程度避免细胞计数的主观误差。

表4 正交试验结果Tab. 4 Results of orthogonal test L9(34)design

表5 正交结果的方差分析Tab. 5 Variance analysis of orthogonal test results
底栖硅藻营自养生活, 必须依靠光合作用来合成有机物质。光强和光质都会影响底栖硅藻的光合作用以及藻的群落、种群动态和适应模式[13]。郭峰等报道了底栖硅藻适宜生长的光强一般为21.4~78.6µmol/(m2·s)[14], 最适光强因种类不同而有所区别, 如亚历山大菱形藻(Nitzschia alexandrina)适于光照较强的环境, 在 78.6 µmol/(m2·s)迅速生长, 而卵形(Cocconeissp.)则在 47.1µmol/(m2·s)生长最好[14]。光过强会发生光饱和现象, 甚至发生光氧化。本实验数据表明Amphorasp.适宜生长的光强为 56~99µmol/(m2·s)。与上述藻类最适光照强度不同原因可能是Amphorasp.分离自西沙热带海域的潮间带, 水体的透明度非常高。Amphorasp.适宜生长光照值反映了栖息的环境特征。
温度是影响藻类细胞生理变化的主要因素[15]。对光自养生物, 温度通过控制酶动力学来调节其生长[16]。硅藻多在温度较低的冬春季生长繁殖[17], 各种硅藻各有其适温范围, 高温和低温都会危害底栖硅藻的生长。Amphorasp.适宜温度为25~30℃, 与丁蕾等[18]报道的拟菱形藻(Pseudo-nitzschiasp.)高密度出现在 25~30℃相似, 但比一般的底栖硅藻的适宜温度 10~20℃高, 与该藻生长的热带西沙海域偏高温的环境相一致。
盐度在不仅影响硅藻的分布, 而且是使某些硅藻形成水华的重要原因。在最适范围内生长、繁殖速度最快。超出适盐范围, 过高和过低的盐度都会伤害藻类细胞都会产生[15]。马美荣等[19]培养的咖啡双眉藻(Amphora coffeaeformis)在盐度在8~60时生长速率逐渐减慢, 郭峰等[14]培养的矮小卵形藻(Cocconeis diminuta)和亚历山大菱形藻(Nitzschia alexandrina)的最适盐度分别为30和35,在20~40 盐度范围都能良好的生长, 与本实验结果基本一致。同时 Clavero等[20]在34株底栖硅藻的盐度试验中发现, 大部分培养的种属表现出极度的广盐性,最适盐度在30。说明不同藻种最适质量浓度不同, 本实验Amphorasp.采自西沙永兴岛海域, 最适生长盐度为30~35, 也是长期适应的结果。
氮是构成蛋白质的重要元素, 是影响底栖硅藻细胞生长与分裂的重要元素[18], 是底栖硅藻生长与繁殖的一个限制性因子。实验结果表明, 在 0~750 mg/L的质量浓度范围内, 随着氮质量浓度的增加,藻细胞比生长速率也相应增加, LSD多重比较得知,该藻在质量浓度为750 mg/L和7500 mg/L时, 该藻的相对生长速率K没有差别(P>0.05)。董金利等[21]研究了氮、磷营养盐对底栖硅藻缢缩菱形藻(Nitzschiaconstricta)的生长及生化组成影响中表明,该藻在最大氮质量浓度900 mg/L时, 该藻的比生长速率达到最大。一般认为, 不同的藻种有不同的最适氮质量浓度。在藻类的规模化培养中, 营养盐的投入多少直接影响成本的高低, 选择合适的氮质量浓度既要保证藻类的较快速生长, 又要讲究社会效益。
由于硅藻的硅质外壳, 硅是硅藻的必需营养元素.除了作为细胞壁结构成分外, 还参与光合色素的合成、蛋白质的合成、DNA的合成和细胞分裂等多种代谢和生长过程[22]。 尽管如此, Shifrin[23]曾报道,一种小环藻在硅饥饿后大约一代时间内, 细胞分裂就完全停止, 但马志珍[24]在实验室用自然海水培养单种底栖舟形藻(Neviculasp.)时也发现, 即使不加硅盐, 硅藻仍能生长良好。大贝政治[25]等采用营养去除法的实验表明, 用完全不含硅的人工海水培养液培养一种卵形藻Cocconeissp.时, 对其生长的抑制作用很小。由图6可知, 当硅盐质量浓度为零时, 双眉藻仍能较缓慢生长, 但在0~15 mg/L时, 该藻的相对生长常数没有太大变化, 当硅的质量浓度增加到150 mg/L时,Amphorasp.呈快速增长,进一步证明传统的 f/2海水培养基不能满足该藻快速生长的营养需要。
磷是细胞膜的重要成分, 在细胞的能量传递中起着重要的作用, 而培养液中的磷对培养液的酸碱度起缓冲作用[18]。在藻类培养中, 磷的用量一般都比氮小, 但由于磷的化合物的溶解性和移动性较差,磷对水体初级生产力的限制作用更显著[26], 本文的单因子试验中这一结论同样得到证实。有研究表明,微藻对营养盐的摄取不是单独进行的, 而是按一定比例吸收, 营养盐之间的比例, 尤其是氮磷的质量浓度配比对细胞的生长发育有重要作用[27-28]。各种单细胞藻所要求的N、P比例不同。王渊源等[29]实验表明, 小型舟形藻(Navicula parva)最佳 N: P=65:1,在此条件下细胞数量增加最为明显。单因子试验没有考虑营养盐之间的配比, 存在一定的缺陷。藻类生长状态是多因子同时作用的结果, 所以多因子组合实验更能真实反映它们的营养需求, 更接近藻类培养的最优条件。本实验在N:P:Si=2.4:1:3.4时该双眉藻的生长最好, 而与李雅娟等[9]培养的咖啡双眉藻(Amphora coffeaeformis)的最佳配比为 2.5:1:2接近,两者都与马志珍[24]报道的舟形藻(Naviculasp.)最适质量浓度都不同, 说明不一样的藻类适宜的营养盐比例有异。同是双眉藻, 分布在不同的海域, 环境条件不同, 也会表现出不同的营养需求。
[1]陈明耀. 生物饵料培养 [M]. 北京: 中国农业出版社,1995.
[2]陈世杰, 陈木, 卢豪魁, 等. 鲍苗的饵料-底栖硅藻培养试验初报 [J]. 动物学报, 1977, 23(1): 47-52.
[3]袁成玉. 海参饲料研究的现状与发展方向 [J]. 水产科学, 2005, 24(012): 54-56.
[4]张春云, 王印庚, 荣小军, 等. 国内外海参自然资源、养殖状况及存在问题[J]. 海洋水产研究, 2004,25(3): 89-97.
[5]Rivkin R B, Putt M. Photosynthesis and cell division by antarctic microalgae:comparion of benthic, planktonic and ice algae [J]. Journal of phycology, 1987, 23: 223-229.
[6]Snyder E B, Robinson C T, Minshall G W. et al. Regional patterns in periphyton accrual and diatom assemblage structure in a heterogeneous nutrient landscape [J]. Canadian Journal of Fisheries and Aquatic Sciences, 2002, 59(3): 564-577.
[7]Agatz M, Asmus R, Deventer B. Structural changes in the benthic diatom community along a eutrophication gradient on a tidal flat [J]. Helgoland Marine Research,1999, 53(2): 92-101.
[8]Armitage A R, Frankovich T A, Fourqurean J W. Variable responses within epiphytic and benthic microalgal communities to nutrient enrichment [J]. Hydrobiologia,2006, 569(1): 423-435.
[9]李雅娟, 王起华. 氮, 磷, 铁, 硅营养盐对底栖硅藻生长速率的影响 [J]. 大连水产学院学报, 1998,13(4): 7-14.
[10]Wang Q H, Wang S H, Ding M J, et al. Studies on culture conditions of benthic diatoms for feeding abalone[J]. Chinese Journal of Oceanology and Limnology,1998, 16(1): 78-83.
[11]周银环. 氮, 磷, 铁, 硅对简单双眉藻生长的影响[J]. 广东海洋大学学报, 2008, 28(1): 35-39.
[12]Hoagland K D, Rosowski J R, Gretz M R, et al. Diatom extracellular polymeric substances: function, fine structure, chemistry and physiology[J]. Journal of phycology, 1993, 29:537-566.
[13]庄树宏. 光强和光质对底栖藻类群落影响Ⅱ. 群落和种群的动态和适应模式 [J]. 生态学报, 2001, 21(12):2057-2066.
[14]郭峰, 朱凌俊, 柯才焕, 等. 两种海洋底栖硅藻的培养条件研究 [J]. 厦门大学学报(自然科学版), 2005,44(6):831-835.
[15]华汝成. 单细胞藻类的培养与利用 [M]. 北京: 农业出版社, 1986.
[16]Davison I R. Environmental effects on algal photosynthesis: temperature [J]. Journal of phycology, 1991,27(1): 2-8.
[17]陈峰, 姜悦. 微藻生物技术 [M]. 北京: 中国轻工业出版社, 1999.
[18]丁蕾, 支崇远. 环境对硅藻的影响及硅藻对环境的监测 [J]. 贵州师范大学学报: 自然科学版 2006, 24(3):13-16.
[19]马美荣, 李朋富, 陈丽, 等. 盐度和营养限制对盐田底栖硅藻咖啡双眉藻生长及胞外多糖产率的影响[J]. 盐业与化工, 2008, (5): 30-34.
[20]Clavero E, Hernández-Mariné M, Grimalt J O, et al.. Salinity tolerance of diatoms from thalassic hypersaline environments [J]. Journal of Phycology, 2000, 36(6):1021-1034.
[21]董金利, 庄惠如, 占美怜,等. 氮, 磷营养盐对底栖硅藻的生长及生化组成影响[J]. 生物技术,2010,20:64-67.
[22]Werner D. The biology of diatoms [M]. California:Univ of California Press, 1977.
[23]Shifrin N S, Chisholm S W. Phytoplankton lipids:interspecific differences and light-dark cycles[J].Journal of phycology, 1981, 17(4): 374-384.
[24]马志珍, 季梅芳, 陈汇远. 一种可做鲍和海参饵料的底栖舟形藻的培养条件的研究[J]. 海洋通报, 1985,4(4): 36-39.
[25]大贝政治, 松井敏夫, 高木博之. 附着硅藻Cocconeis sp.の增殖に及 ぽ环境诸要因の影响[J].水产增殖, 1992, 40(2): 240-246.
[26]吴春雪. 两种海洋底栖硅藻生长条件及生化成分的研究[D]. 大连: 大连理工大学, 2008.
[27]Smith R E H, Geider R J. Kinetics of intracellular carbon allocation in a marine diatom[J]. Journal of Experimental Marine Biology And Ecology, 1985, 93(3):191-210.
[28]Thomas W H, Dodson A N. Effects of phosphate concentration on cell division rates and yield of a tropical oceanic diatom [J]. The Biological Bulletin, 1968,134(1): 199-208.
[29]王渊源, 姜庆国, 江航宇. 培养小型舟形藻的氮、磷肥料量 [J]. 海洋科学, 1986, 10(5): 35-37.
