三种海洋浮游微藻的分子鉴定及培养条件研究
2012-10-13逄少军
徐 娜, 逄少军
(1. 中国科学院 海洋研究所, 山东 青岛 266071; 2. 中国科学院 研究生院, 北京100049)
浮游微藻是海洋中最主要的初级生产者, 在海洋生态系统中起着重要作用。一些微藻能够引发赤潮, 给水产养殖、人类健康和海洋环境都造成巨大负面影响。很多海洋微藻是水产动物开口饵料, 或者活性物质、生物能源等研究的基础生物材料[1]。微藻的传统鉴定主要是依靠形态特征, 但对于一些个体微小或形态多变的种类, 需借助电子显微镜。电镜观察受设备条件的限制, 而且电镜样品处理复杂, 广泛使用有一定的难度。另外, 在微藻分类中存在很多同物异名的现象, 例如卡罗藻Karlodinium vene fi cum就有Gymnodinium galatheanum,Karlodinium micrum等多个名称[2-3]。目前的微藻鉴定和命名存在欠缺准确性、具有主观性等问题, 在国内, 不同研究者对一些拉丁文名称的翻译也不一致。随着对生物鉴定研究的深入, 很多物种的命名已发生改变, 而大多分类参考书目因年代较早而没有囊括这些更新的物种。分子生物学方法对藻种的鉴定不受条件及环境因素限制, 是一种准确、客观、高效的方法。Genbank收录了大量生物分子序列, 而且数量在不断快速增加,为研究系统进化及物种鉴定提供了重要参考。核糖体18S rDNA和ITS序列是藻类分子鉴定和分类中最常用的两个分子指标[4]。
在持续建立我国近海浮游单细胞海藻活体种质库的过程中, 人们需要对其中的一些重要物种建立丰富培养的条件, 同时准确无误地完成相关生物学鉴定。本文报道了作者通过使用两种分子标记序列对三种新分离的单细胞海藻进行鉴定和培养条件研究的结果。研究表明这三种藻都是能够引发赤潮的海藻物种。研究它们在不同环境条件下的生长潜力,对揭示其在自然界大规模暴发的机制有重要参考意义。本项实验所采用的使用光密度(optical density)来检测海藻生物量变化的研究方法在国际上被广泛采用[5-10]。这种方法是利用微藻在某一波长下的光吸收值来间接评价细胞密度的变化, 并以此作为衡量藻生物量的指标。相对于传统的细胞计数法, 光密度法具有简单快速、客观准确、不伤害实验材料等优点[11-13]。
1 材料与方法
1.1 藻种的来源及分离方法
藻种Mbccc-Gym-1、HH200907-1和HH200907-2由北黄海水样中分离得到。采回的水样加入灭菌海水配制的f/2培养液[14-15](不添加硅酸盐)进行富集培养。培养温度为20℃, 以白炽灯为光源, 光照强度为3 000 lx, 光照周期12L : 12D。定期检查富集培养藻液的细胞密度。约一周后进行藻种分离, 将藻液逐渐稀释直到一滴(约1μL)平均只含有一个藻细胞, 在显微镜下检查, 把只含一个藻细胞的水滴转移至24孔组织培养板中, 加入f/2培养液继续培养。得到纯的藻种后转移到三角瓶中扩大培养。
1.2 藻种的鉴定
1.2.1 形态的显微观察
取纯培养的藻液直接置于倒置显微镜下(江南XD-202, 中国)观察活体藻细胞。另取少量藻液固定后用正置显微镜(Nikon E100, 日本)的油镜观察并拍照(Canon EOS 1000D, 日本)。扫描电镜样品制备:将藻细胞抽滤到滤膜上, 用2.5%戊二醛溶液固定1 h;之后用 0.1 mol/L 的磷酸缓冲液洗涤 3次; 依次在30%、50%、70%、80%、90%、95%的乙醇中各脱水10 min, 100%的乙醇2×10 min; 随后先用乙醇: 醋酸异戊酯(1 : 1)置换10 min, 再用100%的醋酸异戊酯20 min; 样品在临界点干燥并喷金, 用扫描电子显微镜(KYKY-2800B, 中国)观察拍照。
1.2.2 分子鉴定
取50 mL处于对数生长期的纯种藻液, 7 000g离心5 min, 弃上清收集藻细胞。用植物试剂盒提取基因组DNA。
18S rDNA序列的扩增采用真核生物18S通用引物 SSU-F/ SSU-R[16]。扩增藻种 Mbccc-Gym-1和HH200907-1所用的 ITS序列引物为 ITS1/ITS2[4];HH200907-2的ITS序列引物为ITS4/ ITS5[17]。PCR反应体积50 μL, 体系包括: 模板基因组DNA 2.5 μL,引物(20 μmol/L)各 1 μL, Taq 酶预混合的 PCR 反应液(Takara, 日本)25 μL, 补充 ddH2O 至 50 μL。18S 序列扩增循环程序为: 94℃预变性10min; 之后94℃变性30 s, 55℃退火45 s, 72℃延伸90s, 循环32次; 最后 72℃延伸10 min[16]。Mbccc-Gym-1和HH200907-1的 ITS序列扩增程序为: 95℃预变性 5 min; 之后94℃1 min, 55℃1 min, 72℃2 min, 循环 30次后 72℃延伸5 min[4]。扩增HH200907-2 ITS序列的程序为95℃预变性5 min; 之后94℃1 min, 45℃1 min, 72℃1 min, 循环25次, 最后72℃延伸5 min[17]。
扩增产物经琼脂糖凝胶电泳并切胶回收目标片段, 连接到 pMD18-T 载体, 并转化感受态Escherichia coliDH-5α, 用蓝白斑法筛选阳性克隆。用菌液 PCR检测白斑菌落, 重组成功的菌落扩增培养后送至上海博尚测序公司测序。
将测得的序列在NCBI用BLAST进行同源检测,找出与其最相近的物种。在 Genbank下载相关物种的18S rDNA序列及ITS序列, 与测得的序列一起用BioEdit软件的Clustal W[18]进行多序列对位分析。用MEGA 4[19]的 Kimura 2-parameter 模型计算遗传距离, 采用邻接法(neighbor-joining/ NJ)[20]构建系统进化树, 用自举分析(bootstrap)[21]估计系统树分支节点的置信度, 自举数据集为1000次。
1.3 培养条件实验
以藻液在680 nm下的光密度值(A680)为参数衡量藻体生物量。为检验A680与藻密度的相关性, 分别对三种藻不同密度的藻液进行细胞计数并测量A680, 计算藻液密度–A680标准曲线的相关系数。光密度值由T6紫外分光光度计(普析通用, 中国)测得。藻液初始浓度合适时接种于100 mL三角瓶, 分别进行6组单因素实验。每组实验平行重复3个样本, 置于人工培养箱(江南, 中国)中培养, 每天摇瓶2次。每隔一天测量藻液的A680。
表1列出了 6组实验的条件。每组实验只有所列条件不同, 其他条件均一致。在实验1中, 藻液生长条件为温度15~28℃, 光照强度5 000 lx, 光照周期为12L : 12D。实验2中藻液生长条件为温度22℃,光照强度1 500~10 000 lx, 光照周期12L : 12D。实验3条件为温度22℃, 光照强度5 000 lx, 光照周期分别为8L : 16D、12L : 12D和16L : 8D。实验1~3所用培养液都是标准f/2培养液。实验4用盐度为1~36的 f/2培养液。实验 5培养液中氮(N)浓度为0N~3N, 0N代表培养液不添加氮营养盐, 1N等于标准f/2培养液中的氮浓度(882 μmol/L), N/2等于其一半的浓度, 2N和3N分别代表标准浓度的2和3倍。实验6培养液的磷(P-)浓度为0P~3P, 0P代表培养液不添加磷营养盐, 1P等于标准f/2培养液的磷浓度(36.2 μmol/L), P/2等于其一半的浓度, 2P和3P分别代表标准浓度的2和3倍。在实验4~6中, 其他培养条件为温度20℃, 光照强度5 000 lx, 光照周期12L : 12D。

表1 6组培养条件实验Tab. 1 Information of 6 batch culture experiments
2 结果与分析
2.1 形态学特点
2.1.1 Mbccc-Gym-1
生长状态良好的藻液呈黄褐色。在显微镜下观察, 藻细胞横沟明显, 将细胞分为大小不等的上下两部分(图1a, b)。细胞旋转运动, 活跃的游动细胞长8~15 μm, 宽 5~12 μm, 鞭毛 2 条。细胞易变形, 藻液中加入固定液后细胞很快变成球形。

图1 Mbccc-Gym-1的形态特征Fig. 1 Morphological features of strain Mbccc-Gym-1
2.1.2 HH200907-1
藻液黄褐色。藻细胞梨形, 被横沟分为上下两部分, 上锥部尖, 下锥部半球形。细胞长 15~30 μm,宽13~25 μm(图2a)。细胞前端伸出两条不等长的鞭毛。扫描电镜照片可看到明显的横沟和纵沟(图2b)。藻体细胞在营养匮乏或条件不适宜时, 会形成孢囊。孢囊个体较大, 近球形, 表面具尖刺状或不规则的突起(图 2c)。
2.1.3 HH200907-2
藻液呈黄褐色至褐色。藻细胞一般为椭圆形, 长13~20 μm, 宽 7~13 μm(图 3a,b)。细胞一侧近体长1/3处有一短凹陷, 此处伸出两条不等长的鞭毛。细胞核明显。无细胞壁, 细胞形状易变化。当藻体被转移至淡水中或加入固定液后, 细胞膜很快破裂, 可明显看到十几个黄绿色的叶绿体(图3c)。
2.2 分子鉴定: 18S rDNA及ITS序列分析
2.2.1 Mbccc-Gym-1
Mbccc-Gym-1的18S rDNA去除引物后序列长度为 1742 bp, 提交至 Genbank获得序列号JQ320136。ITS序列去除引物后长度为 613bp(Genbank索引号: JQ320137)。两条序列分别经BLASTn进行在线检索, 与之相似性得分最高的物种都是共生甲藻属(Symbiodinium)。将18S rDNA序列与Genbank中的相似序列用NJ法构建的系统进化树(图 4)表明, Mbccc-Gym-1和几株Symbiodiniumsp.、S. microadriaticum、S. californium、Dinophyceae sp. CCMP421(实为共生甲藻属[22])完全聚在一起, 支持率为 100%。依据 ITS序列构建的进化树(图 5)结果相似, Mbccc-Gym-1与几株共生甲藻Symbiodiniumsp.、S. microadriaticum、S. californium和裸甲藻Gymnodiniumsp.聚为单独的一支, 支持率为100%。经查阅, Genbank收录的这几株裸甲藻Gymnodiniumsp.实际也都为共生甲藻。因此, 根据这两条序列的分析结果, 这株藻应该为共生甲藻属, 但是由于该属内种间差异较小, 这两种序列都不能很好地区分开不同种, 且 Genbank中与这株藻相近的生物大多未定名到种, 故暂不能对 Mbccc-Gym-1的种名作出判断, 只推断为一种可以独立生活的共生甲藻Symbiodiniumsp.。

图2 HH200907-1的形态特征Fig. 2 Morphological features of strain HH200907-1

图3 HH200907-2的形态特征Fig. 3 Morphological features of strain HH200907-2

图4 依据18S rDNA序列通过邻接法(NJ)构建的系统树(重复1000次计算bootstrap值), 以Alexandrium tamarense为外类群Fig. 4 The neighbor-joining tree of 18S rDNA sequence. Bootstrap values (%)of 1000 replicates are given adjacent to each node. Alexandrium tamarense is used as outgroup

图5 依据ITS序列通过邻接法(NJ)构建的系统树(重复1000次计算bootstrap值), 以Alexandrium tamarense为外类群Fig. 5 The neighbor-joining tree of ITS sequence. Bootstrap values (%)of 1000 replicates are given adjacent to each node.Alexandrium tamarense is used as outgroup
2.2.2 HH200907-1
HH200907-1的18S rDNA序列去引物后长度为1744bp, 提交至Genbank获得序列号JQ246506。ITS序列去除引物后长度为 601bp, Genbank序列号JQ250798。将两个序列经BLASTn进行在线检索, 都与Scrippsiella trochoidea(锥状斯氏藻)相似性得分最高。依据18S rDNA构建的系统树(图 6)表明, 该藻与Genbank收录的几株S. trochoidea聚在一起, 支持率 85%。ITS序列系统树(图 7)中, 几株S. trochoidea没有形成单独的一支, 有一定的种内差异, 但HH200907-1与大多数的S. trochoidea聚在一起。因此,作者认为这株藻应该是锥状斯氏藻S. trochoidea。

图6 依据18S rDNA序列通过邻接法(NJ)构建的系统树(重复1000次计算bootstrap值), 以Alexandrium tamarense(塔玛亚历山大藻)为外类群Fig. 6 The neighbor-joining tree of 18S rDNA sequence. Bootstrap values (%)of 1000 replicates are given adjacent to each node. Alexandrium tamarense is used as outgroup

图7 依据ITS序列通过邻接法(NJ)构建的系统树(重复1000次计算bootstrap值), 以Alexandrium tamarense为外类群Fig. 7 The neighbor-joining tree of ITS sequence. Bootstrap values (%)of 1000 replicates are given adjacent to each node.Alexandrium tamarense is used as outgroup
2.2.3 HH200907-2
HH200907-2的18S rDNA序列去除引物后长度为1751bp, Genbank序列索引号JQ250796。ITS序列去引物长度为610bp, Genbank序列号JQ250797。将两个序列经 BLASTn进行在线检索, 都与Heterosigma akashiwo(赤潮异弯藻)相似性得分最高。依据 18S rDNA 构建的系统树(图 8)表明, 该藻与Genbank收录的几株H. akashiwo聚在一起, 支持率100%。ITS序列系统树(图9)中, HH200907-2同样以100%的支持率与H. akashiwo聚为一支。因此, 作者推断这株藻应该为赤潮异弯藻H. akashiwo。
2.3 三种藻的生长条件
2.3.1A680-细胞密度标准曲线
三种藻的A680-细胞密度标准曲线(图 10)相关系数(R2)都大于0.99。作者检验了三种藻在不同培养条件下的细胞密度和A680值, 与标准曲线吻合良好, 表明在680nm测得的三种藻的A值都可以用来代表细胞密度。
2.3.2 共生甲藻
图11a表明, 共生甲藻在19~28℃生长良好, 在15℃低温时生长较缓慢; 低光照强度时(1 500 lx)生长受限, 4000~10 000 lx条件下, 其生长速度接近(图 11b); 延长光照时间能促进其生长, 但影响不大(图 11c); 淡水中藻体无法存活, 在低盐度(15)中生长也受限制, 在盐度大于20的培养液中生长无显著差异(图 11d); 培养液中氮浓度对其生长影响较大,不额外添加氮营养盐时, 藻体繁殖受限, 氮浓度越高, 藻密度越高(图 11e); 培养液中低磷浓度也影响其生长, 但磷浓度高于1P(36.2 μmol/L)时, 生物量增长一致(图11f)。
2.3.3 锥状斯氏藻
锥状斯氏藻在 28℃高温时生长受到限制, 19~22℃生长最好(图12a); 1 500 lx的低光照强度限制其生长, 在4 000 lx的光照下开始生长虽较慢, 但最终能达到较高的生物量(图 12b); 短的光照时间(8L:16D)下, 藻体密度开始上升较慢, 但最终生物量最高, 长光照时间下的藻体最初生长最快, 但最早进入稳定生长期(图 12c); 图 12d表明藻体在淡水中无法存活, 盐度为15~25时生长最好; 图12e中, 低氮浓度的培养液不利于藻体的生长, 在氮浓度为 2N(1 764 μmol/L)和 3N(2 646 μmol/L)时, 最终获得的生物量最大; 培养液不添加磷营养盐可维持藻体缓慢增长, 磷浓度高于 P/2(即 18.1 μmol/L)时, 对其生长影响差别不大(图12f)。
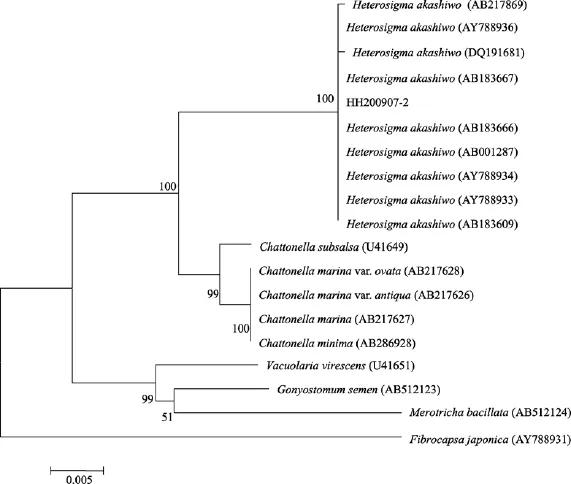
图8 依据18S rDNA序列通过邻接法(NJ)构建的系统树(重复1000次计算bootstrap值), 以Fibrocapsa japonica为外类群Fig. 8 The neighbor-joining tree of 18S rDNA sequence. Bootstrap values (%)of 1000 replicates are given adjacent to each node. Fibrocapsa japonica is used as outgroup

图9 依据ITS序列通过邻接法(NJ)构建的系统树(重复1000次计算bootstrap值), 以Fibrocapsa japonica为外类群Fig. 9 The neighbor-joining tree of ITS sequence. Bootstrap values (%)of 1000 replicates are given adjacent to each node.Fibrocapsa japonica is used as outgroup

图10 三种藻的A680-细胞密度标准曲线Fig. 10 The relationship between A680and cell density of three microalgae

图11 共生甲藻在不同温度(a)、光照强度(b)、光周期(c)、培养液盐度(d)、氮浓度(e)、磷浓度(f)下的生长曲线Fig. 11 Increases of algal biomass of Symbiodinium sp. as determined by A values at different temperatures (a), under different light intensities (b), in different photoperiods (c), in mediums with varied salinities (d), nitrogen (e)and phosphorus (f)levels. Vertical bars represent standard deviations.

图12 锥状斯氏藻在不同温度(a)、光照强度(b)、光周期(c)、培养液盐度(d)、氮浓度(e)、磷浓度(f)下的生长曲线Fig. 12 Increases of algal biomass of Scrippsiella trochoidea as determined by A values at different temperatures (a), under different light intensities (b), in different photoperiods (c), in mediums with varied salinities (d), nitrogen (e)and phosphorus (f)levels. Vertical bars represent standard deviations
2.3.4 赤潮异弯藻
该藻在不同温度下生长趋势一致, 最适温度为22℃, 低温(15℃)和高温(28℃)条件下生长稍差(图 13a);光照强度较低(1 500 lx)时, 藻体生长明显受限, 光强高于4 000 lx对其影响不明显(图13b); 不同的光周期对它的生长稍有影响, 适当延长光照时间能增大生物量(图13c); 在淡水中该藻不能存活, 盐度为15~36的培养液对其生长没有明显影响(图 13d); 未添加氮营养盐的培养液中, 藻体生长受限, 氮浓度高于 1N(即 882 μmol/L)时, 生长状况一致, 生物量最高(图 13e); 培养液不添加磷营养盐也限制藻的生长, P/2(18.1 μmol/L)的磷浓度足够满足其快速生长需求(图13f)。

图13 赤潮异弯藻在不同温度(a)、光照强度(b)、光周期(c)、培养液盐度(d)、氮浓度(e)、磷浓度(f)下的生长曲线Fig.13 Increases of algal biomass of Heterosigma akashiwo as determined by A values at different temperatures (a), under different light intensities (b), in different photoperiods (c), in mediums with varied salinities (d), nitrogen (e)and phosphorus (f)levels. Vertical bars represent standard deviations
3 讨论
3.1 对三种藻的分子生物学鉴定方法
本文所研究的这三种藻在形态上都有其特殊性,非专业的研究人员对它们的鉴定有一定困难。分子鉴定作为形态学方法的有效补充, 在研究中发挥越来越重要的作用。近两年作者通过18S rDNA和ITS两种序列对新分离微藻进行了分析, 结果表明这两种序列的结合能够有效鉴定多数微藻物种。18S rDNA序列相对保守, 对属以上水平的鉴定较为有效;而 ITS区变异较大, 更适合于作为种水平的分类依据[4,23]。
在实验室长期独立培养条件下藻种Mbccc-Gym-1生长良好, 它在形态上与裸甲藻非常相似, 因此最初被鉴定为裸甲藻(Gymnodiniumsp.)。但是在依据两种DNA序列构建的系统进化树中, 它都与Genbank中的共生甲藻属(Symbiodinium)聚在一起, 而与裸甲藻属(Gymnodinium)遗传距离相对较远。自然界中共生甲藻大多与海洋无脊椎动物共生,但有少数能自由生活[24]。本株藻虽与裸甲藻形态相似并独立生活, 但是作者依据分子序列分析判断其应为一种能自由生活的共生甲藻(Symbiodiniumsp.)。Wilcox[25]认为在共生甲藻中形态学特征不能概括系统进化关系, 他根据 SSU rRNA构建的系统进化树中, 有两种自由生活的甲藻出现在共生甲藻类群中,表明这个类群在进化中曾失去其共生的生活方式。美国国家海洋藻种保藏中心的一株能自由生活的藻种 CCMP421最初被鉴定为裸甲藻(Gymnodinium varians), 但是后来 rDNA分子进化研究表明这株藻应该为共生甲藻属(Symbiodinium), 自由生活的共生甲藻可能代表共生甲藻属中的一个亚属[26]。研究者对水体中分离得到的自由生活的共生藻有不同看法,有人认为是底栖共生藻迁移到水体寻找新的宿主,也有人认为它们不能共生只能自由生活[27-29]。陈国福等[24]认为这种藻有引发赤潮的可能。
锥状斯氏藻(S. trochoidea)是一种常见的世界广布性赤潮藻, 由其引发的赤潮在挪威、美国、智利、罗马尼亚、日本等国家都有过报道, 也是我国沿海特别是南海海域常见优势甲藻[30]。锥状斯氏藻在其生活史的某一时期, 能够形成孢囊来抵御不良环境。孢囊也被普遍认为是赤潮发生的“种源”, 对赤潮的发生、延续和消亡过程有着重要的作用[31]。孢囊形态多样, 王艳等[32]观察到锥状斯氏藻可形成 4种形态的休眠孢囊, 并且与营养细胞形态差别较大。因此在对锥状斯氏藻尤其孢囊形态的藻体鉴定时, 经验不足的工作人员仅仅依靠形态观察往往不能够完成准确鉴定, 而分子鉴定可排除这种影响。
赤潮异弯藻(H. akashiwo)也是一种常见的赤潮藻, 能够产生毒素, 在很多国家曾大量暴发并导致鱼类大量死亡[33]。由于培养条件或细胞周期的不同,细胞可呈现球形、卵形或椭圆形等多种形态[34]。另一方面, 赤潮异弯藻没有细胞壁, 细胞维持其渗透压的能力较差, 因此在对其进行形态观察时, 细胞经常因固定而破裂或变形[35]。作者也在研究中发现,藻样中加入微量固定液后, 细胞游动减慢并停止,一旦停止游动, 细胞膜便开始破裂, 只有在细胞刚停止游动但细胞膜暂未破裂的半分钟内才能抓拍到其完整形态的照片, 而想要得到细胞完整形态的电镜照片则更加困难。在国内外研究中, 这种藻经常被误认为是金色滑盘藻(Olisthodiscus luteus)[36]。对这种形态容易变化的微藻, 依靠分子生物学方法对其鉴定, 可得到准确可靠的结论。
3.2 培养条件对三种藻的影响
对三种藻的培养实验发现: (1)三种藻都在 22℃的条件下生长最好, 大多数浮游微藻生长的最适温度都在 22℃左右[37-40], 并且在我国赤潮频发时段为5~8月[41], 20℃左右的水温也最利于赤潮藻类的大量繁殖; 高温和低温对三种藻的影响不同: 共生甲藻不耐低温, 锥状斯氏藻在高温下生长受限, 赤潮异弯藻适温范围较广。(2)光照对它们影响相似, 三种藻在弱光时生长都受限, 大于4 000 lx的光照强度是它们快速增长的必要条件, 不同的是共生甲藻和赤潮异弯藻在光照越强时生长越好, 而锥状斯氏藻在强光下最初几天生长最快但第五天开始生物量明显下降; 延长光照时间对藻体生长繁殖起促进作用,但锥状斯氏藻在短光照时间下虽最初生长缓慢, 但最终生物量最高。(3)三种藻在盐度大于15的海水中都能存活, 适盐范围都较广, 在自然界中沿海淡水流入或降雨而导致的海水盐度的微量变化不会影响它们的生长, 因而赤潮可在近岸暴发。(4)海水中氮磷浓度对三种藻的生长都有重要的影响, 表现在低浓度限制生长, 高浓度促进生长, 但高到一定程度后, 氮磷浓度的增加不会再对藻生物量的增加产生影响, 用f/2培养液可基本满足藻体快速生长的氮磷需求。在室内对大多数浮游微藻的常规培养可采用温度20~22℃, 10 000 lx光照12h的条件, 用f/2培养液培养。
本研究对三种藻培养的实验周期为10~12d, 一直持续到藻体生长的平稳期或衰退期。在研究中发现某些条件下微藻虽在指数期生长最快, 但是最早进入稳定期, 最终生物量可能低于其他条件下的样品, 因此在微藻培养中应根据实际需要提供最合适的条件。例如对于锥状斯氏藻, 若要获得高生物量,在连续培养时应当提供高光和长时间光照; 在一次性培养时, 光照强度和时间可适当减弱。
[1]邹树平, 吴玉龙, 杨明德, 等. 微藻的综合开发利用[J]. 水产科学, 2007, 26(3): 179-181.
[2]Bergholtz T, Daugbjerg N, Moestrup Ø, et al. On the identity ofKarlodinium veneficumand description ofKarlodinium armigersp. nov. (Dinophyceae), based on light and electron microscopy, nuclear-encoded LSU rDNA, and pigment composition [J].J Phycol, 2005, 42:170-193.
[3]Daugbjerg N, Hansen G, Larsen J, et al. Phylogeny of some of the major genera of dinoflagellates based on ultrastructure and partial LSU rDNA sequence data, including the erection of three new genera of unarmoured dinoflagellates [J].Phycologia, 2000, 39 (4): 302-317.
[4]罗立明, 胡鸿钧, 李夜光, 等. 东海原甲藻的分子鉴定[J]. 海洋学报, 2006, 28(1): 127-131.
[5]Tang J X, Hoagland K D, Siegfried B D. Differential toxicity of atrazine to selected freshwater algae[J]. Bull Environ Contam Toxicol, 1997, 59: 631-637.
[6]Ma J, Lin F, Zhang R, et al. Differential sensitivity of two green algae,Scenedesmus quadricaudaandChlorella vulgaris, to 14 pesticide adjuvants[J]. Ecotoxicology and Environmental Safety, 2004, 58: 61-67.
[7]Liang W Y, Qu J H, Chen L B, et al. Inactivation ofMicrocystis aeruginosaby continuous electrochemical cycling process in tube using Ti/RuO2electrodes[J].Environ Sci Technol, 2005, 39: 4633-4639.
[8]Danger M, Leflaive J, Oumarou C, et al. Control of phytoplankton bacteria interactions by stoichiometric constraints[J]. Oikos, 2007, 116: 1079-1086.
[9]Danger M, Oumarou C, Benest D, et al. Bacteria can control stoichiometry and nutrient limitation of phytoplankton[J]. Functional Ecology, 2007, 21: 202-210.
[10]Chen M, Tang H, Ma H, et al. Effect of nutrients on growth and lipid accumulation in the green algaeDunaliella tertiolecta[J]. Bioresource Technology, 2011,102: 1649-1655.
[11]Persoone G. Development and fi rst validation of a“stock-culture free” algal microbiotest: The Algaltoxkit[C]//Wells P G, Lee K, Blaise C. Microscale aquatic toxicology, advances, techniques and practice.USA: CRC Press, 1998: 311-320.
[12]沈萍萍, 王朝晖, 齐雨藻, 等. 光密度法测定微藻生物量[J]. 暨南大学学报(自然科学与医学版), 2001,22(3): 115-119.
[13]黄美玲, 何庆, 黄建荣, 等. 小球藻生物量的快速测定技术研究[J]. 河北渔业, 2010, 4: 1-3.
[14]Guillard R R L, Ryther J H. Studies of marine planktonic diatoms. I.Cyclotella nanaHustedt andDetonula confervaceaCleve[J]. Canadian Journal of Microbiology, 1962, 8(2): 229-239.
[15]Guillard R R L. Culture of phytoplankton for feeding marine invertebrates[C]//Smith W L, Chanley M H.Culture of Marine Invertebrate Animals. New York:Plenum Press, 1975: 26-60.
[16]王波, 米铁柱, 吕颂辉, 等. 五种/株原甲藻核糖体小亚基(18S rRNA)基因克隆及序列分析[J]. 海洋与湖沼, 2006, 37(5): 450-456.
[17]Connell L B. Nuclear ITS region of the algaHeterosigma akashiwo(Chromophyta: Raphidophyceae)is identical in isolates from Atlantic and Pacific basins[J].Marine Biology, 2000, 136(6): 953-960.
[18]Thompson J D, Higgins D G and Gibson T J. CLUSTAL W:improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice[J]. Nucleic Acids Research, 1994, 22(22): 4673-4680.
[19]Tamura K, Dudley J, Nei M, et al. MEGA4: Molecular Evolutionary Genetics Analysis (MEGA)software version 4.0[J]. Molecular Biology and Evolution, 2007,24(8): 1596-1599.
[20]Saitou N, Nei M. The neighbor-joining method: A new method for reconstructing phylogenetic trees[J]. Molecular Biology and Evolution, 1987, 4(4): 406-425.
[21]Felsenstein J. Confidence limits on phylogenies: An approach using the bootstrap[J]. Evolution, 1985, 39:783-791.
[22]苟万里, 刘东艳, 甄毓, 等. 利用 rDNA和 ITS序列对 1株裸甲藻的初步鉴定[J]. 中国海洋大学学报,2004, 34(1): 75-83.
[23]郑俊斌, 张凤英, 马凌波, 等. 米氏凯伦藻18S rDNA和转录间隔区序列分析[J]. 上海海洋大学学报, 2009,18(6): 680-685.
[24]陈国福, 王广策, 张春云, 等. 一株裸甲藻类似种的形态和系统进化分析[J]. 科学通报, 2008, 53(3):299-305.
[25]Wilcox T P. Large-subunit ribosomal RNA systematics of symbiotic dinoflagellates: morphology does not recapitulate phylogeny[J]. Molecular Phylogenetics and Evolution, 1998, 10(3): 436-448.
[26]Pochon X, Montoya-Burgos J I, Stadelmann B, et al.Molecular phylogeny, evolutionary rates, and divergence timing of the symbiotic dinoflagellate genusSymbiodinium[J]. Molecular Phylogenetics and Evolution, 2006, 38(1): 20-30.
[27]Coffroth M A, Lewis C F, Santos S R, et al. Environmental populations of symbiotic dinoflagellates in the genusSymbiodiniumcan initiate symbioses with reef cni-darians[J]. Current Biology, 2006, 16(23): 985-987.
[28]Littman R A, van Oppen M J H, Willis B L. Methods for sampling free-livingSymbiodinium(zooxanthellae)and their distribution and abundance at Lizard Island(Great Barrier Reef)[J]. Journal of Experimental Marine Biology and Ecology, 2008, 364(1): 48-53.
[29]朱霞, 甄毓, 于志刚. 一株分离自胶州湾的裸甲藻形态相似种的分子系统学研究[J]. 海洋学报, 2011,33(1): 153-162.
[30]张玉娟, 曹宇, 王朝晖, 等. N 和 P对锥状斯氏藻(Scrippsiella trochoidea)生长及孢囊形成的影响[J].海洋环境科学, 2006, 25(4): 7-10.
[31]黄海燕, 陆斗定. 甲藻孢囊研究进展[J]. 海洋学研究,2009, 27(3): 85-92.
[32]王艳, 熊德甫, 顾海峰, 等. 锥状施克里普藻孢囊的多种形态特征[J]. 植物学报, 2009, 44(6): 701-709.
[33]O’Halloran C, Silver M W, Holman T R, et al.Heterosigma akashiwoin central California waters[J].Harmful Algae, 2006, 5(2): 124-132.
[34]Hara Y and Chihara M. Morphology, ultrastructure and taxonomy of the Raphidophycean algaHeterosigmaakashiwo[J]. Journal of Plant Research, 1987, 100(2):151-163.
[35]周成旭, 汪飞雄, 严小军. 温度盐度和光照条件对赤潮异弯藻细胞稳定性的影响[J]. 海洋环境科学, 2008,27(1): 17-19.
[36]颜天, 周名江, 钱培元. 赤潮异弯藻Heterosigma akashiwo的生长特性[J]. 海洋与湖沼, 2002, 33(2):209-214.
[37]马志珍, 张继红. 新分离出的5种微藻的适宜生长温度试验[J]. 水产科学, 1998, 17(2): 26-29.
[38]华雪铭, 周洪琪, 丁卓平. 温度和光照对微藻的生长,总脂肪含量及脂肪酸组成的影响[J]. 上海海洋大学学报, 1999, 8(4): 309-315.
[39]王正方, 张庆, 吕海燕. 温度、盐度、光照强度和pH对海洋原甲藻增长的效应[J]. 海洋与湖沼, 2001,32(1): 15-18.
[40]陈炳章, 王宗灵, 朱明远, 等. 温度、盐度对具齿原甲藻生长的影响及其与中肋骨条藻的比较[J]. 海洋科学进展, 2005, 23(1): 60-64.
[41]国家海洋局. 2009年中国海洋环境质量公报[M]. 北京: 海海洋出版社, 2010.
