椎间盘镜下椎管扩大减压术治疗退变性腰椎管狭窄症的临床研究
2012-10-11陈宣煌郑祖高张怀志占鲤生林海滨
陈宣煌,郑祖高,张怀志,占鲤生,林海滨
(莆田学院附属医院骨科,福建莆田351100)
随着人口的老龄化,退变性腰椎管狭窄症的发病率越来越高,给患者的生活带来极大的影响。手术是目前治疗腰椎管狭窄症,特别是经保守治疗无效者的主要方法。随着椎间盘镜手术(microendoscopic discectomy,MED)技术的不断发展以及操作者技术的不断改进和娴熟,其较低的医源性损伤已越来越多地得到医师及患者的关注,对于年老者及手术耐受性差的患者则显得尤为重要。该文以传统后路小切口开窗减压术为对照,探讨MED辅助下微创减压术治疗退变性腰椎管狭窄症的优势,为临床更好地选择减压术式提供相应的依据。
1 资料与方法
选取我院自2008年3月至2009年2月住院手术的46例腰椎管狭窄症患者,随机分为两组,MED辅助下椎管扩大减压术组(MED组);后路小切口开窗减压术组(开放组)。MED组23例,其中男12例,女11例。年龄最小38岁,最大79岁,平均(44.5±7.8)岁。病程最短13周,最长11年,平均(22.1±2.5)个月。病变节段:单节段19例,其中L3/42例,L4/512例,L5/S15例;双节段4例,其中L3~L52例,L4~S12例。开放组 23例,其中男 13例,女 10例,年龄最小35岁,最大72岁,平均(45.2 ±8.3)岁。病程最短14周,最长12年,平均(21.5 ±2.1)个月。病变节段单节段20例,其中 L3/41例,L4/514例,L5/S15例;双节段 3例,其中 L3~ L51 例,L4~S12例。所有患者拍摄腰椎正侧位片,显示Ⅰ度以内滑脱的3例患者行腰椎左右斜位片,未见峡部裂征象;术前CT或磁共振成像检查均与症状及体征相符。均经过至少6个月的保守治疗,症状无明显改善甚至症状加重而采用手术治疗(表1)。两组患者性别、年龄、病程、病变节段等比较具有均衡性(P>0.05)。

表1 两组患者的一般情况
1.2 方法
1.2.1 手术方法 采用德国鲁道夫(Rudolf)椎间盘镜系统。MED组C型臂X线机术前定位,采用后方入路,与病变椎间隙对应处做后正中1.6 cm纵切口。以各型号扩张管顺次分离骶棘肌,最后在扩张管外插入MED工作通道,并以固定臂固定于手术床上,取出扩张管。在工作通道内置入冷光源及摄像头。清除椎板间隙上的软组织,以刮匙分离上位椎板下缘及下关节内侧缘,用椎板咬骨钳稍咬除,做开窗。工作通道适当向外倾斜,以适应逐渐倾斜并狭窄的椎间隙,彻底去除椎间黄韧带,逐步扩大减压范围,向外侧咬除部分增生内聚的小关节突,进入椎管。沿神经根潜行扩大神经根管,使神经根自由向内移动达1.0 cm,用神经拉钩将硬膜囊及神经根拉向对侧,探查并咬除部分增生内聚的关节突、椎体后缘增生的骨质、钙化的后纵韧带、突出钙化的椎间盘等导致椎管狭窄的因素,解除硬膜囊及神经根的压迫。双侧狭窄者,在彻底减压一侧后,用无菌纱布填塞,从原切口进入另一侧,操作步骤同上;双节段者,彻底减压一个节段后,用无菌纱布填塞,定位、切开第二节段,操作步骤同上。双节段均彻底减压后用生理盐水冲洗切口,探查无活动性出血,拔出工作通道,留置橡皮引流条一枚,保障术后引流通畅;缝合腰骶筋膜,关闭切口。
开放组沿棘突后正中线做5~8 cm纵切口(双节段者约10~12 cm),暴露病椎板间隙,用骨凿凿除关节突内1/3,在黄韧带外用枪钳咬除上下椎板各1/3形成约1.8 cm×2.0 cm骨窗,切除黄韧带,探查神经根,用小骨凿和枪钳在侧隐窝狭窄处潜行扩大,使神经根充分松解,减压标准和双侧操作次序同MED组。
1.2.2 术后处理 两组术后处理基本相同:术后24 h拔除引流条,常规预防性应用抗生素3 d,应用地塞米松3 d防治神经根的炎症、水肿;术后第2天开始在床上进行双下肢直腿抬高功能锻炼,术后1周开始在医师指导下做腰背肌功能锻炼,并可带腰围下地行走,术后1个月去除腰围活动,1年内避免弯腰持重物及重体力劳动。
1.2.3 手术结果 所有手术病例均Ⅰ期愈合,无定位错误、神经根或马尾损伤及感染等并发症,开放组1例出现硬脊膜撕裂,该病例腰椎管狭窄伴相同节段腰椎间盘突出,在用髓核钳摘除髓核组织时不慎撕裂硬膜囊,见脑脊液漏,用脑棉片填塞,彻底完成减压后局部应用生物蛋白胶。见无明显脑脊液漏后逐层缝合,术后维持头低脚高位5 d,患者无特殊不适。所有病例无其他并发症。
1.3 观察指标及疗效评价标准 ①肌酸激酶水平:于术后1 d及术后1周检查生化全套测定。②手术时间:从切皮开始到关闭切口的时间段为手术时间,术后当日即予评定。③术中出血量:采用吸引器吸入血量及纱布称重测出血量之和。④术后住院时间:手术当日至出院当日的时间段,出院当日即予评定。⑤术后恢复正常生活时间:手术当日至能独立完成日常活动而不引起术前症状的时间段。出院后门诊、家庭或电话随访,进行详细查体,并由患者完成随访图表的填写,记录随访内容。⑥间歇性跛行改善情况:Deen等[1]的平板试验方法。先行1.2 km/h行走,休息后再行可耐受速度行走,记录第一症状出现的时间,计算每组术前1 d、术后3个月及术后1年每个时相点各自记录时间的平均值。⑦疼痛强度:采用视觉模拟评定(visual analogue scale,VAS)[2]。⑧下腰痛相关性功能障碍指数:采用Oswestry功能障碍指数(version 2.0)[3]。
1.4 统计学方法 所有数据应用SPSS 16.0软件进行统计分析。研究数据以均数±标准差(±s)表示,组间比较采用t检验;P<0.05为差异有统计学意义。
2 结果
2.1 手术时间、术中出血量、术后住院时间、恢复正常生活时间 MED组平均手术时间为(53.1±10.21)min,平均出血量(75.2 ±12.35)mL,较开放组(80.3 ±11.10)min、(120.5 ±13.12)mL 分别减少33.2 min和55.3 mL;术后住院时间、恢复正常生活时间分别为(8.6 ±1.57)d 和(33.4 ±8.22)d,较开放组(16.7 ±2.16)d、(50.6 ± 10.12)d 分别减少6.1 d和 27.2 d,差异均有统计学意义(P < 0.05)(表2)。

表2 手术时间、术中出血量、术后住院时间、恢复正常生活时间比较
2.2 血清肌酸激酶变化情况 两组间比较,MED组在术后1 d、7 d的血清CK水平均明显低于开放组(P<0.05)(表3)。结果表明,与开放手术相比,MED辅助下手术对手术局部肌肉组织损伤程度较小,术后血清CK水平明显低于开放手术,并能比开放手术更快地恢复到正常水平。
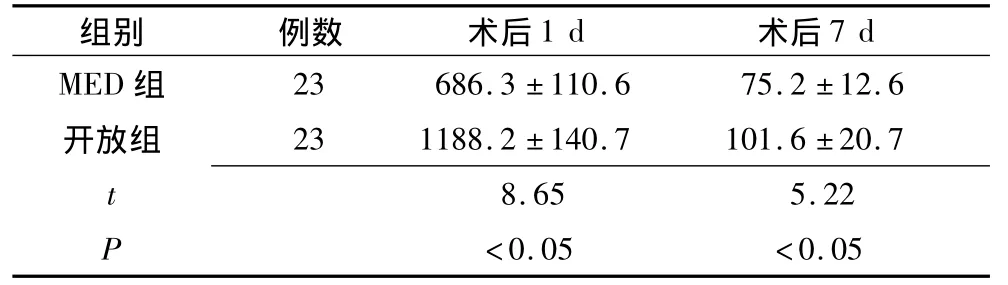
表3 血清肌酸激酶变化 (U/L)
2.3 间歇性跛行评定 两组间比较,术后3个月的差异有统计学意义(P<0.05),术后1年的差异无统计学意义 (P>0.05)(表4)。结果表明,MED辅助下手术与开放手术均能较好地改善间歇性跛行症状,MED辅助下手术能更快地改善间歇性跛行症状。

表4 间歇性跛行评定 (min)
2.4 VAS及 ODI评分比较 MED组术后3个月VAS及ODI较开放组均有统计学意义(P<0.05),术后1年两组间VAS及ODI比较差异均无统计学意义(P>0.05)(表5)。结果表明,MED辅助下椎管扩大减压术及开放减压术均能获得较好的手术疗效,其中MED辅助下椎管扩大减压术能在短期内取得较开放减压术更好的疗效。
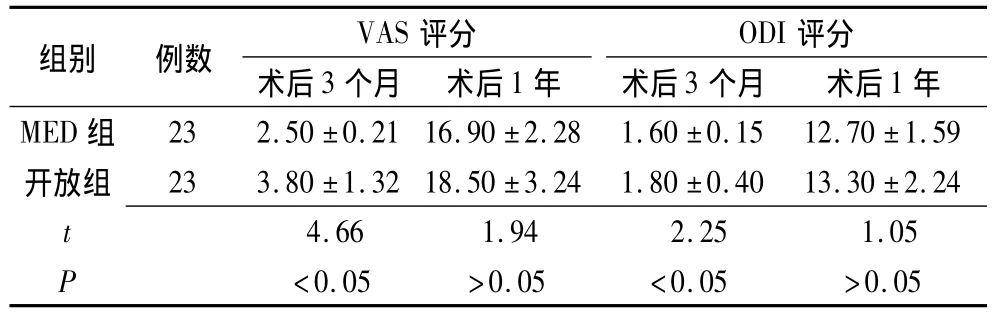
表5 术后3个月及术后1年的VAS、ODI评分情况 (分)
3 讨论
3.1 退变性腰椎管狭窄症的手术治疗 传统的减压术即后路开放行全椎板切除术,在较长一段时间内一直是标准的减压术。但是随着手术数量增多和时间延长,经长期随访发现手术过多地破坏了脊柱后柱的稳定结构,导致节段间的水平、角度以及旋转不稳[4]。Stevens 等[5]通过临床实验证明,传统腰椎后路开放式手术中,肌肉神经支配和肌肉功能受损是术后腰背痛发生的重要原因。
随着现代脊柱外科理论和技术水平的不断向前发展,退变性腰椎管狭窄症的手术方法朝着既要最大限度地解除硬膜囊及神经根所受的压迫,也要尽量减少脊柱结构的破坏、保持脊柱的稳定性、减轻患者痛苦的方向发展。对退变性腰椎管狭窄症尤其是多节段退变性腰椎管狭窄进行手术治疗,术中如何做到减压与稳定的统一,是当今乃至今后骨科医师需要认真对待的一个问题。最近,由于认识到原发性与退行性狭窄压迫神经的结构大多位于椎间平面,许多作者不主张单一横式大范围减压的手术方法,而强调针对不同情况,采取有限化手术,即“解剖结构切除有限化,椎管减压有效化”的治疗原则。MED辅助下减压术在保证减压充分的前提下,尽可能少地影响脊柱稳定结构;同时利用冷光源及视频系统,视野清晰,减少了神经根损伤的概率,在精确减压的同时,减少了对手术区域的不必要干扰,某种程度上减少了术后瘢痕形成及椎板残端再生,保持了脊柱的稳定性。
3.2 MED辅助下椎管扩大减压术的优点 Rosen等[6]研究认为,椎板切除在下关节突基部超过1/4以上易引起骨折而继发腰椎滑脱。传统的椎管减压术需要剥离单侧或双侧椎旁软组织,切除椎板及其韧带,手术时间长,术中失血多;剥离的骶棘肌术后通过瘢痕相互愈合,破坏了其正常的生理特性,影响了躯干肌肉的强度,导致部分患者术后残留长期腰背部疼痛[7]。Datta等[8]研究发现,在行腰椎开放手术时拉钩对椎旁肌肉的长时间牵拉可导致肌内灌注压明显降低甚至呈无灌流状态,导致椎旁肌损害,与术后患者下腰痛有一定相关性。同时,对于脊柱后柱结构的破坏使手术区域邻近椎体遭受异常的载荷,增加邻近节段退变的发生[9],使术后复发率及术后腰椎不稳发生率有所提高。文献报道术后中远期腰椎不稳定和椎管再狭窄发生率较高,再手术率高达23%[10]。术中剥离的骶棘肌创面上成纤维细胞侵入血肿是导致瘢痕形成的重要原因。而保留部分椎板能作为天然的阻隔物,有效防止硬脊膜外瘢痕的形成[11]。
多裂肌与邻近肌肉之间存有间隙,肌束间本身也有诸个分裂面(可分为5条肌束),通过这些间隙和分裂面钝性分离肌束,可减少对多裂肌的损伤[12]。本研究中MED组病例采用MED辅助下椎管扩大减压术,不剥离或尽量少剥离骶棘肌,尽量减少椎板切除,保留了绝大部分后柱结构,对脊神经后支的保护显而易见,利用扩张管逐渐撑开肌肉间隙过程中,肌纤维被逐渐推开,其排列顺序不会发生明显改变,手术以后肌纤维之间基本不形成瘢痕组织,保留了椎旁软组织的生理功能,通过MED扩张器暴露手术区域,对肌肉的牵拉均匀分布在扩张器四周,降低了传统牵拉方法使局部肌肉受到异常载荷而导致肌肉变性、坏死的发生率。因此,对于预防和减少硬脊膜外瘢痕形成,降低术后腰背部疼痛的发生率有非常重要的意义。
3.3 MED辅助下椎管扩大减压术的操作体会
3.3.1 手术定位 镜下手术,由于其微创的要求,切口小、暴露的范围较传统手术小、操作通道狭小等特点,对定位的要求就显得更为重要。手术中定位的相应要点如下:①术前详问病史,仔细检查神经根受累症状,同时结合影像学资料判断病变部位。术前通过阅片可了解以下几方面:a.有无腰椎骶化、骶椎腰化和腰椎六椎体畸形等,但无论有无上述情况均将最下位椎间隙定为L5/S1椎间隙。b.椎板间隙与椎体间隙的对应关系。可预知进入椎管的方式(椎板间隙入路或椎板骨性入路),关节突关节的咬除范围。c.椎板间隙的大小及椎板与后正中线的夹角。可预知开骨窗时通道管与后正中线的角度和有效避免因椎间隙过大,同时黄韧带较薄发生置入扩张管时直接进入椎管损伤神经组织的危险。d.关节突关节是否有增生、肥大和内聚,以确定准确的减压范围。②双侧髂棘连线与棘突中线的对应关系不是恒定的。术前一定要摄腰椎正侧位X线片,以确定体表定位点。③先切开皮肤,用小剥离器贴棘突推开软组织,单指探查椎板间隙后按顺序放入扩张管后,再透视以确保定位无误。
3.3.2 避免片面追求小切口 需要强调的是,微创脊柱手术不是盲目追求皮肤切口的长短,尽量减少对脊柱正常解剖结构的破坏才是微创手术的真正目的。皮肤切开时,潜行切开此筋膜,并使其切口长度略大于通道管直径,以便术中能较方便地调整通道管。小直径扩张管插入后,紧贴关节突关节面向周围推移,可以推开减压区域的软组织,使手术视野更加清楚。腰背筋膜弹性较差,扩张管不能很好地扩张,且扩张后调整角度困难,而在减压时往往需要通过调整扩张器的角度来获得一个理想的视野。本组病例皮肤切口均稍大于MED通道管直径,但在处理椎旁组织和脊柱骨性结构时,在满足彻底减压的前提下,尽量多地保留了这些组织。微创脊柱手术技术要求高,需要对脊柱解剖结构有很好的理性认识[13]。并需熟悉内镜影像系统,结合内镜系统获得对手术区域一个全面的三维认识,对于减少手术并发症、缩短手术时间起了积极作用。
3.3.3 减少术中出血和有效止血 MED切口内少量的出血就会导致视野模糊。如盲目操作,极易撕裂硬膜,损伤神经根。因此,减少术中出血并有效止血,是腰椎后路椎间盘镜手术顺利完成的一个关键。首先,使腹部悬空的正确体位能有效减少术中椎管内出血。其次,切口前于皮下及椎板上注入适量肾上腺素的局麻药可减少术中出血量。再者,术中对不能避开的椎管内前静脉可用双极电凝止血。但术中大多数是渗血,可用冰盐水冲洗或(和)小棉片压迫止血。术毕用明胶海绵压迫止血。此外,控制性降压的合理使用,尤其对高血压患者和手术紧张者,对减少术中出血极为有效。
3.3.4 充分、有限减压 既要减压彻底,又要针对造成狭窄的原因精确减压,避免对椎管及周围组织的过度干扰。对于神经根管狭窄者,首先用神经探钩沿硬膜囊和神经根侧方由头端向尾端边滑边小心分离粘连带,注意神经根起始部和侧隐窝处的分离。用斜坡枪式咬骨钳潜行性咬除侧隐窝内的黄韧带。如关节突增生引起骨性狭窄时,还要少量潜行咬除下关节突内侧缘,甚至上关节突的内侧缘。对于伴有同节段腰椎间盘突出症的患者,用神经牵开器向内侧或外侧(腋下型椎间盘突出)摘除椎间盘髓核组织的同时咬除部分椎板下缘及椎体后上缘骨唇,向前方及外侧扩大神经根管,使硬膜囊均匀无压迹和搏动恢复正常。镜下减压标准:神经根显露长约1 cm、能自由移动1 cm(镜下约视野的半径);中央管狭窄者受累的硬膜囊及神经根能自由移动,大号球形探头可沿神经根插入神经根管。值得注意的是:①在切除椎间盘过程中,限制牵拉神经根的方向,避免牵拉时间过长,过度牵拉神经根,牵拉程度不应超过中线,并应间歇牵拉神经根。②在充分减压的前提下最大限度地保留关节突的上下关节面,能较好地保持脊柱的稳定性和减少并发症的发生。
MED辅助下手术是脊柱外科一项理想的微创手术方式,治疗腰椎管狭窄症疗效显著。它具有创伤小、手术时间短、疗效好、恢复快、患者易于接受、术后患者满意度高等明显的优点,具有广阔的临床推广价值。
[1]Deen HG,Zimmerman RS,Lyons MK,et al.Test-retest reprroducibility of the exercise treadmill examination in lumbar spinal stenosis[J].Mayo Clin Proc,2000,75(10):1002-1007.
[2]Majani G,Tiengo M,Giardini A,et al.Relationship between MPQ and VAS in 962 patients.a rationale for their use[J].Minerva Anestesiol,2003,69(1/2):67-73.
[3]Fairbank JC,Pynsent PB.The Oswestry disability index[J].Spine,2000,25(22):2940-2952.
[4]Ahn Y,Lee SH,Park WM,et al.Percutaneous endoscopic lumbar discectomy for recurrent disc herniation:surgical technique,outcome and prognostic factors of 43 consecutive case[J].Spine.2004,29(16):E326-E332.
[5]Stevens KJ,Spenciner DB,Griffiths KL,et al.Comparison of minimally invasive and conventional open posterolateral lumbar fusion using magnetic resomance imaging and retraction pressure studies[J].J Spinal Disord Tech,2006,19(2):77-86.
[6]Rosen C,Rothman S,Zigler J,et al.Lumbar facet fracture as a possible source of pain after lumbar laminectomy[J].Spine,1991,16(6 Suppl):S234-S238.
[7]Salerni AA.A minimally invasive approach for posterior lumbar interbody fusion[J].Neuosurg Focus,2002,13(6):e6.
[8]Datta G,Gnanalingham KK,Peterson D,et al.Back pain and disability after lumbar laminectomy:is there a relationship to muscle retraction?[J].Neurosurgery,2004,54(6):1413-1420.
[9]Hilibrand AS,Robbins M.Adjaeent segment degeneration and adjacent segment disease:the consequences of spinal fusion?[J].Spine,2004,4(6 Suppl):190S-194S.
[10]Katz JN,Lipson SJ,Chang LC,et al.Seven-to-10-year outcome of decompressive surgery for degenerative lumbar spinal stenosis[J].Spine,1996,21(1):92-98.
[11]Song J,Park Y.Ligament-sparing lumbar microdiscectomy:technical onte[J].Surg Neurol,2000,53(6):592-596.
[12]Kuriyama N,Ito H.Electromyographic functional analysis of the lumbar spinal muscles with low back pain[J].J Nihon Med Sch,2005,72(3):165-173.
[13]German JM,Foley KT.Minimal access surgical techniques in the management of the painful lumbar motion segment[J].Spine,2005,30(16 Suppl):S52-S59.
