异噁草松降解酶的定位及酶学性质研究
2012-09-28刘亚光步金宝李晓雨黄晓敏苑石磊
刘亚光, 冯 蕾, 步金宝, 李晓雨, 李 威, 黄晓敏, 苑石磊
(1.东北农业大学农学院,哈尔滨 150030;2.黑龙江省农垦科学院水稻研究所,佳木斯 154007)
异噁草松(clomazone)是20世纪80年代FMC公司研制的一种噁唑酮类除草剂,主要作为苗前或苗后选择性除草剂防除一年生禾本科杂草和阔叶杂草[1],因其具有对作物安全、除草广谱、适应性强、持效期长、增产显著等特点而被推广应用于多种作物田[2-3],使其应用范围呈不断扩大的趋势[4],目前已普及应用于甘蔗、油菜、花生、棉花等作物田[5],但该除草剂在水中残留至少为130d[6-7],在土壤中持效期较长,严重污染土壤并对后茬作物产生药害,进而影响种植结构的调整,造成农业生产损失巨大,其危害已成为农业生产上迫切需要解决的问题。异噁草松在土壤中不易发生光降解和水解,其降解主要依靠微生物活动,因此利用微生物降解残留除草剂,是一种安全有效并切实可行的途径[8]。
众所周知,微生物主要通过其体内的降解酶对农药进行降解,而降解不同农药的酶在微生物细胞中的位置不同。生物酶在生物量转化和积累的过程中起主要作用,因此研究关键酶的酶学性质对提高生物体内酶促反应速度具有不可忽视的重要意义[9]。目前在农药酶降解领域研究比较广泛的是有机磷类农药、菊酯类农药和三氮苯类农药等,对于异噁草松降解酶的研究还未见报道。
本课题组已筛选出的异噁草松高效降解菌W2[10],在90d内对土壤中异噁草松的降解率为85%,降解半衰期仅为32d,并对影响降解菌W2生物修复效果的因素进行了研究[11],张金花探明了异草酮高效降解菌 W2的最佳发酵培养基[12]。本试验采用气相色谱技术,对降解菌W2有效酶成分在细胞中的位置进行分析,并对其降解酶的酶学性质进行研究,为降解酶在田间的应用奠定应用基础,也对异噁草松农田污染的生物修复提供重要的理论依据。
1 材料与方法
1.1 试验材料
供试菌株:异噁草松高效降解菌 W2(短杆菌属Brevibacterium)[11],由东北农业大学杂草与农药实验室提供,筛选自东北农业大学香坊农场长期施用过长残效除草剂异噁草松的地块。
供试药品:99.0%异噁草松标准品,哈尔滨利民农化有限公司提供。
供试仪器:气相色谱仪 GC-2010,日本岛津公司。
1.2 试验方法
1.2.1 异噁草松降解酶的提取及定位测定
参考降解菌不同细胞组分的分离方法[13],取发酵后的菌液7 000r/min离心10min。收集上清液,经微孔滤膜(0.22μm)过滤除菌,根据无菌滤液体积加适量的(NH)2SO4粉末,混匀至饱和度为100%,4℃盐析过夜,离心收集沉淀。用pH7.0的0.05mol/L 的 KH2PO4-NaOH 缓冲液溶解后,再用同样缓冲液透析至无SO24-,收集透析液,得胞外粗酶液。
收集菌体,按照1g∶3mL的比例将菌体悬浮于缓冲溶液中,冰浴下应用功率为350W的超声波破碎仪破碎20次,每次6s,间隔8s,然后7 000r/min离心10min,上清液经0.22μm微孔滤膜过滤除菌,收集得胞内粗酶液。
离心后的沉淀为菌体细胞碎片,用缓冲液重悬,得菌体细胞碎片悬浮液。
测定降解菌 W2不同组分的酶活性,确定异噁草松降解酶的位置。
1.2.2 异噁草松降解酶活力的测定方法
将2.7mL含有10mg/L异噁草松的缓冲溶液(缓冲液为0.05mol/L pH7.0的 KH2PO4-NaOH)在30℃恒温水浴锅中预热5min,加入0.3mL同样预热过的粗酶液,置于30℃水浴条件下反应60min后加入1.0mol/L HCl溶液0.2mL终止反应,以未添加酶液的处理作为对照。提取净化反应溶液,应用气相色谱仪对异噁草松进行定量分析。在本试验条件下,每1min每1mL蛋白酶降解1μg异噁草松定义为1个酶活力单位。
1.2.3 异噁草松降解酶性质的研究
1.2.3.1 降解酶在不同酶促反应时间对异噁草松的降解情况
于含有10mg/L异噁草松的缓冲溶液(缓冲液为0.05mol/L pH7.0的 KH2PO4-NaOH)体系中,加入降解菌粗酶液,置于30℃水浴条件下进行酶促反应。分别在反应0、10、20、30、40、50、60、90、120、150、180、210min终止反应,在不同反应时间条件下,分别设置不添加酶液处理的对照。应用气相色谱仪测定异噁草松的含量,计算降解酶对异噁草松降解率。以酶促反应时间(min)为横坐标,异噁草松相对降解率(%)为纵坐标,绘制进程曲线,确定最佳酶促反应终止时间。
1.2.3.2 酶浓度对降解酶活力的影响
在含有10mg/L异噁草松的缓冲溶液体系中分别加入0.15、0.3、0.45、0.6、0.75、0.9mL降解粗酶液,使最终测定酶活体系为3mL。将混合溶液置于30℃水浴条件下反应60min后终止反应,以未添加酶液的处理作为对照。应用气相色谱仪测定异噁草松的含量,计算降解酶活力,确定最佳粗酶液添加量。
1.2.3.3 最适酶促反应pH的确定
在pH 值分别为5.5、6.0、6.5、7.0、7.5、8.0和8.5的2.67mL磷酸盐缓冲液中加入30μL异噁草松溶液,再各加入30℃预热的酶液0.3mL,即刻摇匀计时,置于30℃水浴锅中进行酶促反应,60min后终止反应。在不同pH条件下,分别设置不添加酶液处理的对照。应用气相色谱仪测定异噁草松的含量,计算相对降解酶活力,确定最适酶促反应pH。
1.2.3.4 最适酶促反应温度的确定
于2.7mL含有10mg/L异噁草松的缓冲溶液体系中加入0.3mL降解菌粗酶液,分别置于20、25、30、35、40、45、50 ℃水浴条件下进行酶促反应,60min后终止反应,在不同反应温度条件下,分别设置不添加酶液处理的对照。应用气相色谱仪测定异噁草松的含量,计算降解酶活力,确定最适酶促反应温度。
1.2.3.5 异噁草松降解酶动力学常数的测定
取100mg异噁草松原药溶于100mL 0.05mol/L pH7.5 的 KH2PO4-NaOH 缓 冲 溶 液 中,即 为1 000mg/L的母液。用移液枪分别吸取5.000、2.500、1.670、1.250、1.000、0.835、0.715、0.625mL用缓冲溶液定容至100mL,配制成浓度为50、25、16.7、12.5、10、8.35、7.15、6.25mg/L 的异噁 草松缓冲溶液体系,于2.7mL的体系中加入0.3mL酶液,于35℃水浴锅中反应30min。应用气相色谱仪测定异噁草松的含量,计算反应体系中异噁草松降解速度。以异噁草松浓度的倒数(mL/mmol)为横坐标,以速度的倒数(min/mmol)为纵坐标作Lineweaver-Burk图,并计算出降解酶对异噁草松降解的米氏常数Km和最大反应速率Vmax。
1.2.4 气相色谱分析条件
色谱 柱:RTX-1701石 英 毛 细 管 柱,30m×0.25mm×0.25μm;进样口温度:200℃;柱温:起始温度200℃,保持4min,以10℃/min升温至220℃,保持4min;进样量:1.0μL;检测器温度:ECD检测器,280℃;分流比:3.0;保留时间:10min。
2 结果与分析
2.1 异噁草松降解酶的定位
微生物降解农药的主要作用机理是通过其分泌的降解酶,将农药降解为小分子物质,已成为当今世界各个领域研究热点[14-15]。研究表明,降解农药的有效酶活性物质主要在微生物细胞内[16],但是胞外酶和胞壁酶等细胞其他位置的酶有时也可表现出降解活性[17]。分别测定 W2菌体细胞碎片悬浮液、胞外粗酶液和胞内粗酶液对异噁草松的降解能力,确定异噁草松的降解酶的位置。以添加相同体积的缓冲液作为对照,试验结果见表1和图1~4。
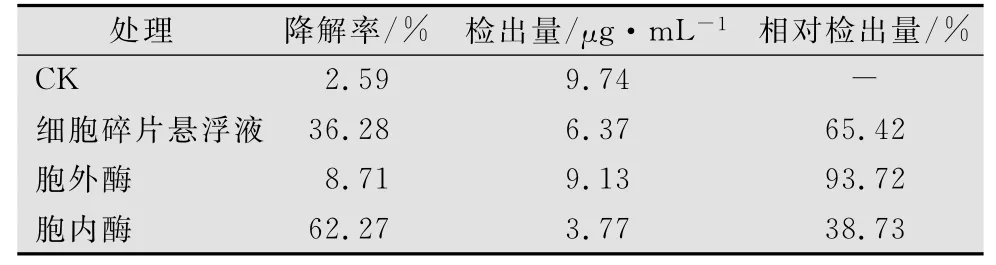
表1 降解菌W2不同细胞组分对异噁草松的降解
由表1和图1~4可以看出,60min反应终止后细胞不同组分对异噁草松(10mg/L)降解效果有显著差异,且降解率均高于对照处理。胞内无细胞提取液的降解活性最大,降解率可达62.27%;细胞碎片悬浮液的降解活性略低,降解率为36.28%,超声波破碎后,会有部分有效降解活性物质残存于细胞碎片中,或者细胞壁或膜上存在可降解异噁草松的酶;胞外粗酶液的降解活性最低,降解率为8.71%,死亡的菌体释放到细胞外后仍会有少部分降解物质具有活性。因此推断降解异噁草松的有效活性物质主要存在于微生物细胞内,属于胞内酶。
图4 胞内酶对异噁草松的降解能力
2.2 异噁草松降解酶性质的研究
2.2.1 降解酶酶促反应时间的确定
应用气相色谱仪分别测定酶促反应0、10、20、30、40、50、60、90、120、150、180、210min下异噁草松的含量,计算降解酶对异噁草松降解率。以酶促反应时间(min)为横坐标,异噁草松相对降解率(%)为纵坐标,绘制进程曲线,以确定最佳酶促反应终止时间。酶促反应进程曲线如图5所示。
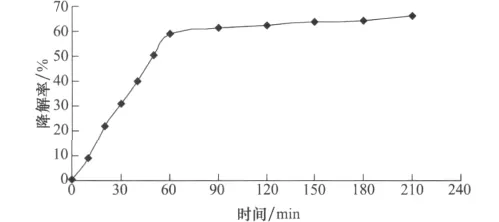
图5 酶促反应进程曲线
由图5酶促反应进程曲线可以看出,在30℃,0.05mol/L pH 7.0的磷酸盐缓冲液中,降解酶对异噁草松的降解率随时间的增加逐渐增大。当酶促反应时间范围0~60min时,异噁草松降解率与反应时间呈直线关系,斜率明显大于60~210min;当时间大于60min时,曲线开始弯曲;随反应时间延长,曲线趋于平坦,斜率变小,即酶促反应速度下降。说明反应初始速度的时间范围为0~60min,因此酶活力测定应于60min时终止反应。
2.2.2 酶浓度对降解酶活力的影响
不同体积粗酶液的添加会导致酶活力反应体系中酶浓度的变化,从而对异噁草松产生不同的降解效果。于3mL酶活体系中加入0、0.15、0.3、0.45、0.6、0.75、0.9mL 降解 粗 酶液 (蛋白质含 量为0.646mg/mL),60min后终止酶促反应,测定降解酶活力,明确最佳粗酶液添加量,结果如图6所示。
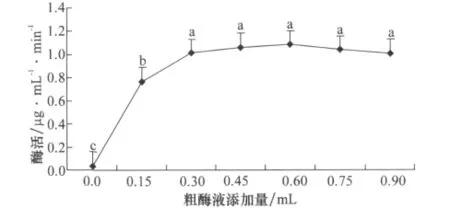
图6 粗酶液添加量对异噁草松降解酶活力的影响
由图6可知,不同粗酶液添加量对异噁草松降解酶活力的影响不同,在0~0.6mL范围内时,降解酶活力随着酶液添加量即酶浓度的增加而增加,但增加趋势逐渐趋于平缓;而在0.6~0.9mL范围内时,降解酶活力呈下降趋势,这是因为粗酶液中含有抑制异噁草松降解的物质,高浓度粗酶液中夹带更多抑制物,因此导致降解效果下降。方差分析结果表明,酶液添加量为0.3~0.9mL处理间无显著差异,说明在此酶液添加量范围内,粗酶液浓度的变化对异噁草松的降解效果影响较小,如果考虑添加酶液成本,则应该选择粗酶液添加量为0.3mL。
2.2.3 最适酶促反应pH的确定
不同酸碱条件对酶促反应效果影响较大。调节各反应体系pH 分别为5.5、6.0、6.5、7.0、7.5、8.0、8.5,60min后终止酶促反应,在不同pH条件下,分别设置不添加酶液处理的对照,计算降解酶活力,确定最适酶促反应pH,结果如图7所示。
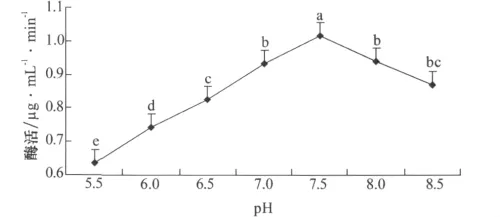
图7 pH对降解酶活力的影响
由图7可知,不同pH对降解酶活力影响极为显著,在5.5~7.5范围内相对降解酶活力随pH的增加而增大,在pH为7.5时,相对降解酶活力最大,为1.016μg/(mL·min);在7.5~8.5范围内降解酶活力逐渐下降,但下降幅度0.147μg/(mL·min)远远小于5.5~7.5范围内下降幅度0.383μg/(mL·min),说明中性偏碱性条件下降解酶活力较高。方差分析结果表明,pH为7.5时相对降解酶活力与其他pH相比差异显著,因此异噁草松降解酶最适反应pH为7.5。
2.2.4 最适酶促反应温度的确定
温度对酶促反应速度影响很大,在最适温度范围内,降解酶活力最大,酶促反应速度最快。调节酶促反应体系pH 值为7.5,分别置于20、25、30、35、40、45、50℃水浴条件下进行60min后终止反应,在不同反应温度条件下,分别设置不添加酶液处理的对照,计算降解酶活力,确定最适酶促反应温度。结果如图8所示。
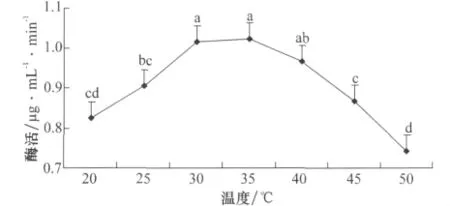
图8 温度对降解酶活力的影响
由图8可以看出,异噁草松降解酶在20~50℃范围内,相对酶活力值均高于0.7μg/(mL·min),降解酶的催化作用并没有发生可逆性变。相对酶活力随着温度的升高而增大,当温度升至35℃时,相对酶活力值最大为1.023μg/(mL·min),当温度大于35℃时,相对酶活力值迅速下降,50℃时为0.743μg/(mL·min),相较于最大值损失27.4%。经方差分析可知,30、35、40℃处理间相对酶活力差异不显著,而与其他处理差异显著,说明异噁草松降解酶最适温度范围为30~40℃,其中最适温度为35℃。
2.2.5 异噁草松降解酶动力学常数
动力学常数可以反映酶与底物的关系,是区别不同反应底物的重要特征性常数。调节含有50、25、16.7、12.5、10、8.35、7.15、6.25mg/L 异噁草松溶液的酶促反应体系pH为7.5,于35℃水浴锅中反应30min,计算反应体系中异噁草松降解速度。以异噁草松浓度的倒数(mL/mmol)为横坐标,以速度的倒数(min/mmol)为纵坐标作 Lineweaver-Burk图(结果如图9所示),根据公式计算出降解酶对异噁草松降解的米氏常数Km和最大反应速率Vmax。
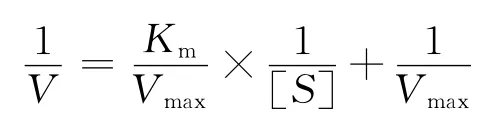
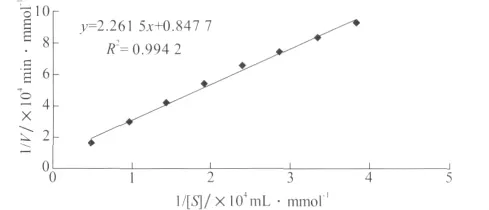
图9 异噁草松降解酶的Lineweaver-Burk图
由图9可知,异噁草松降解酶的Lineweaver-Burk曲线标准方程为y=2.265 1x+0.847 7,相关系数R2=0.994 2,根据标准方程可计算得到降解酶米氏常数Km=2.668×10-4mmol/mL,最大反应速率Vmax=0.322×10-4mmol/min。此动力学常数反映了降解粗酶液在以异噁草松为反应底物时的酶学性质,是区别于其他底物的主要特征性常数。
3 结论与讨论
3.1 异噁草松降解酶在细胞中位置的探讨
微生物降解农药的实质是酶促反应,对于不同的农药来说降解酶在细胞中的位置不用,如果降解酶是胞外酶,则无菌体的富集培养基可以对农药表现出较强的降解活性;如果是胞壁酶,则离心的细胞碎片悬浮液可以高效降解农药;如果是胞内酶,则离心去除细胞碎片的胞内粗提液对农药的降解率较高[17]。本研究发现胞内无细胞提取液的降解活性最大,其次为细胞碎片悬浮液,胞外粗酶液的降解活性最低。分析认为胞外粗酶液会有降解活性是因为会有一些死亡的菌体释放到细胞外后,仍会有少部分降解物质具有活性;细胞碎片悬浮液会有降解活性是由于经过超声波破碎后,会有部分有效降解活性物质残存于细胞碎片中,或者细胞壁或膜上存在可降解异噁草松的酶,但这种酶与胞内酶是否属于同一种酶、降解机理是否相同仍有待于进一步研究。鉴于降解菌W2在降解异噁草松的过程中,胞内无细胞提取液的降解率最大,推断异噁草松降解酶属于胞内酶。
3.2 异噁草松降解酶酶学性质研究的意义
探讨降解酶酶学的性质,对利用微生物治理异噁草松污染土壤和实现降解酶的工业化生产具有重要的现实意义。酶促反应初速度的时间范围是酶动力学性质研究的必要组成部分和重要前提条件,而反应进程曲线则可以很好地反映酶促进行的时间范围,本试验研究结果表明在0~60min内,以异噁草松为底物的酶促反应一直在初速度的范围内进行,且在60min时达到最大值,这为明确异噁草松降解酶的酶学性质提供了研究基础。
酶促反应速度受酶浓度、pH和温度等因素的影响[18],因此本试验对异噁草松降解酶的粗酶液添加量、最适反应pH和最适反应温度分别进行了研究,为降解酶制剂的规模化生产及治理土壤污染提供理论依据和技术支持。酶促反应速度与酶浓度成正比,底物转化的速度随着酶浓度的增大而加快,但是本试验研究结果表明,粗酶液添加量为0.6~0.9mL范围内时,酶活力呈下降趋势,分析认为粗酶液中可能含有抑制异噁草松降解的物质,高浓度粗酶液中会夹带更多的抑制物,导致降解效果下降,因此应该继续对异噁草松降解酶的分离纯化进行研究,从而获得更高效降解酶。在适宜的pH范围内,降解酶会表现出酶活力。异噁草松降解酶最适pH为7.5,当pH大于或小于7.5时,酶活力都会降低,分析认为pH会改变反应底物分子和酶分子的带电状态,在非最适pH条件下酶与底物的结合受到阻碍而导致酶活力下降。在最适的酶促反应温度范围内,当温度每升高10℃时,反应速度可以相应提高1~2倍,不同降解酶的最适反应温度不同。异噁草松降解酶最适温度范围为30~40℃,其中最适温度为35℃,温度过高或过低都会降低酶的催化效率。
动力学常数Km值和Vmax是反映酶动力学性质的重要特征性常数,体现了酶与底物结合的牢固程度和酶的特异性质,对研究酶的主要催化方向和生理生化功能具有重要的意义。本试验以异噁草松为反应底物,得到米氏常数Km为2.668×10-4mmol/mL,最大反应速率Vmax为0.322×10-4mmol/min,这为异噁草松降解酶学性质的深入研究提供基础依据。
[1] 刘亚光,杨谦.长残留除草剂广灭灵生物测定方法的研究[J].东北农业大学学报,2005,36(4):463-466.
[2] Renner K A,Powell G E.Velvetleaf(Abutilon theophrasti)control in sugarbeet(Beta vulgaris)[J].Weed Technology,1991,5(1):97-102.
[3] Semidey N.Clomazone and oxyfluorfen for weed control in transplanted cabbage(Brassica oleracea L.)[J].Journal of Agriculture of the University of Puerto Rico,1997,81(34):203-210.
[4] Baldwin F L,Talbert R E,CareyⅢ V F,et al.A review of propanil-resistant Echinochloa crus-galli in Arkansas an field advice for its management in dry seeded rice[C]∥Brighton crop protection conference:weeds.Proceedings of an international conference,Brighton,UK,20-23November,1995,2:577-585.
[5] Gumz M S,Weller S C.Mesotrione and clomazone effects on peppermint and spearmint growth and yield[J].North Central Weed Science Proceedings,2005,60:60.
[6] Sergiane Souza Caldas,Fabiane Pinho Costa,Ednei Gilberto Primel.Validation of method for determination of different classes of pesticides in Aqueous samples by dispersive liquidliquid microextraction with liquid Chromatography-tandem mass spectrometric detection[J].Analytica Chimica Acta,2010,665(1):55-62.
[7] Zanella R,Prirnel E G,Machado S L O,et al.Monitoring of the herbicide clomazone in environmental water samples by solid-phase extraction and high-performance liquid chromatography with ultraviolet detection[J].Chromatographia,2002,55(9/10):573-577.
[8] Mervosh T L,Sims G K,Stoller E W.Clomazone fate in soil as affected by microbial activity,temperature,and soil moisture[J].Agricultural and Food Chemistry,1995,43(2):537-543.
[9] Goutami Banerjee,Scott-Craig J S,Walton J D.Improving enzymes for biomass conversion:A basic research perspective[J].Bioenergy Research,2010,3(1):82-92.
[10] 刘亚光,闫春秀,赵滨.降解除草剂异噁草松细菌的分离、鉴定及生长特性[J].中国油料作物学报,2007,29(3):328-332.
[11] 刘亚光,刘蕊,唐广顺.影响降解菌W2修复异噁草酮污染土壤的三种因子的优化[J].植物保护,2011,37(3):93-98.
[12] 张金花,赵滨,李影,等.异噁草松高效降解菌 W2发酵培养基的研究[J].中国植保导刊,2011,31(11):5-9.
[13] 兰亚红,谢明,陈福良等.施氏假单胞菌JHY01菌株毒死蜱降解酶的定位及其提取条件的优化[J].中国生物防治,2008,24(4):349-353.
[14] Rutwik R M T,Sivakami S.Degradation of chlorpyrifos by an alkaline phosphatase from the cyanobacteriumSpirulina platensis[J].Biodegradation,2010,21(4):637-644.
[15] 刘幽燕,鄢恒宇,李青云,等.一株产碱杆菌DN25中降氰酶的提取和特性研究[J].环境科学与科技,2008,31(5):11-13.
[16] 蔡颖慧,张惠文,苏振成,等.敌敌畏降解菌的分离鉴定及降解特性研究[J].生物技术,2009,19(2):59-62.
[17] 黄强.水中毒死蜱的D3降解菌固定化与酶促降解研究[D].合肥:安徽农业大学,2008.
[18] 王国惠.环境工程微生物学[M].北京:科学出版社,2011:82-93.
