灰飞虱体内Wolbachia的检测及三种稻飞虱Wolbachia的wsp基因差异分析
2012-09-28许存宾王锡锋
许存宾, 刘 艳, 王锡锋
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
Wolbachia是一类细胞内共生菌,是属于α-变形菌门的立克次氏体。最早于1924年在尖音库蚊(Culex pipiens Linnaeus)的生殖器官内发现,命名为 Wolbachia pipienti[1]。Wolbachia 普遍寄生于昆虫、甲壳动物、螨虫和丝状线虫类动物体内,据估计66%的昆虫都感染有Wolbachia[2]。Wolbachia随母系遗传,参与调控寄主的诱导细胞质不亲和(cyto-plasmic incompatibility,CI)、雄性致死(male-killing)、雌性化(feminization)、孤雌生殖(parthenogenesis inducing)等多种生殖活动[3-7],从而有利于自身的生存与传播,并影响寄主的生殖行为。此外也有研究表明Wolbachia能保护寄主抵御病原菌和寄生虫等的侵害[8]。Wolbachia还能依靠寄主的捕食、寄生等行为在昆虫的个体、群体间进行横向传播[9-10]。
早期的研究多用DAPI染色法和电镜观察昆虫体内的 Wolbachia[11-12]。随着分子生物学方法的快速发展,主要利用其16S/23SrDNA、groEL、ftsZ和wsp等基因进行PCR检测与序列分析[13]。编码表面蛋白的Wolbachia outer surface protein(wsp)基因是已知的Wolbachia基因中进化最快的基因,因而被广泛地用于Wolbachia的PCR检测与分子鉴别[14]。根据分子系统发生,Wolbachia的不同种属被划分为11个超群(supergroups A~K),节肢动物中的Wolbachia主要划分在A和B超群,并在两超群下又细分为12个组[14]。
水稻是我国最重要的粮食作物之一,水稻生产的丰歉直接影响我国的粮食安全。自20世纪60年代中期起,稻田3种飞虱(褐飞虱、白背飞虱和灰飞虱)陆续成为影响我国水稻生产的重要生物灾害。同时灰飞虱还可以在水稻、小麦、玉米上传播水稻条纹病毒和水稻黑条矮缩病毒,引起的病毒病造成更为严重的损失[15]。长期以来国内外把研究重点放在与应急防治密切相关的技术研发上,而对与稻飞虱灾变和持续治理相关的生物学和生态学基础研究较少。特别是灰飞虱与内共生菌、病毒三者之间的相互关系的相关研究还未见报道。本研究的主要目的是检测我国主要水稻产区灰飞虱携带的共生细菌Wolbachia比例,对其wsp基因进行序列测定与比较,为深入研究稻飞虱与其体内共生物的关系,揭示Wolbachia对共生昆虫的作用机制奠定基础。
1 材料与方法
1.1 虫源材料
本试验所采用的灰飞虱(Laodelphax striatellus Fallen)采集于我国12个省(自治区)21个水稻生产地区(见表1),采集时间为2010-2011年。田间活体采集并进行种类鉴定后,取部分样品按采集地区隔离饲养,剩余样品经液氮冷冻后-80℃冰箱保存备用。
1.2 DNA的提取
灰飞虱总DNA的提取采用Promega公司的Wizard Genomic DNA提取试剂盒,提取方法参考说明书略作改动。取冷冻保存单头灰飞虱经乙醇消毒清洗后,切取腹部组织于1.5mL离心管,加入液氮后用玻璃研棒充分研磨并加入50μL核酸裂解液(nuclei lysis solution)匀浆,直至组织完全破裂,再用100μL核酸裂解液冲洗研棒,混匀后65℃温浴20min。室温冷却,加入1μL RNase,37℃温浴20min,加入80μL蛋白质沉淀剂(protein precipi-tation solution),振荡混匀后冰浴5min,13 000~16 000r/min常温离心6min。取上清于1.5mL离心管中,加入300mL常温异丙醇,轻柔颠倒混匀,13 000~16 000r/min常温离心3min,弃上清,加入75%乙醇,13 000~16 000r/min常温离心2min,再加75%乙醇重复1次,超净台干燥后加入25μL ddH2O,65℃温浴溶解1h,-20℃保存备用。
1.3 PCR扩增
参照Zhou等方法[14]进行Wolbachia的wsp基因的PCR扩增,采取通用引物 wsp-81F:5′-TGG TCC AAT AAG TGA TGA AGA AAC-3′;wsp-691R:5′-AAA AAT TAA ACG CTA CTC A-3′,引物由华大基因公司合成。扩增反应液(25μL体系):模板DNA 1μL,10μmol/L正反向引物各0.5μL,2.5mmol/L dNTP 2μL,5Ur Taq 酶0.25μL,10×buffer 2.5μL,加ddH2O至25μL。在Eppendorf PCR仪中按下列扩增程序进行:95℃预变性5min;95℃变性0.5min,55℃复性0.5min,72℃延伸1min,36次循环;最后在72℃延伸10min;4℃下保存备用。
根据灰飞虱线粒体基因序列(GenBank登录号:FJ360695),设计引物COI-F:5′-ATT TAC CCA CCA CTA TCT-3′;COI-R:5′-TGG AAA TGA GCC ACT ACA-3′用于PCR扩增灰飞虱的COI基因,片段长度为752bp。扩增反应液(25μL体系):模板DNA 1μL,10μmol/L正反向引物各0.5μL,2.5mmol/L dNTP 2μL,5Ur Taq 酶0.25μL,10×buffer 2.5μL,加ddH2O至25μL。在Eppendorf PCR仪中按下列扩增程序进行:94℃预变性3min;94℃变性1min,51℃复性0.5min;72℃延伸1min,36次循环;最后在72℃延伸10min,4℃下保存备用。
1.4 扩增产物的电泳检测
取PCR特异性扩增产物5μL,在1%的琼脂糖胶上进行电泳检测(电压100V,30min),紫外灯下观察结果并保存,明确Wolbachia的wsp基因与灰飞虱的COI基因是否存在以及扩增片段的大小。
1.5 Wolbachia的wsp基因片段克隆和测序分析
PCR产物纯化后,连接至pMD-18T载体上,转化到DH 5α大肠杆菌感受态中。每个样品选取3个阳性克隆由华大基因公司进行序列测定。
2 结果与分析
2.1 DNA提取与PCR检测
对采集自全国12个省份(自治区)21个地区共167头灰飞虱样品进行Wolbachia测定,以灰飞虱COI为对照。其中16个地区的灰飞虱都100%感染有Wolbachia,5个地区出现非阳性个体,四川遂宁地区感染率最低,平均阳性率为96.41%(见表1)。

表1 不同地区灰飞虱感染Wolbachia情况统计表
2.2 序列测定与分析
对167头灰飞虱中的102头的Wolbachia wsp进行了序列测定,获得的wsp基因的序列长度均为599bp,各地理种群间序列仅存在极小的差异。21个地区群体中都具有相同的wsp序列个体,其中只有3个地区的个体中存在变异。云南大理(YNDL-1)样品的46位存在突变T→C;四川郫县(SCPX-2)样品的231位存在突变A→G,云南保山(YNBS-6)样品的584位存在一个gap。将全国大部分地区Wolbachia一样的wsp序列命名为National-wsp,参照Zhou等[11]Wolbachia的分类,结合NCBI的blast工具,用MEGA v.5对上述序列进行聚类构建系统进化树(图1)。
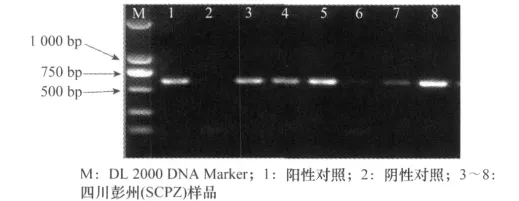
图1 灰飞虱体内Wolbachia的wsp基因的PCR产物电泳图
从系统发育树可以得出,灰飞虱体内Wolbachia在系统进化上属于B超群(supergroup B)内Con组(Group Con)[14]。在地理区域上,国内各地区以及日本、泰国等地的灰飞虱Wolbachia处于同一分支,不存在地理种群的分化。
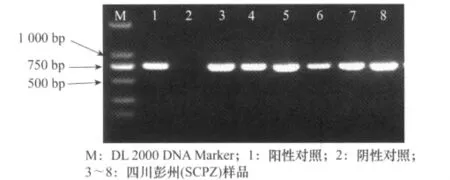
图2 灰飞虱COI基因的PCR产物电泳图
2.3 三种稻飞虱体内Wolbachia的wsp序列分析
利用NCBI数据库,对比褐飞虱体内Wolbachia的wsp基因(GenBank登录号:GU289775,FJ713754,FJ713760,GU289751)序列和白背飞虱体内Wolbachia的wsp基因(GenBank登录号:GU361730,GU361731,GU361731,FJ713766)序列。其中白背飞虱与灰飞虱的序列完全一致,但两者与褐飞虱存在较大差异,序列相似性只有83.39%。由此我们假设白背飞虱与灰飞虱可能感染有相同的Wolbachia(图3所示,B超群下Con组),而褐飞虱可能感染另外一个株系的Wolbachia(图3所示,B超群下Cau组)。系统进化树中与灰飞虱和白背飞虱处于同一分支的还有寄生捻翅虫(Elenchus japonicus Esaki & Hashimoto)、寄生螯蜂(Dryinid wasp),与之相近的还有一种寄生绒茧蜂[Cotesia glomerata(L.)],这些寄生昆虫可能帮助了灰飞虱与白背飞虱体内Wolbachia在其种群内和种群间进行水平传播。但是3种稻飞虱在自然界具有密切交汇,那么三者体内应该携带相似的Wolbachia,然而三者中两者一样而另一种存在差异。
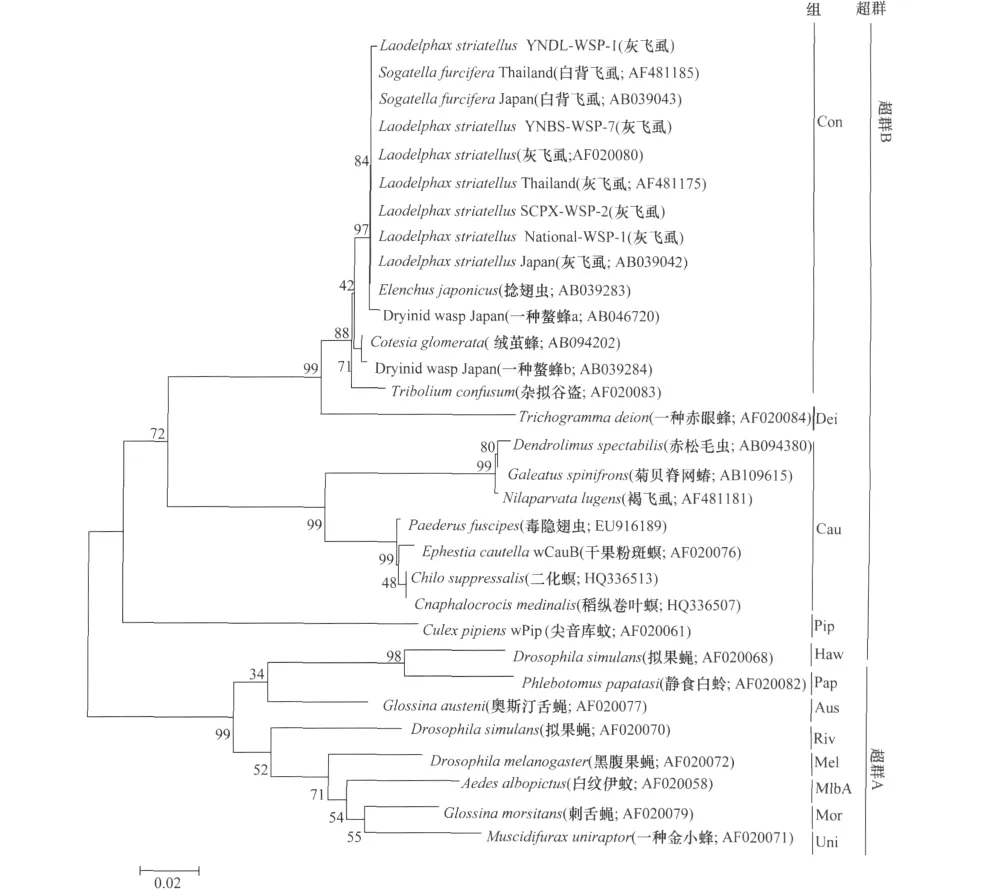
图3 灰飞虱体内Wolbachia与已报道的wsp基因构建系统发育树
3 讨论
通过设计Wolbachia的wsp基因的特异引物,对采集自我国12个省21个地区的灰飞虱进行鉴定,发现我国绝大部分地区灰飞虱都带有Wolbachia,且感染率高。不同地区灰飞虱Wolbachia的感染率存在一定的差异,四川地区的感染率较其他地方相对低,这与甘波谊等[16]的报道相一致。从群体分化来看,灰飞虱体内的Wolbachia为同一群体,不存在明显的地理种群分化,这可能与不同地区的灰飞虱群体可以经常进行基因交流有关。
三种稻飞虱体内的Wolbachia比较发现:灰飞虱与白背飞虱的wsp基因序列完全一致,而与褐飞虱存在较大差异。再次引起我们对Wolbachia如何在自然界进行传播的思考。有报道推测可能与灰飞虱和白背飞虱的寄生蜂(Dryinid wasp)、寄生捻翅虫(Elenchus japonicus Esaki & Hashimoto)有关[10],这两种寄生昆虫可能协助了Wolbachia在两种飞虱之间的水平传播。
三种稻飞虱在自然界具有极其相似的生活环境,寄生螯蜂(Dryinid wasp)和寄生捻翅虫(Elenchus japonicus Esaki & Hashimoto)同为三种稻飞虱的寄生昆虫[16-17],而从本研究得出的系统发育树可以明显看出Wolbachia在三者之间产生了种群分化。此外,从系统发育树中还发现与灰飞虱、白背飞虱处于同一分支的还有杂拟谷盗(Tribolium confusumJacquelin du Val),一种鞘翅目拟步行虫科昆虫。与褐飞虱处于同一分支的还有鳞翅目的赤松毛虫(Dendrolimus spectabilis Butler),寄生于赤松,与褐飞虱的生活习性及分布区域相差很大。怎样的遗传事件使不同的昆虫具有相类似的Wolbachia,而相类似的昆虫群体却具有不同的Wolbachia?当然,仅仅用wsp一个基因是不足以全面反映各宿主的Wolbachia种群的关系的,这只是一方面的推测。Wolbachia在自然界中真实的传播方式还需要从多方位、多角度进一步探索。
[1] Hertig M.The rickettsia,Wolbachia pipientis (gen.et sp.n.)and associated inclusions of the mosquito,Culex pipiens[J].Parasitology,1936,28:453-486.
[2] Hilgenboecker K,Hammerstein P,Schlattmann P,et al.How many species are infected with Wolbachia?-A statistical analysis of current data[J].FEMS Microbiology Letters,2008,281:215-220.
[3] Fine P E M.On the dynamics of symbiote-dependent cytoplasmic incompatibility in culicine mosquitoes[J].Journal of Invertebrate Pathology,1978,31:10-18.
[4] Engelstadter J,Hurst G D D.The ecology and evolution of microbes that manipulate host reproduction[J].Annual Review of Ecology Evolution and Systematics,2009,40:127-149.
[5] Hurst G D D,Jiggins F M.Male-killing bacteria in insects:mechanisms,incidence,and implications[J].Emerging Infectious Diseases,2000,6:329-336.
[6] Rousset F,Bouchon D,Pintureau B,et al.Wolbachia endosymbionts responsible for various alterations of sexuality in arthropods[J].Proceedings of the Royal Society of London Series B-Biological Sciences,1992,250:91-98.
[7] Stouthamer R,Luck R F,Hamilton W D.Antibiotics cause parthenogenetic Trichogramma (Hymenoptera,Trichogrammatidae)to revert to sex[J].Proceedings of the National A-cademy of Sciences of the United States of America,1990,87:2424-2427.
[8] Hurst G D D,Hutchence K J.Host defence:getting by with a little help from our friends[J].Current Biology,2010,20:806-808.
[9] Kittayapong P,Jamgongluk W,Thipaksorn A,et al.Wolbachiainfection complexity among insects in the tropical rice-field community[J].Molecular Ecology,2003,12:1049-1060.
[10] Noda H,Koizumi Y,Qiang Z,et al.Wolbachia infection shared among planthoppers (Homoptera:Delphacidae)and their endoparasite(Strepsiptera:Elenchidae):aprobable case of interspecies transmission[J].Molecular Ecology,2001,10:2101-2106.
[11] O’Neill S L,Karr T L.Bidirectional incompatibility between conspecific populations of Drosophila simulans[J].Nature,1990,348:178-180.
[12] Louis C,Nigro L.Ultrastructural evidence of Wolbachia rickettsiales in Drosophila simulans and their relationships with unidirectional cross-incompatibility[J].Journal of Invertebrate Pathology,1989,54:39-44.
[13] Casiraghi M,Bordenstein S R,Baldo L,et al.Phylogeny of Wolbachia pipientis based on glA,groELand ftsZgene sequences clustering of arthropod and nematode symbionts in the F supergroup,and evidence for further diversity in the Wolbachiatree[J].Microbiology,2005,151:4015-4022.
[14] Zhou W,Rousset F,O’Neill S.Phylogeny and PCR-based classification of Wolbachia strains using wsp gene sequences[J].Proceedings of the Royal Society of London.Series Biological Sciences,1998,265:509-515.
[15] 谢联辉,魏太云,林含新,等.水稻条纹病毒的分子生物学[J].福建农业大学学报,2001,30(3):269-279.
[16] 甘波谊,周伟国,冯丽冰,等.沃尔巴克氏体在中国三种稻飞虱中的感染[J].昆虫学报,2002,45(1):14-17.
[17] Kifune T,Maeta Y.New host records of Elenchus japonicus(Esaki et Hashimoto,1931)(Strepsiptera,Elenchidae)from Japan and the East China Sea[J].Kontyû,1986,54(2):359-360.
