结晶法纯化2′-脱氧腺苷的工艺研究
2012-09-25赵洪娥,崔励
赵 洪 娥, 崔 励
( 大连工业大学 轻工与化学工程学院, 辽宁 大连 116034 )
0 引 言
2′-脱氧腺苷是一种天然的脱氧核苷,是脱氧核糖核酸DNA的结构片段,是基因药物和基因工程研究的重要原材料,具有很好的生理活性,经过化学结构修饰得到的2′-脱氧腺苷类似物具有良好的抗肿瘤活性,因此在市场上有广泛需求[1-2]。2′-脱氧腺苷可通过脱氧核糖核酸的降解而得到,但是由于DNA供应的不稳定,以及降解后产物分离困难等原因,使得该方法并不实用。2′-脱氧腺苷也可通过化学合成法合成,但其步骤过于复杂[3],比如一些基团的保护与去保护以及糖基的活化等[4]。通过生物转化法合成2′-脱氧腺苷,具有步骤简单等优点,避免了以上不足。本实验的原料为2′-脱氧腺苷的生物转化液,其主要成分有核糖基供体2′-脱氧胸苷、碱基供体腺嘌呤、副产物胸腺嘧啶和主产物2′-脱氧腺苷[5-6]。
目前国内外学者对提高2′-脱氧腺苷转化率的研究较多[6-7],有关提取纯化工艺的文献报道却很少。本实验采用结晶法对生物转化液中的2′-脱氧腺苷进行分离纯化、富集,为其工业化生产提供依据。
1 材料与方法
1.1 材料与仪器
乙醇、碳酸钠、盐酸、氢氧化钠、标准品2′-脱氧腺苷,均为分析纯;甲醇,色谱纯;2′-脱氧腺苷生物转化液,实验室自制。
岛津高效液相色谱仪,UV检测器(SPD-10A),C18反相柱(4.6 mm×250 mm,5 μm)。
1.2 实验方法
1.2.1 2′-脱氧腺苷的分离、纯化
预处理:将实验室制得的生物转化液离心(室温,4 200 r/min,10 min)除去菌体,得到上清液,其中2′-脱氧腺苷的质量浓度为10.5 g/L,腺嘌呤质量浓度2.3 g/L,胸腺嘧啶质量浓度3.1 g/L,于4 ℃保存备用。
将预处理得到的生物转化液调至一定pH范围内,冷却静置一段时间分离杂质碱基,抽滤分离析出的固体,60 ℃烘干称重。
将除去大量碱基后的生物转化液进行浓缩,然后在碱性范围内调节pH,冷却静置一段时间,抽滤得2′-脱氧腺苷粗品。
以乙醇溶液为溶剂,于60 ℃制成2′-脱氧腺苷的饱和溶液,4 ℃静置重结晶。
1.2.2 HPLC检测分析
2′-脱氧腺苷、2′-脱氧胸苷、胸腺嘧啶(T)、腺嘌呤(A)的质量浓度采用HPLC测定[7],流动相:pH 6.0的5 mmol/L磷酸盐缓冲液与甲醇的体积比为85∶15;吸收波长,254 nm;体积流量,0.8 mL/min。吸取0.5 g/L 2′-脱氧腺苷标准溶液10.0、8.0、6.0、4.0、2.0 mL,分别加去离子水稀释至10.0 mL,测定它们的吸光度值,得2′-脱氧腺苷标准曲线:
y=0.035 7xR2=0.999 6
式中,x为dA峰面积×10-3;y为dA的质量浓度(mg/L)。
胸腺嘧啶(T)、腺嘌呤(A)标准曲线的作法同2′-脱氧腺苷,得标准曲线方程:
y=0.063 2xR2=0.999 1
式中,x为T峰面积×10-3;y为T的质量浓度(mg/L)。
y=0.059 1xR2=0.999 3
式中,x为A峰面积×10-3;y为A的质量浓度(mg/L)。
2 结果与讨论
2.1 分离碱基pH的确定
用1.0 mol/L的NaOH、HCl溶液分别调节生物转化液的pH,考察pH对分离碱基的影响,实验结果见图1。由图1可以看,当pH为7.0时,碱基析出率达最高值,且实验发现2′-脱氧腺苷损失低于2%,由此确定碱基的最佳析出pH为7.0。
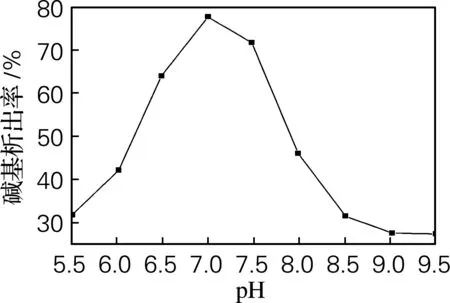
图1 pH对碱基析出率的影响
2.2 分离碱基冷却时间的确定
由图2可以看出,在冷却时间24 h内,随着时间的增加,碱基的析出率增加明显,当冷却时间超过24 h后,碱基析出率几乎不再增加。由此可确定,分离碱基适宜的冷却时间为24 h。

图2 冷却时间对分离碱基的影响
2.3 2′-脱氧腺苷结晶pH的确定
将分离部分碱基后生物转化液调至碱性范围内,使2′-脱氧腺苷在其等电点附近析出。实验结果见图3。
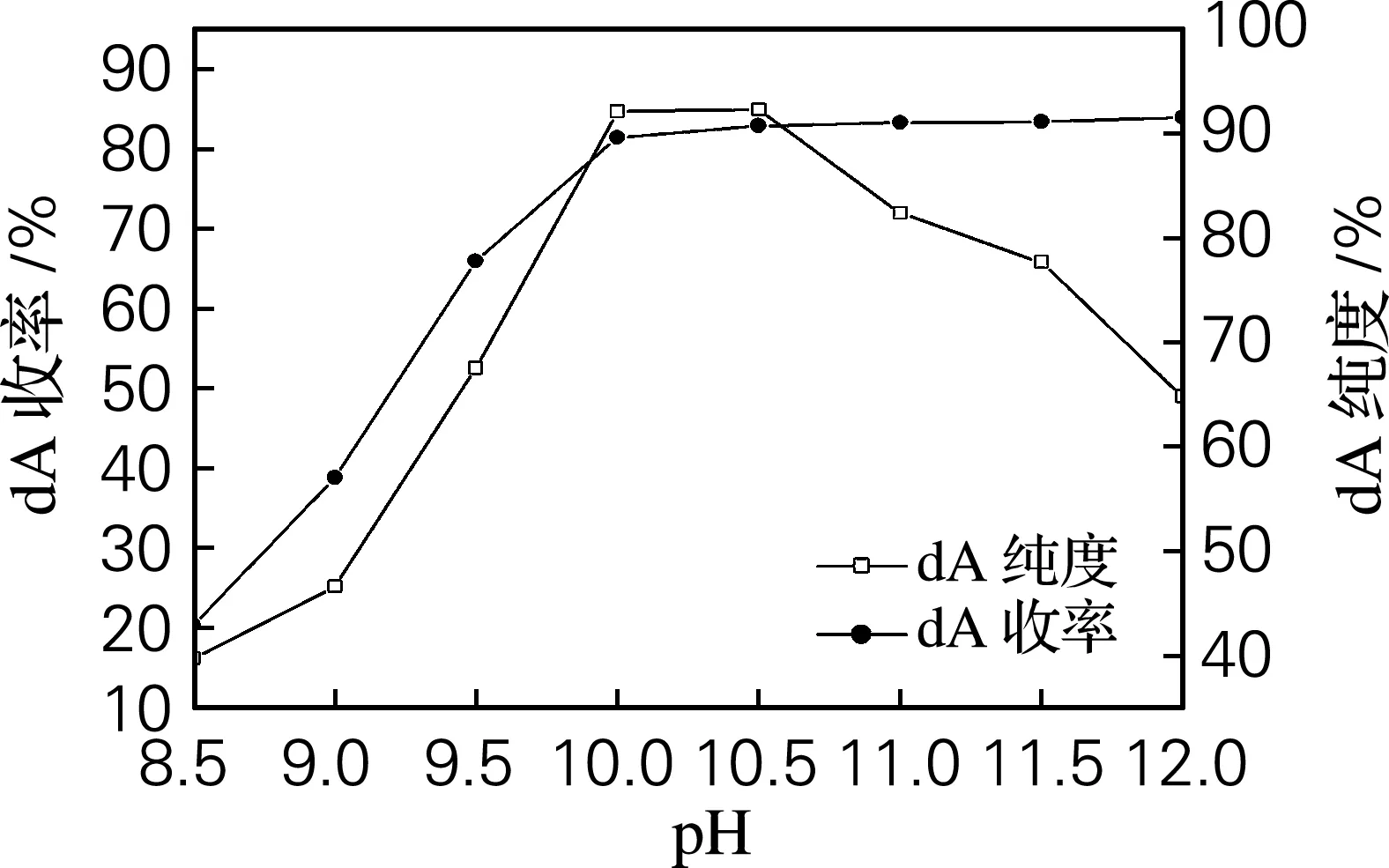
图3 pH对2′-脱氧腺苷结晶的影响
由图3可知,当pH为10.0、10.5时,2′-脱氧腺苷的析出率和纯度均相差不多,综合考虑,确定2′-脱氧腺苷结晶的适宜pH为10.0。
2.4 生物转化液质量浓度的确定
浓缩生物转化液以调节2′-脱氧腺苷在生物转化液中的质量浓度,使其处于较高的质量浓度,且碱基的质量浓度较低,以便得到纯度和收率均较高的2′-脱氧腺苷晶体。
由图4可知,随着生物转化液有效物质质量浓度的增加,2′-脱氧腺苷收率增加,但纯度有所下降。综合考虑2′-脱氧腺苷收率、纯度和生产耗能量,生物转化液浓缩至2′-脱氧腺苷的质量浓度为 50 g/L时进行结晶较适宜。
图4 生物转化液质量浓度对2′-脱氧腺苷结晶的影响
Fig.4 Effect of the concentration on dA crystallization
2.5 2′-脱氧腺苷结晶时间的确定
由图5可见,随着结晶时间的增加,粗品中2′-脱氧腺苷的收率稍有增加,但纯度却有所降低,综合考虑结晶纯度与收率,最终结晶时间确定为6 h,结晶得到的2′-脱氧腺苷收率和纯度均较高。

图5 结晶时间对2′-脱氧腺苷析出的影响
2.6 2′-脱氧腺苷粗品的重结晶
以体积分数20%的乙醇为溶剂,制成2′-脱氧腺苷质量浓度为52.0 g/L的溶液,4 ℃进行重结晶。产品总收率可达62%,纯度≥99%,产品HPLC图谱如图6。
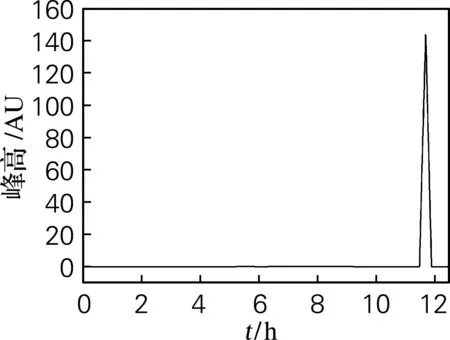
图6 重结晶产品的HPLC图
3 结 论
实验采用结晶法分离纯化生物转化液中的2′-脱氧腺苷,得到的最佳工艺为:除杂质碱基适宜的pH为7.0,时间24 h;原液经浓缩至有效物质量浓度为50.0 g/L;2′-脱氧腺苷粗品的结晶pH为10.0,时间6 h,以体积分数20%的乙醇为溶剂进行重结晶,纯品总收率达62%,利用高效液相色谱法检测2′-脱氧腺苷,纯度99%。该法较之其他方法如柱层析法简便易行、成本低,易于工业化。
[1] LIANG Shenghua, LI Wenzhou, GAO Tong, et al. Enzymatic synthesis of 2′-deoxyadenosine and 6-methylpurine-2′-deoxyriboside byEscherichiacoliDH5α overexpressing nucleoside phosphorylases fromEscherichiacoliBL21[J]. Journal of Bioscience and Bioengineering, 2010, 110(2):165-168.
[2] 岳明,倪孟祥. 常用的核苷类化合物分离技术及应用[J]. 药学进展, 2006, 30(10):442-447.
[3] GOYAL R N, DHAWAN A. Oxidation chemistry of 2′-deoxyadenosine at pyrolytic graphite electrode[J]. Bioelectrochemistry, 2006, 69(2):223-233.
[4] 蒋忠良,李乾坤,齐湘兵,等. 2′-脱氧腺苷全合成研究[J]. 同济大学学报, 2007, 35(9):1264-1268.
[5] KENZO Y, TAKASHI T. A novel enzymatic method for the production of purin-2′-deoxyribomuclosides[J]. Journal of Molecular Catalysis B:Enzymatic, 2000, 10:207-213.
[6] 洪云海,丁庆豹,邱蔚然,等. 应用乙酰短杆菌酶法合成2′-脱氧腺苷[J]. 工业微生物, 2006, 36(1):30-32.
[7] ZINCHENKO A I, BARAI V N, BOKUT S B, et al. Enzymatic synthesis of 2′-deoxyadenosine[J]. Biotechnology Letters, 1991, 13(2):87-90.
