绞股蓝皂苷糖苷酶的分离纯化及酶性质的研究
2012-09-25毛泽仁,张景,金凤燮,鱼红闪
毛 泽 仁, 张 景, 金 凤 燮, 鱼 红 闪
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034; 2.大连市产品质量监督检验所, 辽宁 大连 116021 )
0 引 言
绞股蓝中含有多种化学成分[1-2],其中以绞股蓝皂苷为主要的药理活性成分。绞股蓝皂苷(Gypenosides)是绞股蓝全草的有效成分,具有多种医疗保健功能[3]。自然界中绞股蓝皂苷多是由绞股蓝皂苷元与葡萄糖、半乳糖、鼠李糖、木糖及阿拉伯糖等糖基连接而成,这种结构不是其生物活性的最佳状态,若将其转化为低糖基皂苷或皂苷元,它的生物活性有可能会得到提高。
本实验室前期筛选出的Absidiasp. GYP4r菌,能够产生一种可将绞股蓝皂苷水解为低糖基绞股蓝皂苷的酶[4],该酶有可能提高绞股蓝皂苷的生物活性。本实验对绞股蓝皂苷糖苷酶的分离纯化及性质进行了研究,为今后绞股蓝皂苷糖苷酶的分子生物学性质进一步研究提供了一定的理论基础。
1 材料与方法
1.1 材 料
实验菌种Absidiasp.GYP4r,由大连工业大学菌种保藏所提供;绞股蓝皂苷;人参皂苷标准品,实验室自制;薄层层析板,德国Merk公司提供。
1.2 方 法
1.2.1 培养基的制备
斜面培养基的制备:准确称取硝酸钠3.0 g,磷酸二氢钠1.0 g,七水合硫酸镁0.5 g,氯化钾0.5 g,硫酸钾0.5 g,硫酸亚铁0.01 g,蔗糖30.0 g,琼脂15 g,用去离子水定容至1 000 mL,121 ℃湿热灭菌后备用。
扩大培养基的制备:称取麦麸16.0 g,槐花4.0 g(作为诱导物),溶于20 mL去离子水中,121 ℃ 湿热灭菌后待用。
1.2.2 菌种的培养及粗酶液的提取
将菌种接种于已灭菌的斜面培养基中,在30 ℃的恒温箱中培养6~7 d,活化后的菌放于冰箱内保存。将斜面菌种接种于已灭菌的扩大培养基中,仍在30 ℃的恒温箱中培养6~7 d。待菌长好后将培养基浸泡于100 mL 0.02 mol/L pH 5.0的醋酸-醋酸钠缓冲液中2 h,边浸泡边搅拌,然后将浸泡液过滤。滤液用高速冷冻离心机在8 000 r/min下离心15 min,收集上清液,在磁力搅拌的条件下,缓慢加入已研磨好的硫酸铵粉末至75%饱和度,4 ℃下静置1~2 h。再用高速冷冻离心机在13 000 r/min下离心20 min,弃上清,收集蛋白质沉淀。沉淀用10 mL 0.02 mol/L pH 5.0 醋酸-醋酸钠缓冲液溶解,装入透析袋,用相同的缓冲液透析24 h,约每2 h 更换一次缓冲液。透析结束后,用高速冷冻离心机在13 000 r/min下离心10 min,除去不溶性杂蛋白。所得上清液即为粗酶液,将酶液放于冰箱中保存。
1.2.3 酶活力的测定
取1 mg绞股蓝皂苷,加0.2 mL 95%的乙醇和0.8 mL的0.02 mol/L pH 5.0的醋酸-醋酸钠缓冲液将其溶解,配制成底物,取0.1 mL的底物与0.1 mL的酶液混合,40 ℃下反应24 h,然后加入0.2 mL水饱和正丁醇终止反应,振荡分层后取上层作薄层层析(TLC)分析。展开剂V(氯仿)∶V(甲醇)∶V(水)=7∶3∶0.5;显色剂为10%的浓硫酸。
1.2.4 粗酶液的纯化
用0.5 mol/L的NaOH和0.5 mol/L的HCl反复处理DEAE-cellulose DE52阴离子交换柱,再用0.02 mol/L pH 5.0的醋酸-醋酸钠缓冲液平衡后,向柱子中加入8 mL酶液,然后用60、90、120、180、240、300、400、500、600 mmol/L的KCl梯度洗脱,自动部分收集器以3 min/管的速度收集洗脱液,洗脱液经紫外检测仪在280 nm 下跟踪测定各点的OD值,并通过蛋白质色谱仪绘出吸收图谱。收集各峰值管的酶液,TLC检测酶活力。
1.2.5 酶的分子质量测定
将纯化后的酶溶液经三氯乙酸沉淀,丙酮洗涤后,再用醋酸-醋酸钠缓冲液和上样缓冲液溶解,然后进行SDS-PAGE凝胶电泳,最终得到单一的条带。以已知分子质量的标准蛋白为参照,根据蛋白质的迁移率与其分子质量的对数的关系绘制出标准曲线,确定纯化后酶的分子质量。
1.2.6 酶学特性的研究
采用绞股蓝皂苷糖苷酶的酶活力测定方法,对酶反应的条件进行研究,确定酶反应最适温度和最适pH,研究金属离子对酶的影响,计算出绞股蓝皂苷糖苷酶的动力学方程参数。
2 结果与讨论
2.1 绞股蓝皂苷糖苷粗酶的活力检测
以20%的槐花为诱导物配制培养基装入三角瓶中,121 ℃湿热灭菌20 min,无菌条件下接入菌种Absidiasp.GYP4r数环,30 ℃ 下培养6~7 d,提取粗酶液备用。配制1 mg/mL 的绞股蓝皂苷0.1 mL作为底物与等体积的粗酶液在40 ℃ 下反应24 h后,向反应液中加入0.2 mL的水饱和正丁醇溶液终止反应,经过短暂离心后,取上层(正丁醇层)TLC点板,并与底物作对比。由检测的结果图1可知,该粗酶液具有酶活力。

底,绞股蓝皂苷底物;1、2,底物与粗酶液反应产物
图1 绞股蓝皂苷的酶解薄层层析图
Fig.1 Result of enzyme reaction of gypenosidase
2.2 绞股蓝皂苷酶的纯化与分子质量的检测
纯化柱经过碱酸反复处理,醋酸-醋酸钠缓冲液平衡后,向柱中加入0.8 mL 粗酶液,先用少量的醋酸-醋酸钠缓冲液将未吸附的蛋白质洗脱下来,然后用不同浓度的KCl梯度洗脱,同时以3 min/ 管的速度收集洗脱液,并检测OD值,得到相应的洗脱曲线如图2所示。
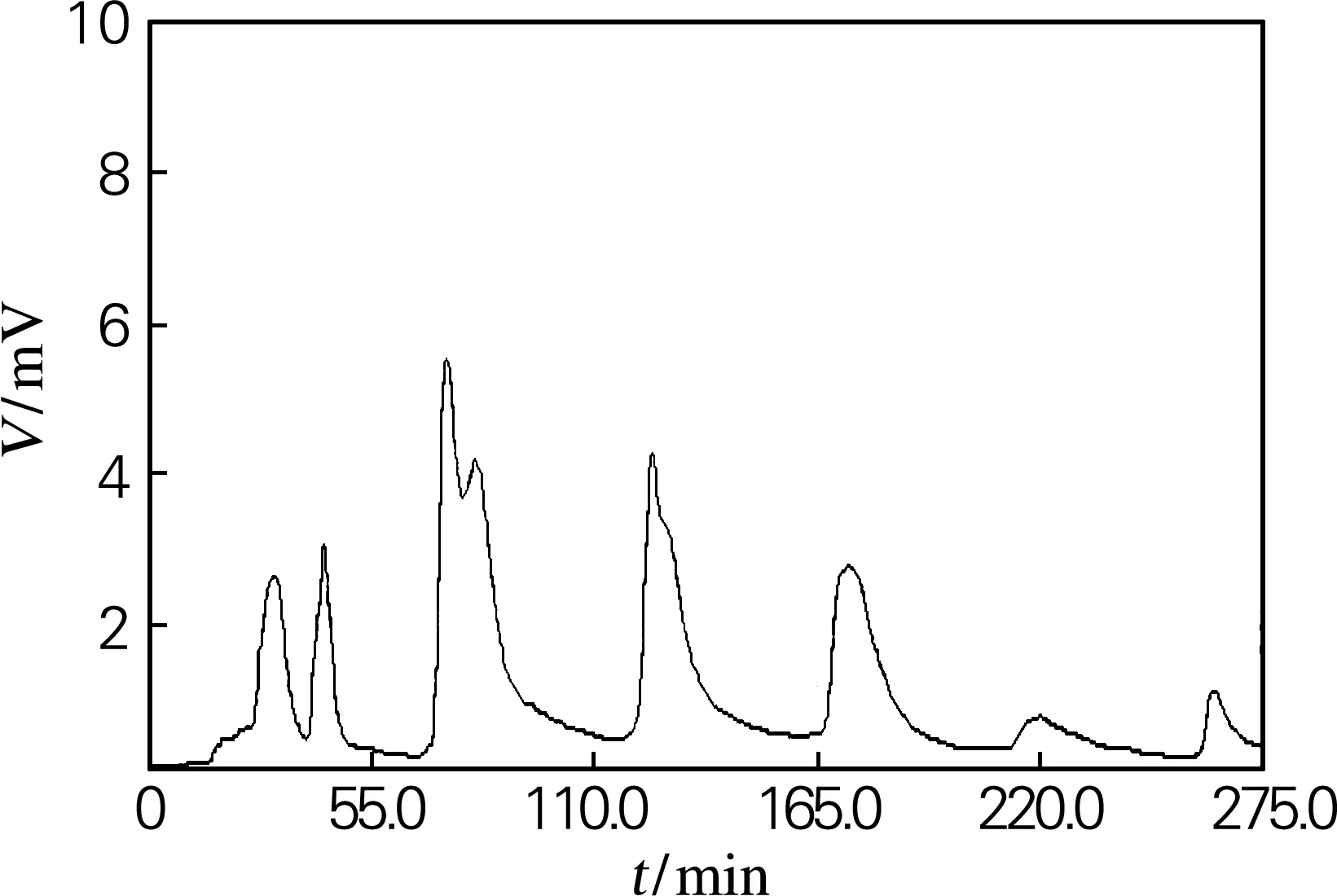
图2 绞股蓝皂苷酶梯度洗脱曲线图
取各个吸收峰的峰值管收集的洗脱液0.1 mL,与等体积的绞股蓝皂苷底物在pH 5.0,40 ℃下反应24 h,然后加0.2 mL水饱和正丁醇终止反应,取正丁醇层,TLC点板结果如图3所示,16、19管收集的酶液具有相对较强的酶活力。

底,绞股蓝皂苷底物;16、19,纯化后收集酶液的管号
图3 提纯后的酶薄层层析图谱
Fig.3 The layer chromatogram of purified enzyme activity
分别取14~22号管收集的酶液0.8 mL加0.36 mL三氯乙酸,4 ℃静置沉淀10 min,4 ℃下离心5 min,倒掉上清,用滤纸吸掉残余的水分,向其中加入50 μL的丙酮,4 ℃下离心5 min,弃丙酮并用滤纸吸干,加50 μL醋酸-醋酸钠缓冲液和等体积的上样缓冲液将蛋白质溶解,煮沸3~5 min。将处理好的样品进行凝胶电泳,检测结果如图4所示,16、19号的酶液得到电泳图谱比较清晰,易于分析。
电泳条带为单带,说明该蛋白质是纯的蛋白质。再根据蛋白质的迁移率与蛋白质分子质量的对数关系绘制出标准曲线,经计算处理得到回归方程logY=5.0-0.91X,再将待测的蛋白质迁移率代入方程中,计算出纯化后蛋白质的分子质量约为68 ku。

16、19为提纯后的酶
图4 绞股蓝皂苷提纯酶SDS-聚丙烯酰胺凝胶电泳图
Fig.4 Polyacrylamide gel SDS electrophoreses of purified gypenosidase
2.3 酶的最适pH 及稳定性的研究
分别配制0.02 mol/L pH为2.2、3~10的缓冲液,将绞股蓝皂苷溶解作为底物,40 ℃下保持30 min,取0.1 mL的酶液与等体积的底物混合,40 ℃下反应24 h,然后加0.2 mL的水饱和正丁醇终止反应,振荡分层后取上层作薄层层析,检测相对酶活力,绘制pH的稳定性曲线如图5所示。由图5可以看出,酶反应的最适pH为5,在pH 2.2~8.0相对酶活力大于50%,此范围即为酶的pH稳定范围。

图5 绞股蓝皂苷糖苷酶的最适pH及稳定性曲线
2.4 酶的最适温度及稳定性的研究
在pH 5.0的条件下,取0.1 mL绞股蓝皂苷底物与等体积的酶液混合,分别在20~80 ℃下反应24 h,然后加0.2 mL的水饱和正丁醇终止反应,振荡分层后取上层作薄层层析,检测相对酶活力,绘制温度稳定曲线如图6所示。由图6可知,在温度为40 ℃时相对酶活力和酶活均为最高,因此确定酶反应的最适温度为40 ℃,相对酶活力大于50%的区间为20~60 ℃,此区间即为酶的温度稳定性区间。

图6 绞股蓝皂苷糖苷酶的最适温度曲线
Fig.6 Optimal temperature and temperature stability of gypenosidase
2.5 金属离子对绞股蓝皂苷糖苷酶的影响
以绞股蓝皂苷作为酶反应底物,向反应体系中加入不同浓度的7种金属离子,在pH 5.0、40 ℃ 下反应24 h,薄层层析检测,计算相对酶活力,结果如表1所示。由表1可以看出,Na+、K+、Mg2+、Zn2+、Ca2+、Fe3+对绞股蓝皂苷糖苷酶的影响不大,而Cu2+对该酶有一定的抑制作用,并且抑制作用随着Cu2+的浓度的增大而增强,当Cu2+浓度达到200 mmol/L的时候,绞股蓝皂苷糖苷酶的相对酶活力降至45.5%。
表1 金属离子对绞股蓝皂苷糖苷酶相对酶活力的影响

Tab.1 Effect of metal ions on enzyme relative activity %
2.6 绞股蓝皂苷糖苷酶米氏常数的测定
将1、2、4、6、8 mg/mL不同质量浓度的底物与酶液反应,薄层层析检测酶活力,绘制米氏常数双倒数曲线,如图7所示。根据图7得到双倒数曲线方程为1/V=30.83/S+2.17,其中Vmax=0.46 mmol/(L·h),Km=14.20 mmol/L。

图7 绞股蓝皂苷糖苷酶的Lineweaver-Burk图
3 结 论
由Absidiasp. GYP4r菌所产的绞股蓝皂苷糖苷酶,经柱纯化后,SDS-PAGE检验得到单带,证明其为纯酶,分子质量约为68 ku。
酶的性质研究结果表明,该酶的最适pH为5.0,酶反应最适温度为40 ℃;该酶在20~60 ℃,pH 2.2~8.0酶活力相对稳定。Na+、K+、Mg2+、Zn2+、Fe3+、Ca2+对该酶没有影响,Cu2+对酶活力有一定的抑制作用。该酶的米常数值为14.20 mmol/L,最大反应速率为0.46 mmol/(L·h)。
以上研究结果为今后绞股蓝皂苷糖苷酶的开发利用及制备高活性低糖基绞股蓝皂苷提供了参考依据。
[1] 侯慧丽,傅童生. 绞股蓝的化学成分与药理作用研究进展[J]. 动物医学进展, 2006, 27(增刊):59-61.
[2] 沈宏伟,肖彦春,车仁国,等. 绞股蓝化学成分研究的现状[J]. 时珍国医国药, 2008, 19(7):1561-1564.
[3] MEGALLI S, AKTAN F, DAVIES N M, et al. Phytopreventative anti-hyperlipidemic effects of Gynostemma pentaphyllum in rats[J]. Journel of Pharmacy & Pharmaceutical Science, 2005, 8(3):507-515.
[4] 柳海,杨宇,金凤燮,等. 绞股蓝皂苷酶转化产物的分离纯化及鉴定[J]. 大连工业大学学报, 2010, 29(2):98-100.
(LIU Hai, YANG Yu, JIN Feng-xie, et al. Isolation and identification of gypenoside in gypenoside hydrolysate[J]. Journal of Dalian Polytechnic University, 2010, 29(2):98-100.)
