海洋假单胞菌胞外多糖的抗氧化性
2012-09-25孙红梅,张星星,白玉,王际辉,王晗,肖珊,叶淑红
孙 红 梅, 张 星 星, 白 玉, 王 际 辉, 王 晗, 肖 珊, 叶 淑 红
( 大连工业大学 辽宁省食品生物技术重点实验室, 辽宁 大连 116034 )
0 引 言
多糖在自然界高等植物、藻类、细菌及动物体内均存在,分布极广,通常来源于植物和藻类的多糖较为普遍[1]。近年来,微生物多糖由于其来源广泛、不受季节及地域的限制,越来越受到人们的关注。微生物多糖按其存在形式可分为胞内多糖、胞壁多糖和胞外多糖。海洋微生物由于其特殊的生活环境,导致其体内多糖的合成过程与陆地生物有所不同,具有产生结构新颖、功能独特的新型活性胞外多糖的潜力。
抗氧化剂是一种重要的食品添加剂,它主要用于阻止或延缓油脂的自动氧化,还可以防止食品在贮藏中因氧化而使营养损坏、褐变、褪色等[2]。以天然抗氧化剂取代合成抗氧化剂是今后食品工业的发展趋势,开发广谱、高效、成本低廉的天然抗氧化剂将是抗氧化剂研究的重点。
近几年来,越来越多的研究表明许多生物多糖及复合物具有良好的抗氧化作用,能够提高抗氧化酶活性并清除自由基,是一种天然抗氧化剂[3]。此外,一些多糖还具有抗衰老、抗肿瘤、抗辐射等作用。这些生理学功能虽然各自有着不同的代谢机理,但可能直接或间接与其抗氧化性有关。目前, 对植物多糖、海藻多糖和真菌多糖的研究较深入,而对于海洋来源的细菌胞外多糖的抗氧化性报道较少[4]。本研究利用海洋假单胞菌发酵,对其产生的胞外多糖的还原能力、清除羟自由基、清除DPPH自由基和清除超氧阴离子自由基做了初步研究,为天然抗氧化剂的研究和开发奠定了一定的基础。
1 实 验
1.1 材料与试剂
1.1.1 材 料
海洋假单胞菌PT-8,深海海泥中筛选所得;
种子培养基:葡萄糖5 g,牛肉膏3 g,蛋白胨10 g,氯化钠5 g,水1 000 mL,121 ℃灭菌 20 min;
发酵培养基:蔗糖25 g,牛肉膏25 g,氯化钠55 g,K2HPO41 g,MgSO41 g,KH2PO40.5 g,MnSO40.5 g,水1 000 mL,pH 7.5,121 ℃灭菌 20 min。
1.1.2 试 剂
1,1-二苯基苦基苯肼(DPPH),Sigma公司产品;番红花红、邻苯三酚、邻苯三酚、硫酸亚铁、三氯乙酸、过氧化氢、无水乙醇,均为分析纯。
1.2 胞外多糖的制备
种子培养基内接一环菌,30 ℃培养24 h →4%接种量转入发酵培养基30 ℃培养48 h→发酵液离心(3 800 r/min,20 min),收集上清液→上清液加3倍体积95%乙醇→4 ℃冰箱沉降过夜→离心(4 000 r/min,10 min)→多糖沉淀加适量水溶解→Sevag法去蛋白3次→上清液加3倍体积95%乙醇→4 ℃冰箱沉降过夜→离心(4 000 r/min,10 min)→弃上清液后将沉淀溶于适量水透析→冷冻干燥得粗多糖。
用蒽酮硫酸法[5]测定多糖含量。
1.3 多糖还原力的测定
取不同浓度样品溶液1.0 mL,加入磷酸盐缓冲液(0.2 mol/L,pH 6.6)和1%铁氰化钾溶液各2.5 mL;50 ℃水浴保温20 min,冷却后加入2.5 mL 10%的TCA终止反应;离心取上清液2.5 mL,加入2.5 mL去离子水和0.5 mL 0.1%三氯化铁溶液,静置10 min,以去离子水作参比,测定700 nm的吸光度值,吸光度值越大表示还原力越强。以同样浓度的维生素C作为阳性对照[6-7]。
1.4 多糖对羟自由基(·OH)的清除作用
取磷酸盐缓冲溶液(0.15 mol/L,pH 7.4)1.0 mL、番红花红溶液(0.52 mg/mL)0.1 mL,0.1 mol/L EDTA Na2-Fe2+1.0 mL,加入样品溶液7.0 mL,最后加入6%的过氧化氢溶液0.8 mL,混匀后于40 ℃水浴中保温30 min,冷却后在520 nm处测定吸光值(A1),空白组以等体积去离子水代替样品溶液(A0),对照组以等体积去离子水代替样品溶液和过氧化氢溶液(A2)。以同浓度维生素C代替多糖作对比试验[8-9]。
清除率=(A1-A0)/(A2-A0)×100%
1.5 多糖对DPPH自由基(DPPH·)的清除作用


1.6 多糖对超氧阴离子自由基(O2-·)的清除作用
取4.5 mL Tris-HCl缓冲液(50 mmol/L,pH 8.2)于试管中,在25℃恒温水浴中预热20 min。加入不同浓度的样品溶液0.1 mL,再加入0.4 mL在25℃恒温水浴中早已预热好的邻苯三酚溶液(7 mmol/L)。摇匀,体系在25 ℃恒温水浴精确反应4 min,然后加入2滴浓盐酸(10 mol/L) 终止反应,测溶液在320 nm处的吸光度[11-12]。
清除率=[1-(Ab-Ac)/Aa]×100%
式中,Aa为不加样品、加入邻苯三酚时的吸光度;Ab为加入样品和邻苯三酚时的吸光度;Ac为加入样品而不加邻苯三酚时的吸光度。
2 结果与讨论
2.1 胞外多糖的纯度
用450 mL发酵液制备胞外多糖,冷冻干燥后得粗多糖2.5 g,取0.1 g溶于100 mL水,即1 mg/mL 溶液。通过蒽酮比色法测定溶液中的多糖含量,得吸光度为0.720,代入回归方程得多糖质量浓度为0.698 mg/mL,因此粗多糖的纯度为69.8%。
2.2 还原力的测定
还原力是抗氧化活力的一个重要指标。测定PT-8胞外多糖的还原能力,与维生素C作对比,结果如图1所示。
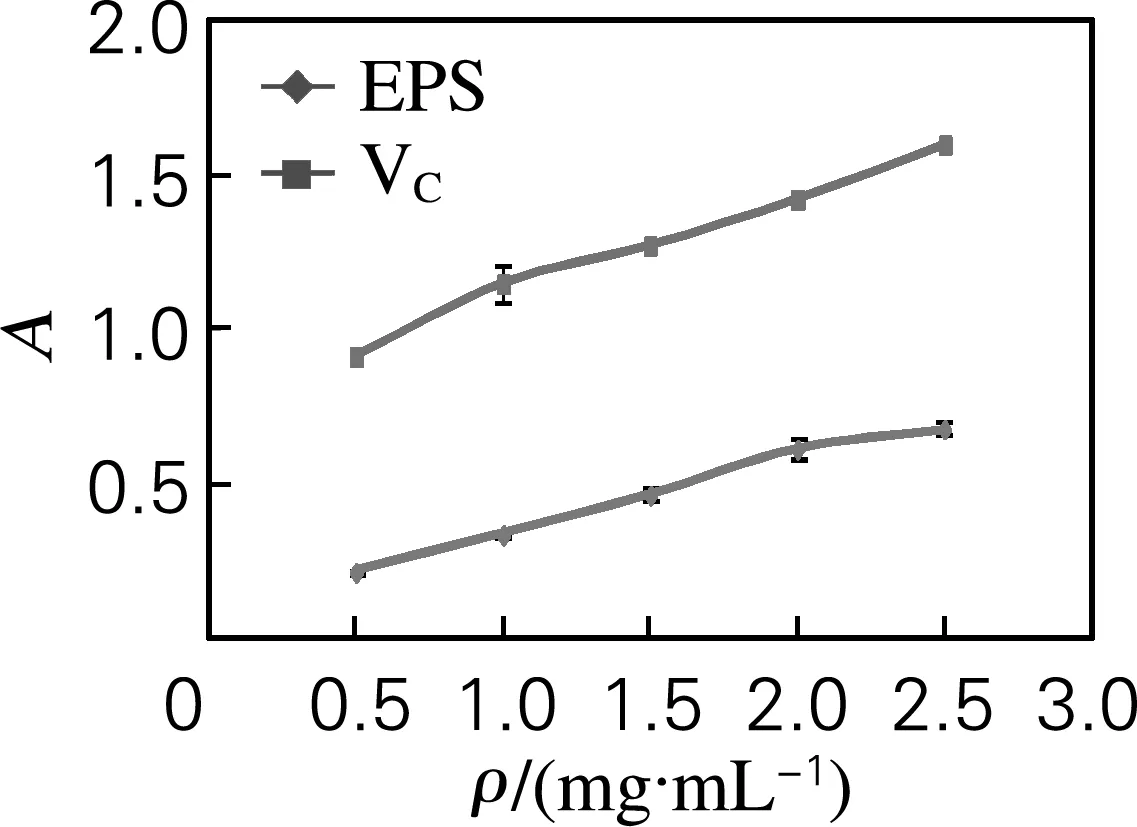
图1 胞外多糖和维生素C的还原力
从图1可以看出,多糖的还原能力虽然低于维生素C,但是也表现出了一定的还原能力,还原力和多糖质量浓度在一定范围内存在较明显的线性关系。
2.3 多糖对羟自由基(·OH)的清除作用
实验利用Fenton反应,由于羟自由基可特异地使番红的红色褪色,根据褪色程度可评价对羟自由基的清除率。选用不同浓度的维生素C和多糖样品,测定清除羟自由基的清除率和浓度的关系,用IC50表示当清除率达到50%所需的样品浓度,结果如表1所示。

表1 多糖和维生素C对羟自由基·OH的清除率
由表1可知,多糖对羟自由基的清除作用比较明显,随多糖浓度的增加而增加并存在一定的量效关系。当清除率达到50%时所需的多糖和维生素C分别为0.161和0.312 mg/mL。可见多糖对羟自由基的清除作用大于维生素C,清除率最高可达95.00%,具有较强的清除羟自由基的能力。
2.4 多糖对DPPH自由基(DPPH·)的清除作用
DPPH(1,1-二苯基苦基苯肼)是一种稳定的自由基,在乙醇溶液中呈深紫色,由于DPPH有个单电子并在517 nm处有强的吸收,当加入具有抑制作用的化合物后,由于其单电子配对而使其特征吸收逐渐消失,其褪色程度与吸收减弱程度呈定量关系,因此可评价抗氧化活性[13]。多糖和维生素C对DPPH自由基的清除作用结果见图2。

图2 多糖和维生素C对DPPH自由基的清除作用
Fig.2 The scavenging of EPSs and VCto DPPH·
由图2可得出,胞外多糖清除DPPH自由基的能力随多糖浓度的增加而增大,清除效果和维生素C相比仍有差距。随着多糖浓度的增大,DPPH自由基清除率逐渐减缓,但仍呈现上升趋势。EPS对除DPPH自由基的清除率随剂量增大而升高,当EPS质量浓度为0.3 mg/mL时,清除率达36.45%。
2.5 多糖对超氧阴离子自由基(O2-·)的清除作用
选取不同浓度的胞外多糖和维生素C测定两者对超氧阴离子自由基的清除率,实验结果如图3所示。

图3 多糖和维生素C对超氧阴离子的清除率
由图3可以看出,多糖对超氧阴离子自由基的清除作用随胞外多糖质量浓度的增加而增加,清除效果与多糖浓度呈现明显的量效关系。当超氧阴离子自由基清除率达到50%时所需的胞外多糖和维生素C的质量浓度分别为0.128和0.141 mg/mL,可见多糖对超氧阴离子自由基的清除能力优于维生素C,具有较强的清除超氧阴离子自由基的能力。
3 结 论
海洋假单胞菌PT-8所产生的胞外多糖具有一定的还原能力,对羟自由基、DPPH自由基、超氧阴离子自由基都有一定的清除作用:表现出较强的清除羟自由基能力,其IC50为0.161 mg/mL,清除能力远远超过了维生素C;多糖在0~0.2 mg/mL对超氧阴离子自由基清除率均随质量浓度增大呈现一定量效关系,高于0.2 mg/mL时其抗氧化能力较维生素C强,表明其具有较高的清除超氧阴离子自由基能力。
自由基被称为“万病之源”,能够引起机体的损伤,而羟基自由基、DPPH自由基和超氧阴离子自由基是最主要的形式。多糖作为天然化合物对3种自由基有明显的清除作用,终止自由基的链式反应达到抗氧化的目的,从而停止、甚至逆转某些由于过量自由基所导致的损伤。同时,原料来源简单、生产周期短、产品绿色,因此海洋假单胞菌PT-8胞外多糖作为天然抗氧化剂有很好的开发前景。
[1] 许冰. 一株芽孢杆菌胞外多糖的抗氧化性研究[J]. 中国酿造, 2010(8):75-77.
[2] 杨洋,韦小英,阮征. 国内外天然食品抗氧化剂的研究进展[J]. 食品科学, 2002, 23(10):137-140.
[3] 纪立金,李奕祺,于晓艳,等. 强脾补精化瘀益智胶囊对多发梗塞性痴呆大鼠自由基的影响[J]. 中华中医药杂志, 2007, 22(3):153-156.
[4] 陈艳丽,任盛,魏国琴,等.Rhizobiumsp.N613胞外多糖的抗氧化活性[J]. 微生物学通报, 2010, 37(2):234-238.
[5] RONEN M, GUTERMAN H, SHABATAI Y. Monitoring and control of pullulan production using vision sensor[J]. Journal of Biochemical and Biophysical Methods, 2002, 51(3):243-249.
[6] DORMAN H J D, HILTUNEN R. Fe(Ⅲ) reductive and free radical-scavenging properties of summer savory (SaturejahortensisL) extract and subtractions[J]. Food Chemistry, 2004, 88:193-199.
[7] 刘莎,叶淑红,王际辉,等. 一株细菌ps-5胞外多糖的抗氧化性研究[J]. 食品科技, 2010, 35(6):111-114.
[8] 李平,王艳辉,马润宇. 山茱萸多糖PFCC Ⅰ抗氧化性能研究[J]. 食品工业科技, 2003, 24(5):34-36.
[9] 刘凤,叶淑红,王际辉,等. 海洋假单胞菌pf-6胞外多糖吸湿保湿和抗氧化性研究[J]. 食品工业科技, 2011, 32(11):68-71.
[10] 胡喜兰,韩兆祥,陶莹,等. DPPH法测定17种植物抗氧化活性[J]. 食品科技, 2006, 31(10):264-268.
[11] 韩伟. 食品微生物抗氧化性能的研究[D]. 南昌:南昌大学, 2008.
[12] 胡昕,余燕影,李华,等. 染料木素、槲皮素及其化学修饰物清除自由基能力研究[J]. 天然产物研究与开发, 2008, 20(2):203-206.
[13] 刘美华. 染料木糖苷的合成及其生物活性研究[D].南昌:南昌大学, 2007.
